Le leggi quantitative che stanno alla base della chimica sono tre: la legge di conservazione delle masse (o anche legge di Lavoisier), la legge delle proporzioni definite (o legge di Proust) ed infine la legge delle proporzioni multiple (ideata da Dalton).
La prima legge venne definita da Lavoisier che, mentre analizzò le varie reazioni chimiche, pensò di pesare le sostanze prima e dopo la reazione, notando che il peso iniziale era lo stesso di quello finale. Infatti, la legge di conservazione dice: “Nulla si crea, nulla si distrugge, tutto si trasforma”, quindi, durante una trasformazione chimica ordinaria non vi è guadagno né perdita apprezzabile di massa (la massa dei reagenti è uguale alla massa dei prodotti).
Tutto ciò, riguarda quindi solo le reazioni chimiche ordinarie. Le altre reazioni, come quelle nucleari, non rispettano la legge di Lavoisier, e le trasformazioni si accompagnano a difetti di massa che si converte in energia.
Proust continuò gli esperimenti di Lavoisier e ideò la legge delle proporzioni definite secondo cui, quando gli elementi si combinano tra di loro per formare dei composti, essi lo fanno secondo proporzioni in peso ben definite. Quindi per formare un composto X, occorre sempre tener conto del giusto rapporto combinatorio delle masse del reagente A e del reagente B.
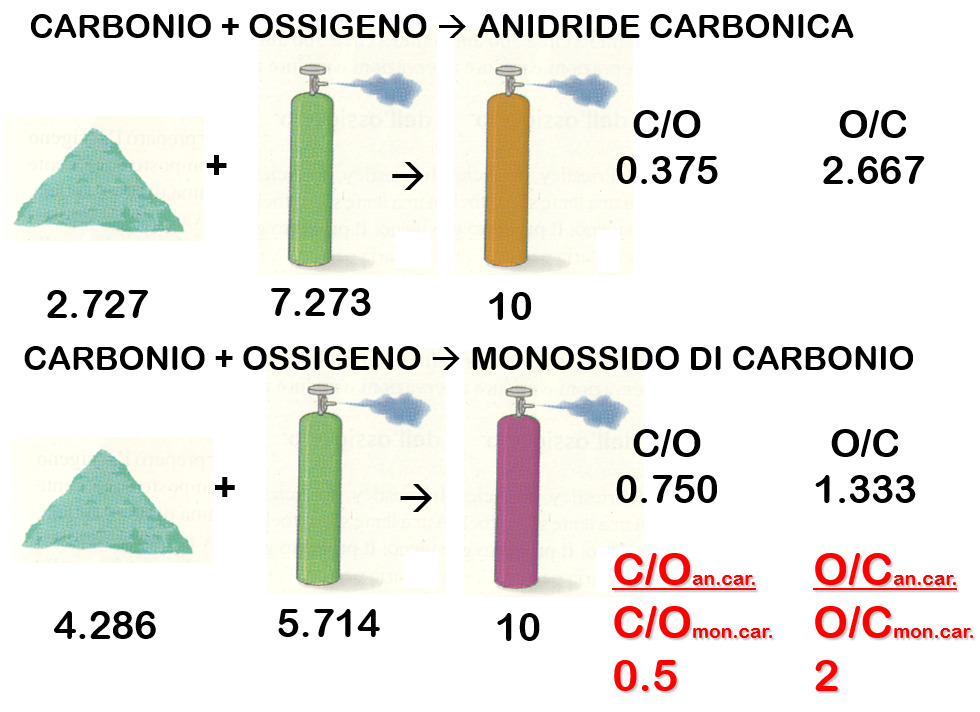
Per esempio, per preparare 44 grammi di anidride carbonica, occorrono 12 grammi di carbonio e 32 grammi di ossigeno. Se invece ne volessi preparare 10, occorrerebbero, in proporzione, 2,727 grammi di carbonio e 7,273 grammi di ossigeno.
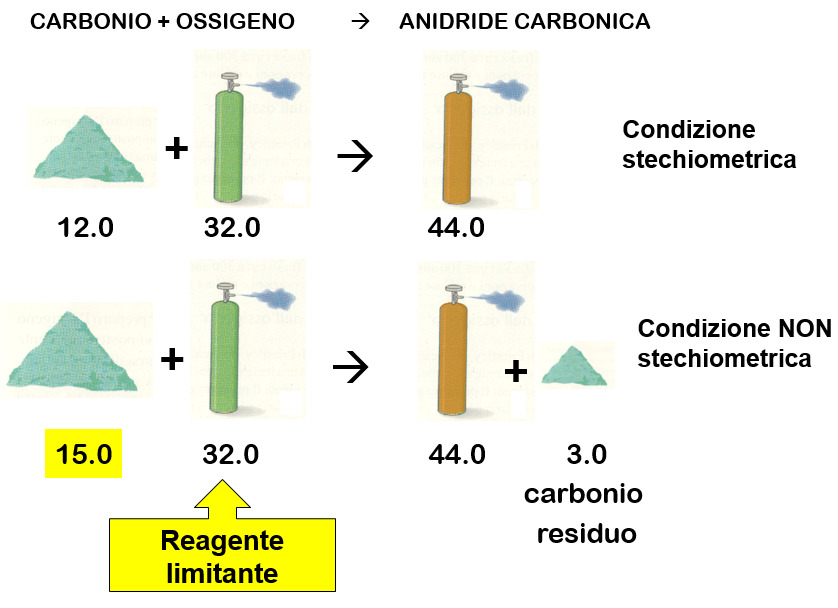
Nei casi in cui si utilizzino perfettamente le dosi di reagente per formare un prodotto, le reazioni sono in condizioni stechiometriche. Invece, nelle condizioni di non stechiometria, un reagente è in eccesso rispetto all’altro e quindi, nella reazione, in parte si consuma, in parte rimane come reagente residuo. Il reagente che si consuma del tutto si chiama reagente limitante.
Nella reazione accanto si può vedere come aumentando la quantità di carbonio non aumenta la quantità di anidride carbonica prodotta, bensì, la quantità in eccesso rimane solo un residuo.
Per incrementare la quantità di anidride carbonica bisognerebbe aumentare anche la quantità di ossigeno in proporzione con la reazione.
Come la legge di Lavoisier, anche la legge di Proust riguarda solo le reazioni chimiche ordinarie.
Infine abbiamo la legge delle proporzioni multiple ideata da John Dalton che dice: “quando due elementi si combinano per formare più di un composto, il loro rapporto in peso in un composto, diviso per il rapporto in peso in uno qualsiasi degli altri composti, è dato da una frazione espressa da numeri interi semplici.
Prendiamo come esempio l’anidride carbonica e il monossido di carbonio. Abbiamo detto che per produrre 10 grammi di anidride carbonica occorrono 2,727 grammi di carbonio e 7,273 grammi di ossigeno, quindi il rapporto Carbonio/Ossigeno in questo caso è 0,375, mentre il rapporto Ossigeno/Carbonio è 2,667. Nel caso del monossido di carbonio, sono necessari 4,286 grammi di carbonio e 5,714 grammi di ossigeno, quindi il rapporto C/O è 0,750, mentre il rapporto O/C è 1,333. Se andiamo a fare il rapporto dei rapporti, il risultato è sempre un numero intero, oppure un numero riconducibile a frazione intera. Infatti 0,375/0,750 è 0,5 (riconducibile ad ½), mentre 2,667/1,333 è 2.
Se assumiamo che il monossido di carbonio sia la sostanza più semplice con una particella di carbonio per ogni particella di ossigeno, vuol dire che nella anidride carbonica vi è una quantità di particelle di ossigeno doppio rispetto a quelle di carbonio ed è possibile definire per questa una formula chimica minima che sarà: CO2. Il monossido di carbonio avrà conseguentemente formula CO.
Sulla base di questo, nel 1804 Dalton scrisse un trattato in cui viene a spiegare la base della legge delle proporzioni multiple.
I quattro punti base in cui si racchiude il trattato sono:
- Gli atomi degli elementi sono le particelle basilari della materia. Essi sono indivisibili e non possono essere né creati né distrutti.
- Gli atomi di un dato elemento sono identici, avendo lo stesso peso e le stesse proprietà chimiche.
- Gli atomi di elementi diversi si combinano tra di loro in rapporti di numeri interi semplici per formare le molecole di composti.
- Gli atomi di elementi diversi possono combinarsi in più di un rapporto di numeri interi semplici per formare più di un composto.
In realtà oggi sappiamo che alcuni di questi punti sono sbagliati in quanto l’atomo può essere diviso in particelle. Inoltre, gli atomi di un dato elemento non sono tutti identici e non hanno le stesse proprietà chimiche, ma ogni elemento può avere diversi isotopi.