ESERCITAZIONE: Cristallizzazione

OGGETTO: Verifica sperimentale sulla cristallizzazione dell’acido benzoico e del Solfato di Rame.
TABELLA:
|
– |
Acido Benzoico |
Solfato di Rame |
|
Massa con impurezze [g] |
15 |
93 |
|
Massa Cristallizzata [g] |
2.52 |
6.25 |
|
Resa % |
16.8 |
6.72 |
FORMULE, CALCOLI e RISULTATI:

STRUMENTI, APPARECCHI e SOSTANZE:
- Pompa elettrica da vuoto;
- Bacchettina di vetro;
- Spatola d’acciaio;
- Piastra elettrica riscaldante;
- Becher;
- Beute con valvole di intercettazione;
- Carta da filtro;
- Imbuto Buchner;
- Filtro a pieghe;
- Termometro;
- Cristallizzatori in vetro pirex;
- Acido Benzoico C6H5COOH;
- Solfato di Rame CuSO4;
- Acqua Distillata (solvente).
RELAZIONE:
CONOSCENZE TEORICHE:
La cristallizzazione è una tecnica di purificazione usata per le sostanze solide che danno quindi cristalli. Il metodo si basa sulla solubilizzazione a caldo delle sostanze in un determinato solvente e precipitazione a temperatura più bassa in modo da ottenere la sostanza pura in forma cristallina. Affinché la purificazione del composto organico abbia successo, le impurezze devono essere insolubili a caldo (si allontanano per filtrazione) oppure completamente solubili anche a freddo.
Il solvente da scegliere è molto importante se si vuole realizzare una corretta cristallizzazione.
E’ risaputo che le sostanze con molecole polari o, addirittura, di natura ionica, si sciolgono in solventi polari, mentre le sostanze costituite da molecole non-polari o di bassa polarità prediligono i solventi apolari. Un buon solvente per la cristallizzazione deve avere le seguenti caratteristiche:
- Non deve reagire col materiale da cristallizzare;
- Deve sciogliere il solido a caldo e poco a freddo;
- Le impurezze devono essere molto solubili a freddo e poco a caldo;
- il punto di fusione del solvente deve essere, preferibilmente, inferiore a 0 °C;
- il solvente deve essere volatile, per poterlo allontanare facilmente dal soluto dopo la filtrazione.
Il solvente da scegliere non dove sciogliere completamente il materiale a temperatura ambiente, ma deve dare una soluzione limpida, per riscaldamento prolungato al punto di ebollizione del solvente e lasciar cristallizzare il solido, per successivo raffreddamento (a temperatura ambiente o a 0 °C).
Talvolta non è possibile ottenere quanto desiderato da un singolo solvente, perciò si provano coppie di solventi con differente polarità.
Per fare ciò, il materiale si scioglie a caldo nella minima quantità del primo solvente, in cui è molto solubile. Quindi, si versa lentamente nel recipiente di cristallizzazione il secondo solvente, nel quale la sostanza da purificare sia poco solubile. Appena la soluzione inizia a diventare opalescente s’interrompe l’aggiunta del solvente meno favorevole. Il successivo, lento, raffreddamento farà precipitare il solido cristallino, che sarà recuperato per filtrazione sotto vuoto.
I vari passaggi della tecnica di purificazione sono i seguenti:
- Sciogliere il soluto. Il materiale da cristallizzare è posto in beuta o provetta, a seconda della quantità. Si addiziona il solvente lentamente, facendo bollire con cautela la soluzione. Si agita con bacchetta di vetro e, se necessario, si aggiunge altro solvente per ottenere una soluzione, all’ebollizione, satura e limpida.
- Filtrare le impurezze solide. La filtrazione si compie solo se la soluzione contiene particelle insolubili, da non confondere con quelle del solido da cristallizzare.
- Decolorare la soluzione. Questa operazione è facoltativa. Le impurezze solubili e colorate sono rimosse per adsorbimento su carbone attivato.
- Il solido cristallizza. La soluzione satura calda si lascia raffreddare lentamente, per ottenere cristalli di dimensioni sufficienti a essere facilmente filtrati.
- Filtrare i cristalli. Il solido cristallino si recupera per filtrazione sotto vuoto su imbuto di Hirsch o Buchner, beuta codata e pompa. Infine, sempre sotto vuoto, si lavano i cristalli raccolti con porzioni ridotte di solvente freddo.
- Essiccare i cristalli. Per rimuovere le ultime tracce di solvente che aderiscono al solido cristallino, si riscalda in stufa il solido posto sul vetrino di orologio o disco di carta da filtro, accertandosi che la temperatura della stufa sia inferiore al punto di fusione del solido.
DESCRIZIONE DELLA PROVA:
L’obiettivo della prova è quello di determinare la massa di due sostanze: l’acido benzoico e il solfato di rame contenenti impurezze, dopo averli purificati mediante il processo della cristallizzazione.

Prima di eseguire la prova si prelevano una certa quantità di acido benzoico e solfato di rame impuri. Nel nostro caso 15 g di acido benzoico e 93 g di solfato di rame. Entrambe le sostanze si portano alla solubilizzazione in un solvente, nel nostro caso l’acqua. Si fanno riscaldare le soluzioni tramite la piastra elettrica in modo da far sciogliere il più possibile le sostanze utili aiutandosi anche con delle bacchettine di vetro per agitare tutte le soluzioni. Si può notare come le impurezze non si sciolgono nell’acqua rimanendo quindi sul fondo. Per eliminare le impurezze solide le si filtrano con il filtro a pieghe inserito in un imbuto, ottenendo alla fine le soluzioni limpide senza precipitati impuri. Queste soluzioni le si conservano in contenitori chiamati appunto cristallizzatori in vetro pirex, particolarmente resistenti a sbalzi termici e con una bocca larga per aumentare la superficie e quindi favorire l’evaporazione del solvente (l’acqua). Per eliminare il solvente non si fa evaporare facendo bollire la soluzione perché la sostanza potrebbe degradare con l’alta temperatura ed inoltre con l’ebollizione si producono sempre degli schizzi (che potrebbero portar via parte della sostanza oltre che del solvente).
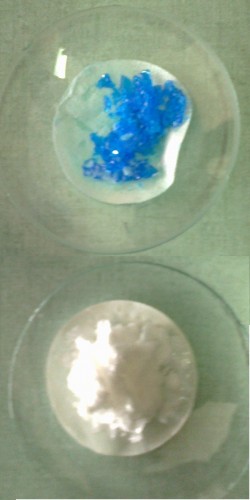
in basso i cristalli di acido benzoico
Si fa evaporare il solvente fino a quando la soluzione è sovra satura e diventa torbida perché si è formato del precipitato. Non si fa evaporare tutto il solvente perché le impurezze che sono solubili nell’acqua rimangono. Invece con la filtrazione successiva si eliminano le impurezze e rimangono le sostanze pure.
La filtrazione viene effettuata con l’aiuto di una pompa elettrica da vuoto perché la filtrazione a pressione normale richiederebbe più tempo. Visto che si utilizza una pompa elettrica è fondamentale inserire una trappola per evitare che i liquidi filtrati vengano risucchiati nella pompa.
L’imbuto utilizzato per la seconda filtrazione è un imbuto Buchner al quale si mette una carta da filtro visto che i suoi buchi sono comunque molto grossi.
Alla fine della filtrazione, le sostanze rimarranno intrappolate sulla carta da filtro, mentre le impurezze sciolte nel solvente entreranno nella beuta.
Le sostanze non sono ancora totalmente pure, hanno bisogno di essere essiccate in una stufa 3-4 ore a 80-90 °C (visto che la temperatura di fusione dell’acido benzoico è di 122 °C) per eliminare tutta l’umidità e poi pesate. Essendo il solfato di rame pentaidrato, con l’essiccazione va via l’acqua di cristallizzazione. Nel nostro caso dopo aver tolto l’acqua, il solfato di rame pesa 6,25 g mentre l’acido benzoico 2,52 g.
Dai risultati si può notare che la resa di entrambe le cristallizzazioni è molto bassa, ma questo valore non influisce sulla qualità. Può darsi che si sia ricavati una massa inferiore di cristalli, ma molto pura.





