La pleura è sede di una grande varietà di neoplasie primitive e metastatiche. In genere, i tumori metastatici sono più frequenti di quelli primitivi. Tra i tumori primitivi della pleura, circa il 90% sono mesoteliomi, mentre le restanti neoplasie sono entità rare.
Il mesotelioma maligno diffuso (MMD) è una neoplasia che origina dalle cellule mesoteliali.
Il tumore è relativamente raro ma in continuo aumento con un picco di incidenza tra gli anni 2010-2020. In Italia l’incidenza è di 4,2 su 100.000 abitanti. In alcune regioni della Turchia, invece, è una vera e propria malattia endemica con una incidenza superiore a 200 casi su 100.000 abitanti per via dell’esposizione a fibre minerali non asbestosiche come la erionite, che si trova comunemente nel terreno.
L’esposizione all’asbesto è il fattore di rischio associato al mesotelioma più comune e più conosciuto. La carcinogenicità dell’asbesto dipende dal tipo di fibra (crocidolite è maggiore del crisotile) ma soprattutto dalle sue proprietà fisiche (diametro e biodegradabilità), dal periodo di latenza dalla prima esposizione e dalle proprietà di superficie delle fibre.
Per quanto riguarda il diametro, studi hanno evidenziato come fibre di dimensioni superiori ad 8 µm sono più comunemente associate al mesotelioma. Studi hanno dimostrato come anche per le varie fibre vari la capacità di persistere nel tessuto dopo decenni dall’esposizione: le fibre di crisotile hanno una elevata clearance e per questo sono molto meno potenti di altre (gli amfiboli) nel causare mesotelioma.
Il tempo di latenza medio dall’esposizione all’asbesto alla diagnosi di mesotelioma è di 30-40 anni. La trasformazione avviene relativamente presto dopo l’esposizione, ma necessita di un lungo periodo di tempo per crescere e dare tumore diffuso in quanto la cellula mesoteliale necessita di almeno 3 distinti danni genetici indotti dall’accumulo di asbesto per portare all’eventuale trasformazione maligna della cellula mesoteliale.
Un fattore di rischio molto importante è rappresentato dalla dose cumulativa: studi hanno dimostrato come il rischio di sviluppare mesotelioma aumenti in modo lineare con l’intensità dell’esposizione e come il tempo di latenza sia inversamente proporzionale alla dose espositiva, cioè più elevata è la dose espositiva, minore è il tempo di latenza.
Le fibre dell’asbesto, che contengono ferro ferroso, hanno proprietà riduttive intrinseche che catabolizzano reazioni con produzione di radicali liberi di ossigeno considerati fattori critici nel processo di induzione del mesotelioma. La crocidolite ha una superficie maggiore e un più alto contenuto di ferro ferroso rispetto al crisotile, risultando biologicamente più attivo nel generare radicali liberi.
Altre cause sono relative a irradiazione terapeutica, esposizione a cancerogeni chimici, infiammazione cronica e fibrosi della pleura. Recentemente è stata dimostrata la presenza di sequenza SV-40 (Simian Virus 40) simili in circa il 60% dei mesoteliomi umani, suggerendo l’ipotesi di un ruolo sinergico del virus nella genesi della neoplasia.
Da un punto di vista patogenetico tre sono i processi cruciali ipotizzati:
- trasporto di fibre inalate alla pleura;
- accumulo nel tessuto subpleurico con risposta granulomatosa, caratterizzata da accumulo di macrofagi e cellule giganti;
- produzione di ROS con effetti genotossici e citotossici nelle cellule mesoteliali con conseguente alterazione negli oncogeni e negli oncosoppressori che vanno ad influenzare la crescita tumorale.
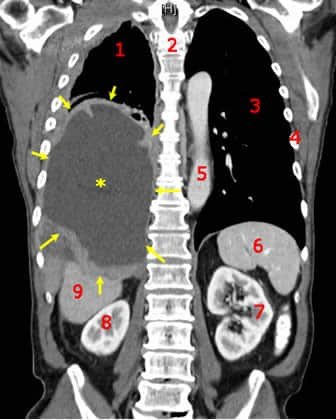
Il mesotelioma maligno presenta un aspetto macroscopico di lesione diffusa che si estende ampiamente nella cavità pleurica ed è di solito associata a versamenti pleurici e ad invasione di strutture toraciche. Ha un aspetto di ispessimento pleurico diffuso per la presenza di una massa dura, bianca che oblitera la cavità sierosa ed incarcera il polmone, usualmente collassato.
Raramente può presentarsi come una massa localizzata (mesotelioma maligno epitelioide localizzato), ben circoscritta, peduncolata o sessile, attaccata alla pleura viscerale o parietale, da non confondere con i tumori fibrosi solitari della pleura.
Il mesotelioma può essere di diversi tipi istologici da cui dipende anche la prognosi:
- Mesotelioma epitelioide. È la forma più frequente (60%) e si presenta con cellule cuboidi, colonnari o appiattite, rade con citoplasma abbondantemente eosinofilo, che formano strutture tubulari o papillari simili all’adenocarcinoma, motivo per cui ne risulta difficoltosa la diagnosi differenziale, sia macroscopicamente che istologicamente. Spesso si riscontrano corpi psammomatosi.
Le caratteristiche che conducono alla diagnosi di mesotelioma sono: colorazione positiva per il mucopolisaccaride acido; nessuna colorazione per l’antigene carcinoembrionario (CEA) e per altri antigeni glicoproteici epiteliali, espressi invece dal carcinoma; colorazione per la cheratina; colorazione positiva per calretinina; presenza di lunghi microvilli e tonofilamenti con assenza di corpi lamellari. - Mesotelioma sarcomatoide. (20%) Ha l’aspetto di un sarcoma a cellule fusate, simile al fibrosarcoma. Dal punto di vista immunoistochimico è però più difficile che sia positivo per CK-5 o 6; le aree di differenziazione condrosarcomatosa o osteosarcomatosa possono mostrare colorazioni positive per actina, desmina, vimentina e/o S100. Molti casi mantengono l’espressione di calretinina. È più aggressivo della forma epitelioide, tant’è che questi pazienti sono esclusi dalla terapia chirurgica.
Questo tipo di tumore presnta due varianti:- Il mesotelioma desmoplastico (10% dei mesoteliomi sarcomatoidi) è una lesione fibrosa diffusa della pleura che consiste in cellule atipiche sparpagliate in un pattern storiforme con aspetti di infiltrazione della parete toracica o del polmone associata o meno alla presenza di focolai di necrosi e metastasi a distanza. Questo sottotipo è spesso mal diagnosticato come pleurite organizzante nei piccoli campioni bioptici.
- Il mesotelioma linfoistiocitoide è una forma molto rara (0,7%) di mesotelioma sarcomatoide che può essere facilmente confuso con il linfoma o lo pseudotumore infiammatorio. Il tumore è composto da cellule di tipo “istiocitoide” e da un denso, diffuso infiltrato di linfociti, plasmacellule, eosinofili e talora cellule xantomatose.
- Mesotelioma misto o bifasico. (20%) Ha sia aspetti epiteliali che sarcomatoidi in percentuali variabili.
I tumori epitelioidi sono associati a una prognosi migliore rispetto ai tumori Bifasici o Sarcomatoidi.
Per quanto riguarda la sintomatologia, quella di esordio è data da dolore toracico, dispnea e versamenti pleurici ricorrenti. Il polmone è invaso per via diretta e spesso vi è diffusione metastatica ai linfonodi ilari e infine al fegato e agli organi distanti.
Il 50% dei pazienti muore a 12 mesi dalla diagnosi, solo pochi sopravvivono a 2 anni.
La diagnosi del mesotelioma maligno è spesso difficile perché il materiale bioptico è spesso scarso e frammentato e gli aspetti morfologici sono molto diversificati e possono simulare condizioni benigne e maligne, inoltre l’istochimica e l’immunoistochimica sono utili ad escludere il mesotelioma ma non nel confermare la sua diagnosi. Molto più utile potrebbe essere una toracoscopia o una pleuroscopia con valutazione macroscopica della pleura e campionamento in più sedi.
Per quanto riguarda la diagnosi differenziale più ricorrente è quella tra mesotelioma e adenocarcinoma. In questo l’immunoistochimica svolge un ruolo importante. Dal momento che non esistono, né per il carcinoma né per il mesotelioma, anticorpi specifici, sono state considerate importanti, a livello diagnostico, un gruppo di immunocolorazioni basate sull’uso di almeno 5 marcatori: uno generico (pancitocheratine), due positivi (calretinina e citocheratine 5/6) e due negativi (TTF-1 e CEA). Nelle forme sarcomatose sono suggeriti le pancitocheratine e la vimentina.
I marcatori positivi sono:
- Le pancitocitocheratine permettono di differenziare il mesotelioma da una metastasi di linfoma, di melanoma e dall’emangioendotelioma, sono però meno specifiche nella diagnosi differenziale con l’adenocarcinoma, anche se la colorazione è citoplasmatica nel mesotelioma e di membrana nell’adenocarcinoma.
- Le citocheratine 5/6 sono espresse nel 90-100% dei mesoteliomi epitelioidi ma non negli adenocarcinomi polmonari (queste citocheratine possono essere espresse nei carcinomi squamocellulari e nei carcinomi a grandi cellule del polmone ma presentano una morfologia molto diversa dal mesotelioma).
- La calretinina si esprime con una positività marcata sia citoplasmatica che soprattutto nucleare (nel 100% dei mesoteliomi) ed è negativa negli adenocarcinomi (debole positività citoplasmatica nel 10% degli adenocarcinomi).
I marcatori negativi sono:
- CEA: Espresso negli adenocarcinomi di polmone e tratto gastrointestinale ma sempre negativo nel mesotelioma;
- TTF-1: Espresso specificatamente nell’adenocarcinoma polmonare ma sempre negativo nel mesotelioma.
La diagnosi differenziale più difficile è con l’iperplasia reattiva mesoteliale. Il marker diagnostico assoluto di malignità è la presenza di infiltrazione stromale profonda, tuttavia sono anche importanti la presenza di strutture papillari e fenomeni di necrosi. L’iperplasia reattiva mostra una marcata cellularità sulla superficie sierosa che tende a diminuire verso lo stroma dove prevalgono aspetti di tessuto di granulazione in superficie e di fibrosi in profondità (zonazione).
Nelle forme reattive è più comune l’espressione di desmina, mentre nelle proliferazioni maligne vengono espresse p53 e EMA.
La stadiazione clinica si basa principalmente su tecniche di imaging tra cui:
- scansioni TC con mezzo di contrasto utilizzate per valutare l’invasione delle strutture adiacenti;
- risonanza magnetica (RM) per identificare l’estensione transdiaframmatica, l’invasione del mediastino e l’invasione multifocale della parete toracica, il coinvolgimento precoce della fascia endotoracica;
- tomografia ad emissioni di positroni (PET) con fluorodesossiglucosio (FDG) ytulizzata successivamente nell’ambito della valutazione preoperatoria e nella strategia di stadiazione iniziale.
L’approccio trimodale è utile per determinare la resecabilità e, insieme alle scansioni di ventilazione e perfusione della medicina nucleare, può quindi essere utilizzato per selezionare il tipo di resezione chirurgica ottimale per il paziente.
Le procedure invasive per la stadiazione includono: laparoscopia, biopsia dei linfonodi extratoracici, agoaspirato transbronchiale sotto guida eco-broncoscopica (EBUS-TBNA) e mediastinoscopia. Tuttavia queste metodiche non sono fatte comunemente a causa del rischio di infezioni e all’incapacità di un piccolo campione di fornire tessuto adeguato per la diagnosi.
La stadiazione patologica si basa sulla resezione chirurgica. Se il tumore non resecabile (T4) viene rilevato durante l’esplorazione chirurgica e impedisce l’accesso ai linfonodi intratoracici, la categorizzazione N completa potrebbe non essere possibile. Il coinvolgimento della fascia endotoracica da parte del tumore è valutato meglio dal chirurgo durante l’intervento, in quanto è difficile da apprezzare istologicamente per i patologi.
Le terapie possibili in caso di mesotelioma sono pneumonectomia extrapleurica (con intento curativo), chemioterapia e radioterapia che sembrano migliorare la prognosi in paziente con mesotelioma epitelioide.
Fonte: Anatomia patologica e correlazioni anatomo-cliniche (Mariuzzi).