La spettrofotometria è una tecnica che si basa sulla capacità di interazione con le onde elettromagnetiche, cioè con la luce, da parte di moltissime molecole, tra cui le proteine che sono tra le biomolecole più rappresentanti che esprimono questa capacità. Lo strumento che permette di condurre questo tipo di analisi è lo spettrofotometro tramite cui è possibile fare delle analisi di tipo innanzitutto qualitativo perché in base alla particolare lunghezza d’onda che viene assorbita da quella sostanza X riusciamo a capire di quale biomolecola si tratta.
Gli aminocidi aromatici fenilalanina, tirosina e triptofano presentano una importante caratteristica spettrofotometrica. La presenza dell’anello benzenico, particolare della catena laterale di questi amminoacidi, giustifica la capacità degli amminoacidi e di conseguenza delle proteine, di interagire con la luce in corrispondenza dell’UV, in particolare come si può notare dal picco, siamo in corrispondenza di 280 nm. Questo grafico riporta la lunghezza d’onda in ascissa e in ordinata il coefficiente di estinzione molare, una sorta di misura della quantità di luce assorbita a quella determinata lunghezza d’onda.
Ci sono tantissime sostanze, anche molto diverse dalle proteine, che riescono a interagire con le onde elettromagnetiche. Le proteine presentano questa particolarità e questa peculiarità è legata alla presenza soprattutto degli amminoacidi aromatici. Anche gli altri amminoacidi, se noi andassimo a registrare lo spettro di assorbimento per altre funzioni chimiche che presentano nella catena laterale, hanno questa capacità di assorbire la luce, però la lunghezza d’onda potrebbe essere differente e la quantità di luce assorbita molto piccola. Quindi, i 3 amminoacidi presi come riferimento per l’assorbanza, ossia per l’assorbimento della luce, sono i 3 amminoacidi aromatici, in particolare il picco più alto è quello del Triptofano, non a caso, perché ha la struttura aromatica più complessa rispetto alla Fenilalanina e alla Tirosina.
Questa caratteristica chimico-fisica degli amminoacidi e delle proteine è importante perché nei laboratori viene utilizzata per rilevare ad esempio la presenza delle proteine in un campione biologico o per dosare la quantità di proteine presente in un mix di reazione che si sta studiando. Questo perché è stata evidenziata una certa correlazione positiva tra la quantità di radiazione luminosa che viene assorbita e la concentrazione del nostro campione, tramite la cosiddetta “Equazione di Lambert-Beer” che mette in correlazione queste grandezze, cioè la quantità di luce assorbita (che viene chiamata anche comunemente Assorbanza, oppure Densità Ottica perché più è denso il campione e maggiore è l’Assorbanza) e la concentrazione del campione. Il logaritmo di I0/I è l’Assorbanza, il contrario dell’Assorbanza è la Trasmittanza, indicata con T. Tanto maggiore è l’assorbanza tanto minore sarà la Trasmittanza e viceversa. Difatti, la Trasmittanza è data dal log di I su I0. I0 è la quantità di luce iniziale che incide, che deve attraversare il campione. I è la quantità di luce trasmessa.
Per fare questo tipo di misurazione occorre uno strumento che si chiama Spettrofotometro. Gli elementi essenziali di uno spettrofotometro sono:
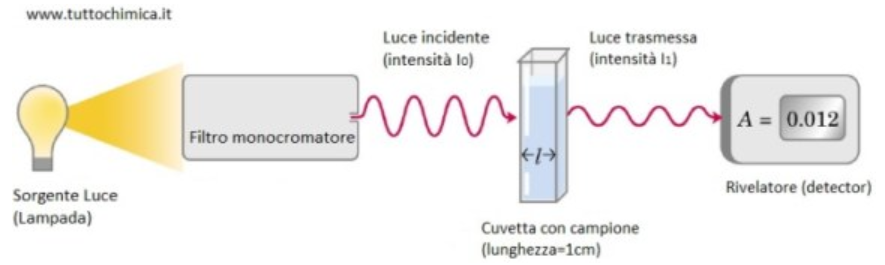
- la sorgente luminosa, una lampada (al Tungsteno, oppure al Deuterio per le radiazioni UV);
- il monocromatore, una parte dello strumento che seleziona una specifica lunghezza d’onda;
- la cuvetta, in cui viene alloggiato il campione biologico che viene fatto attraversare dal fascio di luce incidente. Essa è una sorta di parallelepipedo il cui materiale costitutivo può essere Polistirene, un polimero chimico (quelle in Polistirene sono cuvette monouso), o vetro. Con la luce UV, siccome ci può essere un’interferenza con il vetro o il Polistirene, si utilizzano le Cuvette in quarzo, che è un materiale inerte alla radiazione UV e che non reagisce con la luce, perché se della luce venisse assorbita dalla cuvetta il dato che si otterrebbe non sarebbe veritiero;
- il detector, un registratore che traduce il raggio di luce trasmesso che è più o meno alto a seconda della assorbanza, della densità del nostro campione.
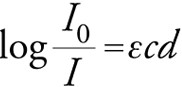
Nella legge di Lambert-Beer ci sono queste 3 grandezze, di cui C è la concentrazione del campione, quindi maggiore è la concentrazione del campione e maggiore è l’assorbanza e viceversa. L è una lunghezza espressa generalmente in cm, la lunghezza che il nostro raggio incidente deve percorrere nel campione, quindi è la distanza tra le due facce ottiche in cui è contenuto il nostro campione. Generalmente, lo spessore della cuvetta è 1 cm, in maniera tale che quella L diventi 1. ε invece è una grandezza che è specifica per ogni sostanza a una determinata lunghezza d’onda e si chiama coefficiente di estinzione molare e rappresenta l’assorbanza di quella determinata sostanza a quella determinata lunghezza d’onda.
Queste grandezze sono poi espresse come unità di misura in mol-1 cm-1 o mmol cm-1, quindi il coefficiente di estinzione molare è una grandezza nota che cambia a seconda della sostanza.
Il picco di assorbanza degli amminoacidi è intorno a 280 nm. Per le proteine è universalmente accettato come valore di λ, di lunghezza d’onda, 280 nm. Analogamente agli amminoacidi anche altre molecole organiche che hanno una struttura complessa, generalmente la capacità di interazione con la luce la si attribuisce alle strutture aromatiche delle molecole, quindi laddove si hanno delle molecole con anelli aromatici allora ci può essere nella zona dell’UV questa caratteristica presentando dei picchi di assorbimento. Questo è dovuto alla delocalizzazione degli elettroni.
Analisi qualitativa
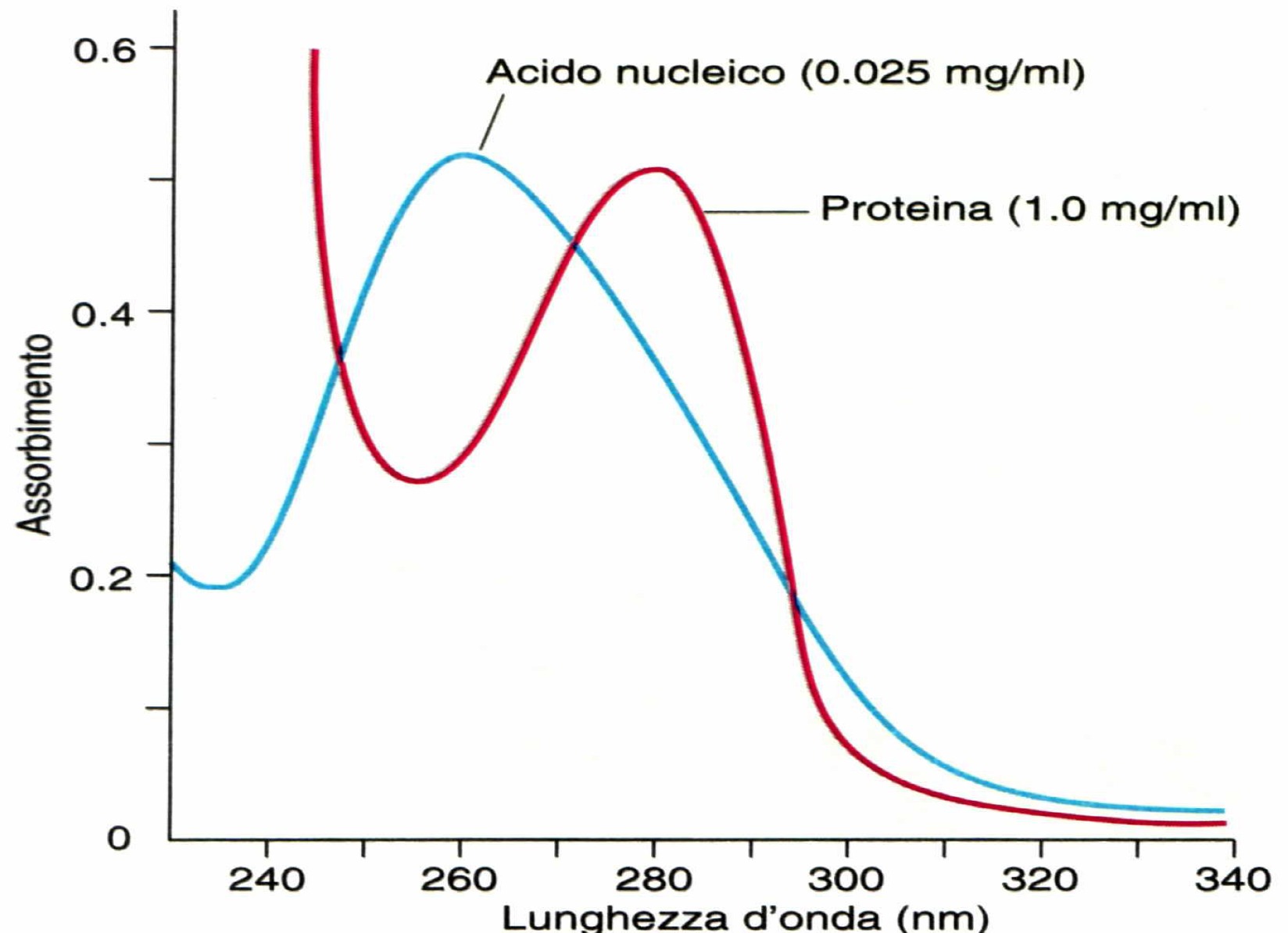
Ogni sostanza o molecola ha un suo “Spettro di Assorbimento” (in base ai gruppi cromofori) rappresentato dal complesso di radiazioni monocromatiche che un composto è in grado di assorbire. Si rappresenta graficamente riportando la quantità di luce assorbita (A) in funzione della lunghezza d’onda (λ).
Il grafico riportato affianco fa vedere i picchi caratteristici di due classi di macromolecole e questo tipo di analisi qualitativo di curva blu⇒acido nucleico e curva rossa⇒proteina permette di distinguere la presenza di acido nucleico che può essere RNA o DNA da una proteina. Quindi gli acidi nucleici, tipo il DNA, grazie alla presenza delle basi azotate presentano questo picco caratteristico a 260 nm mentre invece le proteine a 280 nm. Il rapporto di assorbanza a 260/280 è la cosiddetta ratio, cioè un calcolo che si fa nel caso di purificazione degli acidi nucleici perché questo rapporto deve avere dei valori caratteristici e ci indica il grado di purezza dell’acido nucleico che stiamo andando ad isolare.
Caricamento…
Analisi quantitativa
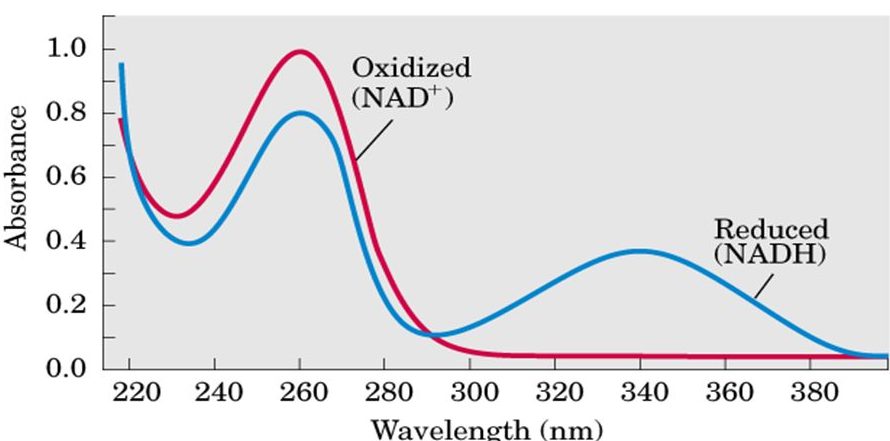
L’analisi quantitativa ci permette di quantificare la presenza di un campione. L’assorbimento delle radiazioni nell’ultravioletto e nel visibile è descritto quantitativamente dalla legge di Lambert-Beer. Ci sono alcune sostanze come per esempio il NADH che sono sostanze cromofore e che presentano diverse lunghezze d’onda a cui è presente un picco di assorbanza e quindi per ogni picco di assorbanza presenteranno una costante differente, cioè una Ɛ differente. Nel caso del NADH esso presenta un picco di assorbanza a 260 nm perché essendo un nucleotide presenta nella sua struttura di base anche una base azotata, l’adenina che conferisce questa proprietà di assorbire la luce alla lunghezza d’onda caratteristica degli acidi nucleici, mentre invece la presenza dell’altra base azotata che è l’anello piridinico nel secondo nucleotide conferisce la capacità di assorbire la luce, però soltanto nella forma ridotta, a 340 nm; perciò il NADH ha due picchi di assorbanza. La forma ossidata del NAD che è il NAD⁺ presenta soltanto il picco a 260 nm. Questo per dire che per il NADH possiamo calcolare due differenti coefficienti di estinzione molare, uno relativo a 260 nm e l’altro a 340 nm. Ɛ è una costante che dipende dalla lunghezza d’onda perché è una grandezza fisica che si può misurare sperimentalmente e rappresenta il valore di assorbanza che viene registrato quando andiamo a misurare l’assorbanza di un nostro campione x a una concentrazione 1 M oppure 1 millimolare.
Per il NADH viene molto utilizzato nella misurazione delle reazioni redox il coefficiente di estinzione molare a 340 nm perché è quello che ci permette di distinguere le due forme, quella ossidata da quella ridotta. Il coefficiente di estinzione molare del NADH a 340 nm è pari a 6,22 M-1cm-1. L’unità di misura del coefficiente di estinzione molare è M-1cm-1 o mM-1cm-1.
La legge di Lamber-Beer è valida per la misurazione di soluzioni non troppo torbide, ossia ci deve essere una concentrazione non troppo alta del nostro campione perché questa correlazione lineare tra l’assorbanza e la concentrazione non è lineare per ogni tipo di concentrazione ma per soluzioni che siano abbastanza diluite. Esiste in realtà una relazione anche tra l’assorbanza e la concentrazione di soluzioni molto concentrate però la relazione non è più di tipo lineare ma diventa una funzione matematica più complessa e quindi per evitare questo tipo di complicazione basta diluire il nostro campione per sfruttare questo tipo di relazione quantitativa.
Caricamento….