Il glioblastoma multiforme (GBM) è un tumore cerebrale altamente aggressivo che colpisce principalmente il sistema nervoso centrale. Ha origine da un gruppo di cellule chiamate cellule gliali, che forniscono supporto alle cellule nervose (neuroni). Tipicamente viene trattato con la resezione chirurgica seguita dalla chemioradioterapia adiuvante. Tuttavia, la prognosi rimane infausta a causa della natura aggressiva della malattia e delle limitate opzioni di trattamento.
Studi recenti hanno identificato livelli elevati di espressione del fattore di attivazione dei fibroblasti (FAP) in vari sottotipi di glioblastomi.
Diverse indagini focalizzate sui gliomi umani hanno osservato un aumento dell’espressione proteica del FAP, particolarmente nei sottotipi di gliomi mesenchimali. Inoltre, è stata stabilita una forte correlazione positiva tra l’espressione del FAP e l’aggressività dei gliomi, principalmente a causa della sua influenza sulla ristrutturazione del microambiente tumorale. È stato riscontrato che il FAP favorisce l’invasione delle cellule del glioma attraverso il tessuto cerebrale facilitando la degradazione del parenchima cerebrale, suggerendo il suo coinvolgimento nell’invasione delle cellule tumorali. Un aumento dell’espressione del FAP è stato riscontrato anche nelle cellule tumorali e nel microambiente protumorale dei tumori neuroepiteliali.
In uno studio di Pandya et al., hanno utilizzato la linea cellulare U87MG, che esprime naturalmente il FAP, per valutare il radiofarmaco immuno-PET [89Zr]Zr-Df-Bz-F19 mAb in vitro. I loro risultati hanno dimostrato che il FAP è un promettente biomarcatore per i gliomi.
L’immagine in basso illustra il caso di una paziente di 52 anni che presentava sintomi di mal di testa e perdita di equilibrio, con ricorrenza evidenziata alla risonanza magnetica (MRI). Le è stata inizialmente diagnosticata una lesione occupante lo spazio temporale destro e ha perciò subito una craniotomia e chemioradioterapia adiuvante nel dicembre 2017. L’analisi istopatologica ha confermato la presenza di GBM, un tumore cerebrale di alto grado (Grado IV secondo l’OMS). Il tumore è stato caratterizzato come wild type per la isocitrato deidrogenasi (IDH), con un indice di Ki67 del 10-12%. L’analisi immunoistochimica (IHC) ha mostrato una colorazione positiva per la proteina acida fibrillare gliale (GFAP) e una colorazione negativa per la citocheratina (CK), indicando l’origine dalle cellule gliali. Il tumore presentava uno stato p53 wild-type, negatività per IDH1 e positività per la sindrome da talassemia alfa/ritardo mentale legata al cromosoma X (ATRX).
Dopo il trattamento iniziale, la paziente ha sperimentato una ricorrenza della malattia e ha subito due successive craniotomie con chemioradioterapia adiuvante. Dopo 5 anni di trattamento senza complicazioni con temozolomide, ha riportato problemi uditivi all’orecchio destro nel 2022.
Una risonanza magnetica di follow-up ha rivelato un residuo di malattia, portando ad una nuova craniotomia temporale destra e decompressione del tumore nel giugno 2022. Poiché le altre opzioni di trattamento sistemico erano state esaurite, la paziente è stata presa in considerazione per l’uso compassionevole del tracciante PET-CT [68Ga]Ga-DOTA.SA.FAPi monomero e terapia radionuclidica [177Lu]Lu-DOTAGA.Glu.(FAPi)2 dimero.
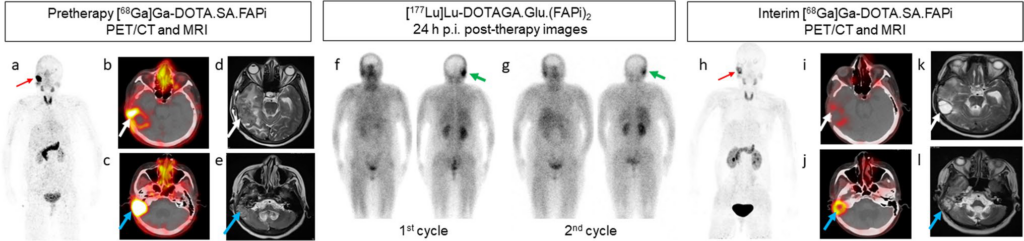
Le immagini assiali MRI pesate in T2 della stessa lesione sono state evidenziate (frecce bianche e blu in d ed e) con significativo edema perilesionale. L’immagine (f) raffigurava la scansione post-terapia del 1º ciclo, eseguita 24 ore dopo la somministrazione di 7,4 GBq di [177Lu]Lu-DOTAGA.Glu.(FAPi)2 nelle proiezioni anteriori e posteriori. Allo stesso modo, l’immagine (g) rappresentava la scansione post-terapia del 2º ciclo, eseguita 24 ore dopo la somministrazione di altri 7,4 GBq di radiofarmaco. Entrambe le scansioni hanno mostrato il mantenimento del radiotracciante terapeutico (freccia verde).
L’analisi visiva delle immagini di [177Lu]Lu-DOTAGA.Glu.(FAPi)2 ha rivelato che la scansione post-trattamento iniziale dopo il primo ciclo (f) ha mostrato una captazione più elevata rispetto alla scansione post-terapia dopo il secondo ciclo (g).
La valutazione della risposta post-terapia ha rivelato una significativa riduzione della fissazione del tracciante nelle immagini MIP (freccia rossa in h) e una riduzione delle dimensioni e della captazione nella regione temporo-parietale destra e nella regione cerebellare destra nelle immagini PET/CT assiali (frecce bianche e blu in i e j). Le immagini assiali MRI pesate in T2 di follow-up della lesione hanno mostrato una riduzione delle dimensioni e dell’edema perilesionale (frecce bianche e blu in k e l).
Nella scansione basale con [68Ga]Ga-DOTA.SA.FAPi, si osserva un’intensa captazione del radiotracciante nella regione della testa, come mostrato dalla freccia rossa nelle immagini di proiezione dell’intensità massima (MIP) (a). Questa captazione è specificamente localizzata nella regione temporo-parietale destra, indicata dalla freccia bianca con un valore di uptake standardizzato (SULpeak) di 7.6 nelle immagini PET/CT assiali (b). Inoltre, c’è un’intensa captazione del radiotracciante nella regione cerebellare destra, rappresentata dalla freccia blu con un SULpeak di 23.9 nelle immagini PET/CT assiali (c).
Le immagini assiali MRI pesate in T2 hanno mostrato due lesioni separate. In primo luogo, è stato osservato un’ispessimento nodulare lobulato eterogeneamente migliorato nella parete della cavità post-operatoria misurante 3.4 × 3.5 cm nella regione temporo-parietale, associato ad edema perilesionale marcato (freccia bianca, d). In secondo luogo, è stata identificata un’altra lesione lobulata eterogeneamente migliorata, che era contigua alla cavità post-operatoria. Questa lesione si estendeva attraverso il tentorio e coinvolgeva il cervelletto destro adiacente. Misurava 3.2 × 2.4 × 2.8 cm (freccia blu, e).
Il paziente ha ricevuto due cicli di terapia con [177Lu]Lu-DOTAGA.Glu.(FAPi)2 alla dose di 7.4 GBq per ciclo a intervalli di 8 settimane. Le immagini della scansione dell’intero corpo post-terapia sono state ottenute 24 ore post-iniezione, come indicato dalla freccia verde in f e g. Queste immagini hanno dimostrato la persistenza di [177Lu]Lu-DOTAGA.Glu.(FAPi)2 nei siti corrispondenti alle scansioni con [68Ga]Ga-DOTA.SA.FAPi e MRI.
Dopo aver completato il secondo ciclo di terapia con [177Lu]Lu-DOTAGA.Glu.(FAPi)2, è stata eseguita una valutazione intermedia della risposta al trattamento utilizzando l’immagine con [68Ga]Ga-DOTA.SA.FAPi PET/CT dopo un periodo di 5 settimane. La valutazione ha mostrato una riduzione sostanziale della fissazione del tracciante nelle immagini MIP, come indicato dalla freccia rossa in h. Inoltre, si sono osservate significative riduzioni delle dimensioni e della captazione nella regione temporo-parietale destra (SULpeak: 2.5) e nella regione cerebellare destra (SULpeak: 6.1), come rappresentato dalle frecce bianche e blu in i e j, rispettivamente, sulle immagini PET/CT assiali.
Inoltre, le immagini di follow-up assiali MRI pesate in T2 della lesione hanno confermato una riduzione delle dimensioni della lesione e dell’edema perilesionale. Questa riduzione può essere osservata dalle frecce bianche e blu in k e l, confermando la risposta positiva al trattamento.
Durante il periodo di trattamento di 10 mesi e di follow-up, non sono stati osservati eventi avversi. Questi risultati evidenziano il potenziale di [177Lu]Lu-DOTAGA.Glu.(FAPi)2 come strategia di trattamento completa, in particolar modo per pazienti con GBM progressivi ricorrenti che hanno opzioni terapeutiche limitate.
La coppia teragnostica [68Ga]Ga-DOTA.SA.FAPi monomero/[177Lu]Lu-DOTAGA.Glu.(FAPi)2 dimero si è rivelata un approccio di successo nel trattamento del GBM, come dimostrato dai risultati. Questa strategia innovativa offre una nuova dimensione al trattamento dei GBM, specialmente nei casi in cui le opzioni di trattamento tradizionali sono limitate. Insieme, i risultati supportano fortemente l’efficacia e la sicurezza di [177Lu]Lu-DOTAGA.Glu.(FAPi)2 come strategia di trattamento completa.
Fonte: Ballal, S., Yadav, M.P., Raju, S. et al. [177Lu]Lu-DOTAGA.Glu.(FAPi)2 Radionuclide Therapy: a New Treatment Option for Patients with Glioblastoma Multiforme. Nucl Med Mol Imaging 58, 32–34 (2024). https://doi.org/10.1007/s13139-023-00814-5