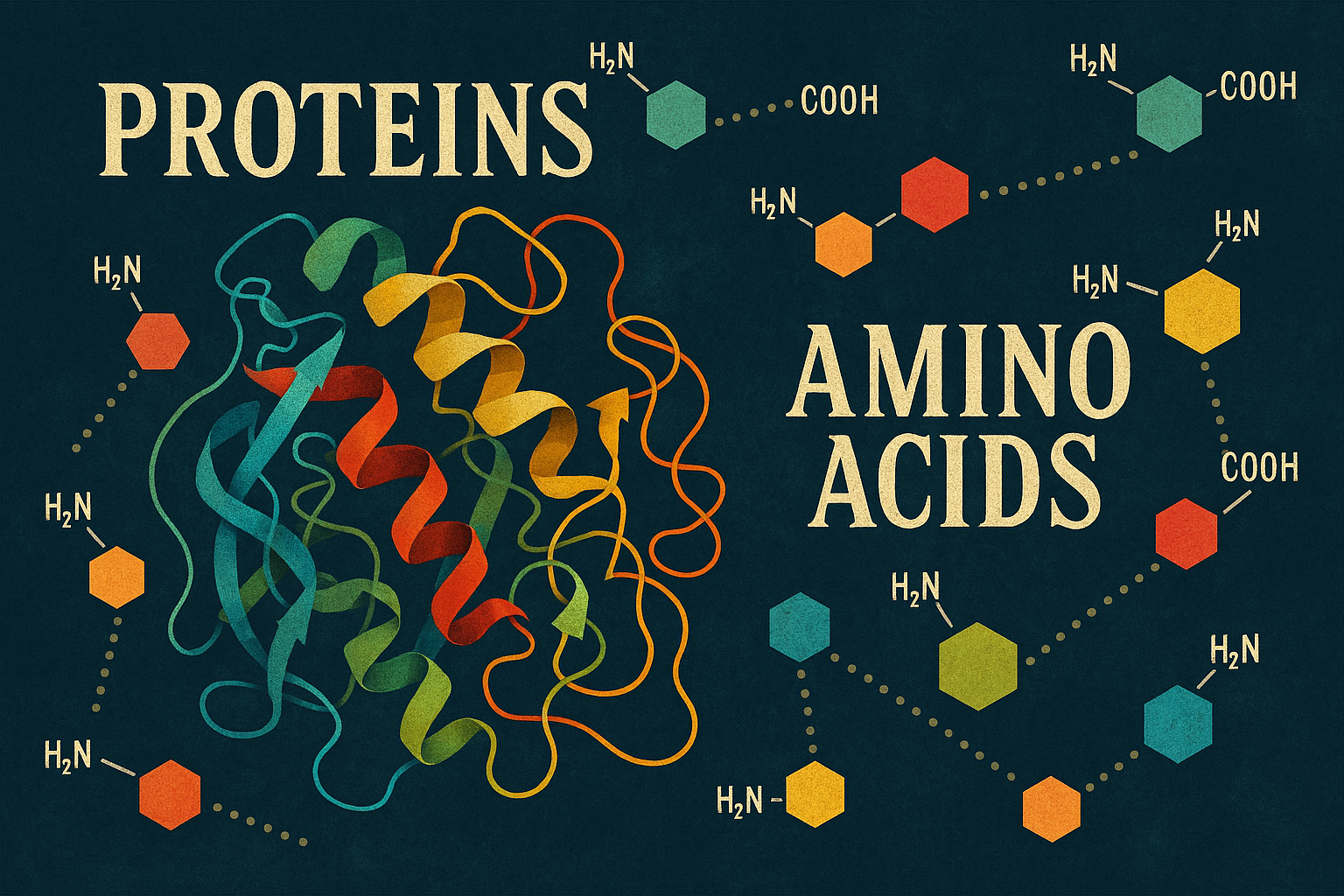
Le proteine sono le macromolecole biologiche più abbondanti, presenti in ogni cellula e in ogni compartimento cellulare. Esse non rappresentano semplicemente una componente strutturale, ma costituiscono lo strumento molecolare attraverso il quale si esprime l’informazione genetica.
La loro diversità funzionale è immensa: agiscono come catalizzatori (enzimi), regolatori (ormoni), elementi di difesa (anticorpi) e componenti strutturali.
Il concetto fondamentale alla base di questa complessità è che la vasta gamma di funzioni proteiche deriva dalla combinazione di sole 20 subunità monomeriche standard: gli amminoacidi. Partendo da questi precursori relativamente semplici, gli organismi viventi sono in grado di assemblare un numero straordinariamente elevato di proteine distinte, ognuna con proprietà e attività biologiche uniche.
Per comprendere appieno come una sequenza lineare di monomeri possa generare tale complessità funzionale, è necessario esaminare in dettaglio le caratteristiche chimiche, strutturali e nutrizionali di questi mattoni fondamentali.
Gli amminoacidi
Gli amminoacidi rappresentano le unità costitutive da cui vengono assemblate tutte le proteine.
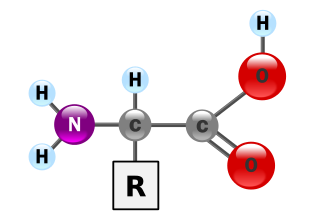
Tutti i 20 amminoacidi standard che compongono le proteine sono α-amminoacidi. La loro struttura generale è caratterizzata da un atomo di carbonio centrale, detto carbonio α, a cui sono legati quattro gruppi distinti:
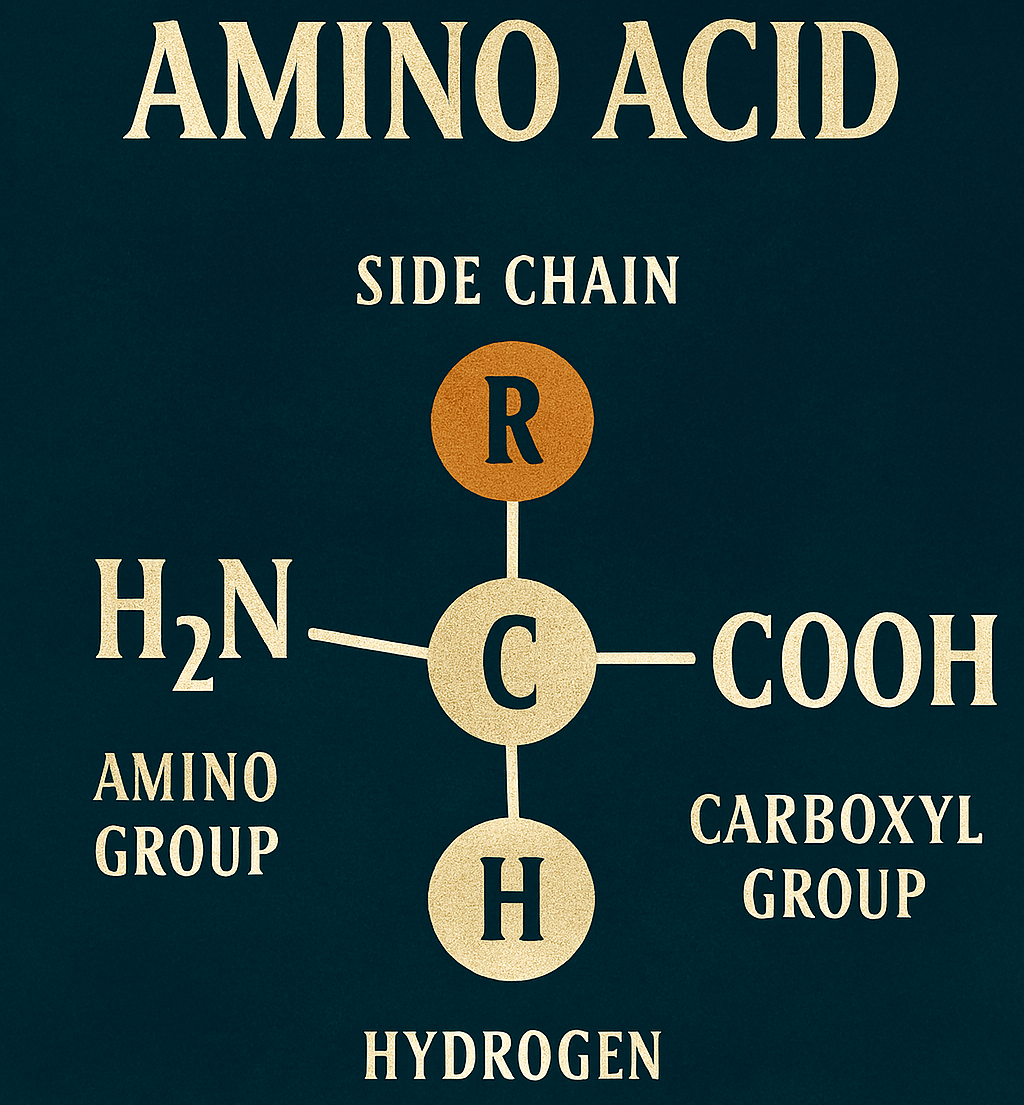
- un gruppo carbossilico (-COOH);
- un gruppo amminico (-NH₂);
- un atomo di idrogeno (-H);
- una catena laterale (o gruppo R).
È proprio la catena laterale a differenziare un amminoacido dall’altro, conferendogli proprietà uniche in termini di dimensioni, carica e solubilità in acqua, che influenzeranno il ripiegamento e la funzione della proteina finale.
Poiché il carbonio α è legato a quattro gruppi diversi, esso è un centro chirale. Fa eccezione la glicina, in cui il gruppo R è un altro atomo di idrogeno. Questa caratteristica conferisce agli amminoacidi la capacità di esistere in due forme speculari non sovrapponibili, definite enantiomeri, classificate secondo il sistema di configurazione assoluta D e L. È di fondamentale importanza biologica sottolineare che tutti i 20 amminoacidi proteinogenici standard sono L-stereoisomeri.
Classificazione degli amminoacidi
Dal punto di vista nutrizionale, gli amminoacidi vengono suddivisi in tre categorie principali, in base alla capacità dell’organismo di sintetizzarli autonomamente per far fronte al proprio fabbisogno.
Now loading…
- Amminoacidi essenziali
Sono definiti “essenziali” quegli amminoacidi che l’organismo non è in grado di sintetizzare de novo. Di conseguenza, è imperativo che vengano introdotti attraverso la dieta. Questi includono:- lisina;
- leucina;
- isoleucina;
- metionina;
- fenilalanina;
- treonina;
- triptofano;
- valina.
- Amminoacidi semi-essenziali
Questa categoria include amminoacidi che l’organismo può sintetizzare, ma la cui produzione endogena potrebbe non essere sufficiente a coprire il fabbisogno in particolari condizioni fisiologiche. L’istidina è un esempio emblematico: risulta essenziale durante l’accrescimento nei bambini e in gravidanza, ma non nell’adulto sano.
Questa categoria, la cui composizione non è univoca in letteratura, include anche altri amminoacidi come l’arginina, la cisteina e la glutammina, che diventano condizionatamente essenziali in specifiche circostanze fisiologiche o patologiche. - Amminoacidi non essenziali
Comprendono tutti gli amminoacidi che l’organismo è in grado di biosintetizzare in quantità adeguate a partire da altri precursori.
L’architettura delle proteine
La funzione biologica di una proteina è intrinsecamente legata alla sua sofisticata e precisa struttura tridimensionale. Questa conformazione non è casuale, ma è il risultato di una gerarchia organizzativa, convenzionalmente suddivisa in quattro livelli. Ogni livello si costruisce su quello precedente, culminando in una forma finale che determina l’attività specifica della molecola.
Struttura primaria
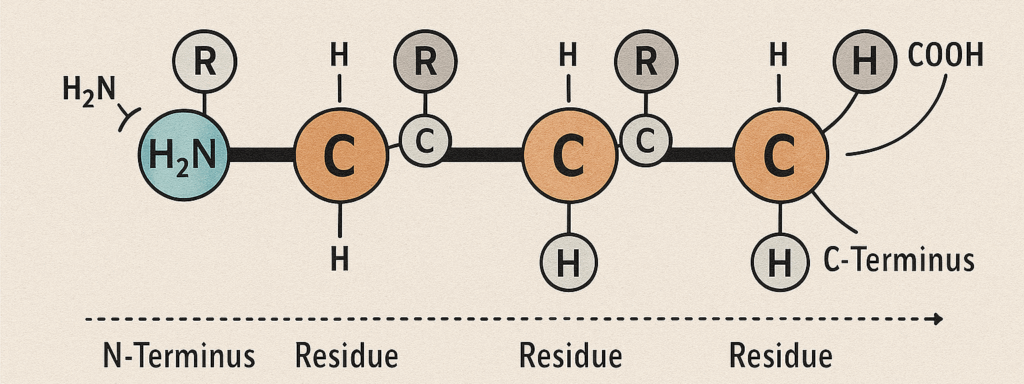
La struttura primaria è la sequenza lineare dei residui amminoacidici uniti covalentemente da legami peptidici. Questa sequenza, determinata dall’informazione genetica, rappresenta il progetto fondamentale della proteina. Essa non solo definisce l’identità della molecola, ma condiziona in modo assoluto tutti i livelli superiori di organizzazione, poiché le interazioni tra le catene laterali degli amminoacidi guideranno l’intero processo di ripiegamento.
Struttura secondaria
La struttura secondaria descrive i ripiegamenti locali e regolari dello scheletro polipeptidico, stabilizzati dalla formazione di legami a idrogeno tra i gruppi amminici (-NH) e carbonilici (-CO) di residui amminoacidici non adiacenti. Le due conformazioni più comuni sono:
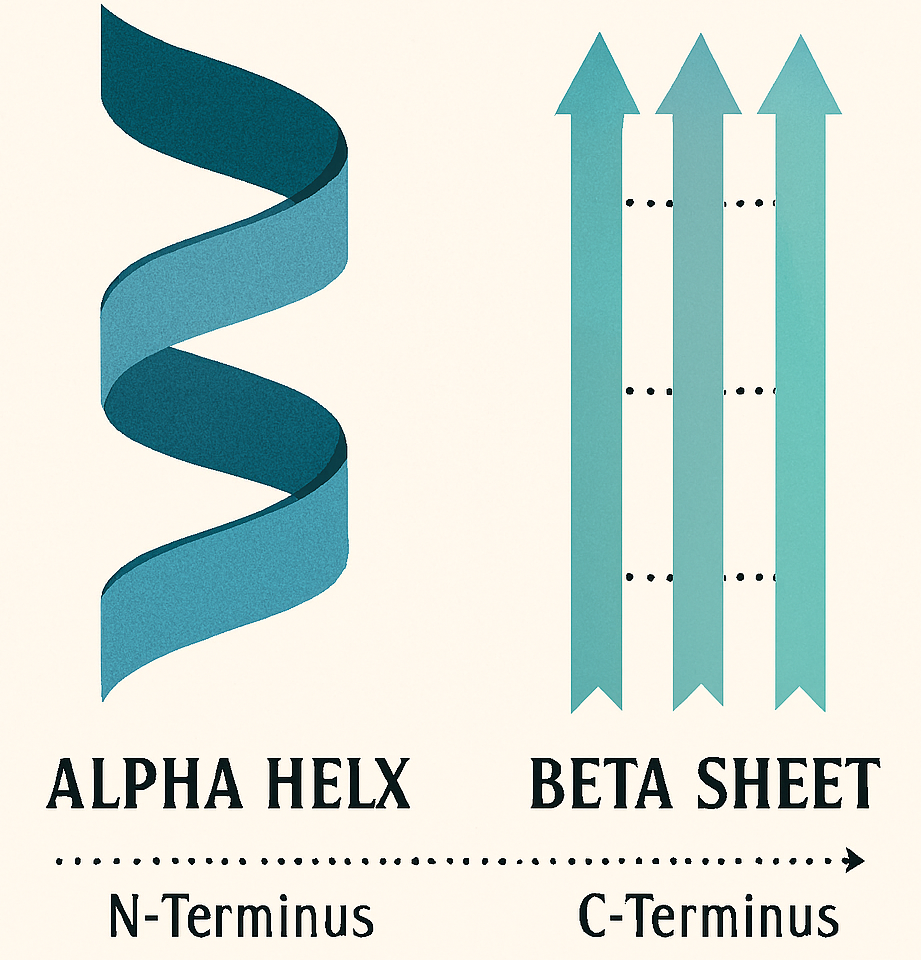
- α-elica: la catena polipeptidica si avvolge a spirale, creando una struttura elicoidale rigida stabilizzata da legami a idrogeno che si formano tra residui della stessa catena. Questa conformazione è caratteristica di molte proteine fibrose ed elastiche, come le α-cheratine presenti in capelli, lana e pelle;
- β-foglietto: la struttura è formata da due o più catene polipeptidiche quasi completamente estese, disposte l’una accanto all’altra. Le catene sono unite da legami a idrogeno tra catene polipeptidiche adiacenti (legami inter-catena), conferendo alla struttura flessibilità ma non elasticità. Un esempio classico è la fibroina, la proteina principale della seta.
Struttura terziaria
La struttura terziaria rappresenta il ripiegamento complessivo tridimensionale di una singola catena polipeptidica. È questa conformazione globulare o fibrosa che conferisce alla proteina la sua funzione biologica. La struttura è stabilizzata da quattro principali tipi di interazioni tra le catene laterali (gruppi R) degli amminoacidi:
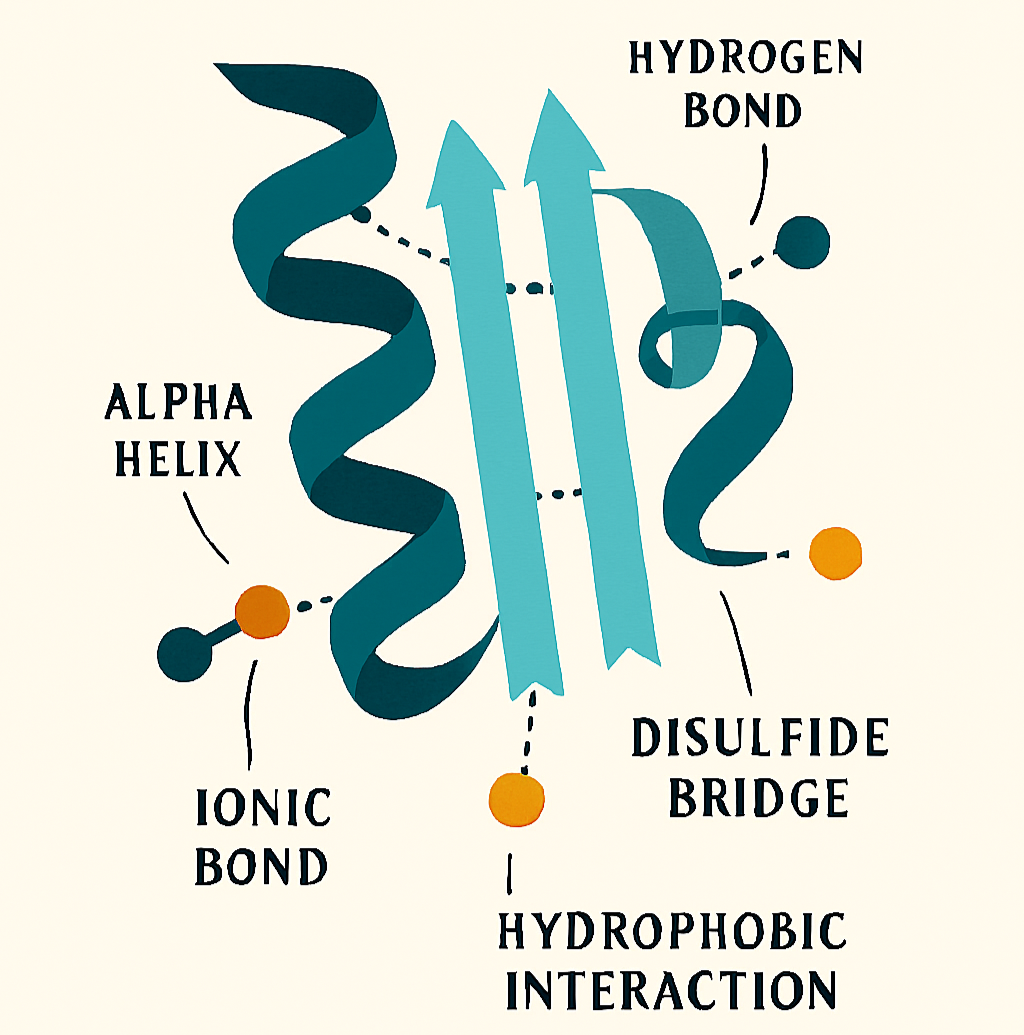
- interazioni idrofobe/idrofile: le catene laterali apolari tendono a raggrupparsi all’interno della proteina per evitare il contatto con l’acqua, mentre quelle polari si espongono sulla superficie;
- attrazioni ioniche: legami tra gruppi R con carica opposta;
- legami a idrogeno: tra catene laterali polari;
- ponti disolfuro: legami covalenti forti che si formano tra i gruppi sulfidrilici di due residui di cisteina.
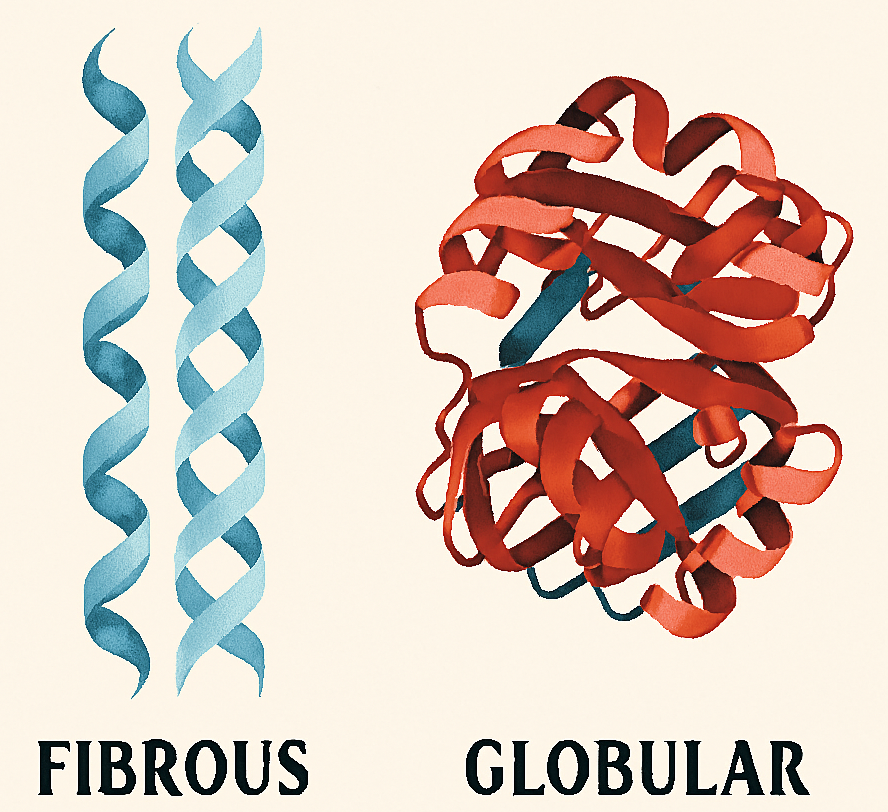
In base alla loro struttura terziaria, le proteine vengono classificate morfologicamente in globulari (compatte, solubili) e fibrose (allungate, insolubili, con ruolo strutturale).
Struttura quaternaria
La struttura quaternaria si osserva solo nelle proteine costituite dall’associazione di due o più catene polipeptidiche, chiamate subunità, ciascuna con la propria struttura terziaria. L’assemblaggio è mantenuto da interazioni sia deboli che forti:
- esempio di proteina globulare: l’emoglobina, la proteina che trasporta l’ossigeno nel sangue, è un tetramero di 574 amminoacidi totali, organizzati in quattro subunità: due catene alfa e due catene beta. L’emoglobina fetale, che ha una maggiore affinità per l’ossigeno, è anch’essa un tetramero ma composto da due catene alfa e due catene gamma.
- esempio di proteina fibrosa: il collagene, la proteina più abbondante nei tessuti connettivi, è formato da tre catene polipeptidiche avvolte l’una sull’altra a formare una tripla elica, che conferisce eccezionale resistenza meccanica ai tessuti.
Catabolismo delle proteine e degli amminoacidi
Il catabolismo proteico è il processo attraverso cui le proteine, sia quelle introdotte con la dieta sia quelle endogene, vengono degradate nei loro amminoacidi costituenti. A differenza di glucidi e lipidi, per gli amminoacidi non esistono forme di deposito dedicate; pertanto, ogni molecola in eccesso rispetto alle immediate necessità biosintetiche deve essere catabolizzata.
Negli animali, gli amminoacidi subiscono una degradazione ossidativa in tre principali situazioni metaboliche:
Now loading…
- durante il normale turnover delle proteine cellulari;
- in caso di una dieta eccessivamente ricca di proteine, quando gli amminoacidi superano il fabbisogno per la sintesi proteica;
- durante il digiuno o in condizioni patologiche come il diabete, quando i carboidrati non sono disponibili e le proteine corporee vengono utilizzate come fonte energetica.
Il processo di degradazione delle proteine alimentari inizia nello stomaco e si completa nell’intestino tenue.
Nello stomaco l’ingresso di cibo stimola la secrezione dell’ormone gastrina, che a sua volta induce la produzione di acido cloridrico (HCl) e pepsinogeno. L’ambiente fortemente acido creato dall’HCl denatura le proteine globulari, “srotolandole” e rendendole più accessibili agli enzimi. L’HCl attiva anche il pepsinogeno, che si converte nella sua forma attiva, la pepsina, tramite un processo di autodigestione catalizzato dal pH acido, iniziando a idrolizzare i legami peptidici.
Nell’intestino tenue i peptidi più piccoli prodotti nello stomaco passano nell’intestino, dove la digestione prosegue ad opera di enzimi pancreatici. Questi enzimi vengono secreti dal pancreas come zimogeni inattivi (tripsinogeno e chimotripsinogeno) e attivati nel lume intestinale dall’azione di enteropeptidasi. La tripsina e la chimotripsina attive hanno specificità diverse:
- la tripsina idrolizza i legami peptidici in cui il gruppo carbonilico è fornito da lisina (Lys) o arginina (Arg);
- la chimotripsina agisce sui legami in cui il gruppo carbonilico appartiene a fenilalanina (Phe), tirosina (Tyr) o triptofano (Trp).
La degradazione è infine completata da amminopeptidasi e carbossipeptidasi, che rimuovono gli amminoacidi uno alla volta dalle estremità dei peptidi. La digeribilità varia: le proteine animali (globulari) sono quasi completamente degradate, mentre molte proteine vegetali sono digerite in modo incompleto a causa della presenza di un involucro di cellulosa non digeribile.
Una volta assorbiti, gli amminoacidi liberi entrano nel circolo metabolico. La tappa fondamentale della loro degradazione è la separazione del gruppo amminico (-NH₂) dallo scheletro carbonioso. Questo processo avviene principalmente tramite una reazione di transaminazione.
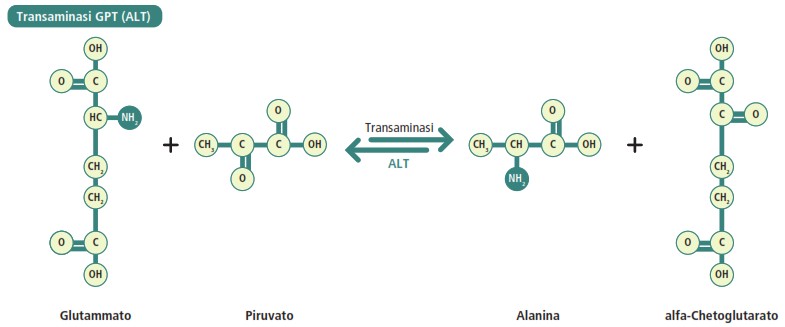
La transaminazione è il trasferimento del gruppo amminico da un amminoacido a un chetoacido, catalizzato da enzimi chiamati amminotransferasi (o transaminasi). Questa reazione reversibile richiede la presenza di un coenzima essenziale, il piridossalfosfato (PLP), la forma attiva della vitamina B6.
Nella maggior parte di queste reazioni, il principale accettore del gruppo amminico è l’α-chetoglutarato, che viene così convertito in glutammato. Due delle transaminasi epatiche più importanti sono:
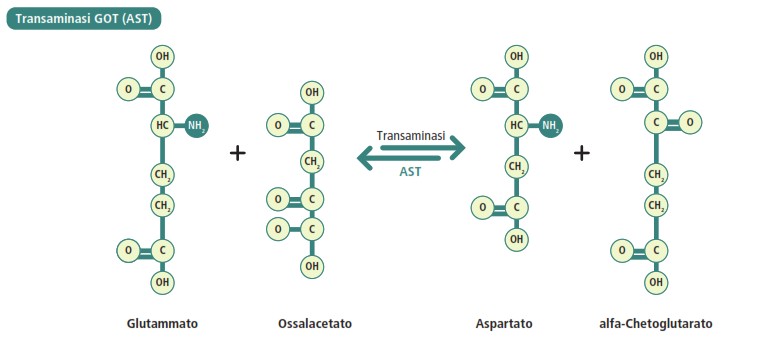
- aspartato amminotransferasi (AST o GOT):
Aspartato + α-chetoglutarato ⇌ Ossalacetato + Glutammato
- alanina amminotransferasi (ALT o GPT):
Alanina + α-chetoglutarato ⇌ Piruvato + Glutammato
Dopo la separazione, i due prodotti (lo scheletro carbonioso e il gruppo amminico) seguono destini metabolici completamente diversi.
Destino metabolico dei prodotti del catabolismo
Una volta che la transaminazione ha separato il gruppo amminico dallo scheletro carbonioso, ciascuno di questi componenti intraprende vie metaboliche specializzate che sono fondamentali per il bilancio energetico, la sintesi di nuove molecole e l’omeostasi generale dell’organismo.
Lo scheletro carbonioso rimanente può entrare nelle principali vie del metabolismo energetico. In base al loro destino finale, gli amminoacidi vengono classificati in due categorie:
- amminoacidi glucogenici: i loro scheletri carboniosi possono essere convertiti in piruvato o in intermedi del ciclo dell’acido citrico (come α-chetoglutarato, succinil-CoA, fumarato e ossalacetato). Poiché questi intermedi sono precursori della sintesi di glucosio tramite la gluconeogenesi, tali amminoacidi sono definiti “glucogenici”;
- amminoacidi chetogenici: i loro scheletri carboniosi vengono degradati ad acetoacetil-CoA e/o acetil-CoA. Questi composti non possono essere convertiti in glucosio, ma sono precursori per la sintesi di acidi grassi e corpi chetonici.
Esistono inoltre amminoacidi che sono sia glucogenici che chetogenici, poiché parti diverse del loro scheletro carbonioso seguono destini differenti. Tra questi figurano: triptofano, isoleucina, fenilalanina, tirosina e treonina.
Il gruppo amminico, convertito in ione ammonio (NH₄⁺), segue un destino completamente diverso. Una parte può essere riciclata per la sintesi di nuovi amminoacidi e altri composti azotati. Tuttavia, l’eccesso di ioni ammonio deve essere prontamente eliminato, poiché è altamente tossico, specialmente per il cervello.
La sua tossicità deriva da due fattori principali: in quanto molecola basica, può alterare l’equilibrio acido-base cellulare e, soprattutto, interferisce con il metabolismo energetico. In particolare, un eccesso di NH₄⁺ sottrae α-chetoglutarato al ciclo di Krebs per formare glutammato, depletando un intermedio chiave e compromettendo la capacità della cellula, soprattutto quella neuronale, di produrre ATP.
Per gestire questa potenziale tossicità, i mammiferi hanno evoluto un’efficiente via metabolica per la sua conversione in un composto innocuo ed eliminabile: il ciclo dell’urea.
Il ciclo dell’urea
Il ciclo dell’urea è il processo biochimico chiave che si svolge principalmente nel fegato dei mammiferi per convertire l’ammoniaca tossica in urea, un composto atossico e altamente solubile. Questa via metabolica è di importanza strategica per il mantenimento dell’omeostasi azotata e la prevenzione dell’iperammoniemia.
L’urea è una molecola piccola e priva di carica, facilmente trasportabile nel sangue fino ai reni, dove viene filtrata ed eliminata con le urine. La sua sintesi richiede substrati specifici che forniscono i suoi atomi costituenti:
- i due atomi di azoto derivano rispettivamente dall’ammoniaca libera e dal gruppo amminico dell’amminoacido aspartato;
- l’atomo di carbonio deriva dall’idrogeno carbonato (HCO₃⁻), incorporato tramite la molecola di carbamilfosfato.
Il ciclo si svolge in parte nei mitocondri e in parte nel citosol delle cellule epatiche, attraverso una serie di reazioni enzimatiche:
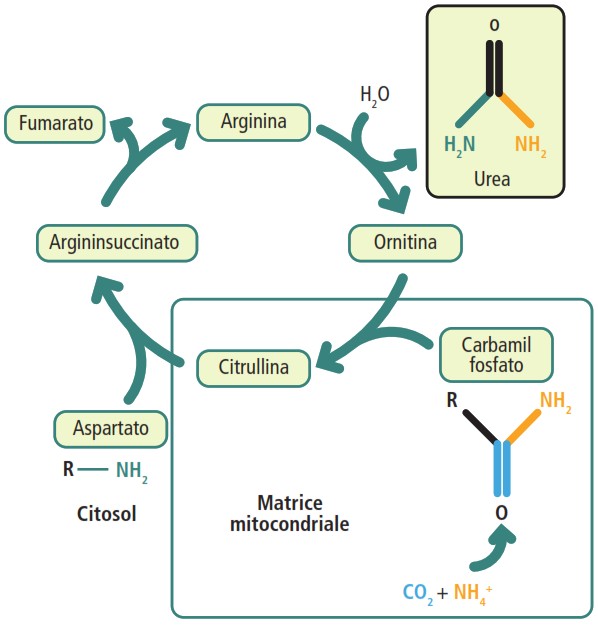
- formazione del carbamilfosfato: nei mitocondri, l’ammoniaca (NH₄⁺) reagisce con l’idrogeno carbonato (HCO₃⁻) per formare carbamilfosfato. Questa reazione è catalizzata dalla carbamilfosfato sintetasi I e richiede il consumo di due molecole di ATP;
- formazione della citrullina: il gruppo carbamilico viene trasferito all’ornitina per formare citrullina, che viene poi trasportata nel citosol;
- incorporazione del secondo azoto: la citrullina reagisce con l’aspartato (che fornisce il secondo atomo di azoto) per formare arginosuccinato. Anche questa tappa richiede energia, fornita dall’idrolisi di ATP;
- scissione dell’Arginosuccinato: l’arginosuccinato viene scisso in fumarato e arginina;
- liberazione dell’urea: l’arginina viene idrolizzata dall’enzima arginasi per liberare urea e rigenerare l’ornitina, che può essere trasportata nuovamente nel mitocondrio per iniziare un altro ciclo.
Il ciclo dell’urea è finemente regolato per rispondere alle variazioni del carico di azoto. La regolazione avviene a due livelli:
- regolazione a lungo termine (genica): un’alimentazione ricca di proteine induce un aumento della sintesi degli enzimi del ciclo per aumentarne la capacità complessiva;
- regolazione a breve termine (allosterica): l’enzima chiave, la carbamilfosfato sintetasi I, è attivato allostericamente dall’N-acetilglutammato, la cui concentrazione aumenta in risposta a un elevato afflusso di amminoacidi.
Dal punto di vista energetico, la sintesi di una molecola di urea è un processo costoso. Tuttavia, parte di questo costo viene recuperato: il fumarato prodotto nel ciclo può essere convertito in ossalacetato, generando una molecola di NADH la cui ossidazione contribuisce alla produzione di ATP.