L’arresto cardiaco improvviso è definito come la brusca cessazione della funzione di pompa del cuore. Sebbene l’esito sia lo stesso, le cause primarie differiscono significativamente tra le popolazioni: nell’adulto, la causa più frequente è l’ischemia miocardica, mentre nel bambino è tipicamente l’ipossia a innescare un coinvolgimento secondario del cuore. In entrambi i contesti, il trattamento fondamentale e tempo-dipendente è la Rianimazione Cardiopolmonare (RCP), una sequenza di interventi mirati a ripristinare una minima circolazione in attesa di trattamenti avanzati.
L’efficacia della risposta all’arresto cardiaco è concettualizzata nella “catena della sopravvivenza“, un modello che evidenzia i passaggi sequenziali critici per massimizzare le possibilità di un esito favorevole. Ogni anello è indispensabile:
- riconoscimento tempestivo dell’arresto cardiaco e chiamata d’aiuto: identificare immediatamente la condizione e attivare il sistema di emergenza è il primo passo che innesca tutte le azioni successive;
- RCP precoce effettuata dagli astanti: l’avvio immediato delle compressioni toraciche da parte di chiunque sia presente può raddoppiare o triplicare le possibilità di sopravvivenza;
- defibrillazione precoce: per i ritmi cardiaci defibrillabili, l’erogazione di uno shock elettrico nei primi minuti è l’intervento più efficace per ripristinare un ritmo cardiaco valido;
- trattamento post-rianimatorio avanzato: una volta ripristinato il circolo spontaneo (ROSC), una gestione specialistica in ambiente ospedaliero è cruciale per trattare la causa sottostante e minimizzare il danno d’organo, in particolare quello cerebrale.

I dati attuali evidenziano la gravità del problema: la sopravvivenza media per un arresto cardiaco extra-ospedaliero si attesta intorno all’8%, mentre sale al 15-34% per gli arresti che avvengono in ambiente intra-ospedaliero. Questi numeri sottolineano l’importanza di un’azione coordinata e basata sull’evidenza. I protocolli qui descritti si basano sulle linee guida di riferimento dell’European Resuscitation Council (ERC) e dell’Italian Resuscitation Council (IRC), aggiornate al 2021. Queste linee guida promuovono iniziative come il registro europeo Eu-ReCa per monitorare l’epidemiologia e la diffusione della formazione laica, a partire dalle scuole, attraverso programmi come “kids save lives”.
La pandemia da Covid-19 ha introdotto un’ulteriore considerazione operativa, evidenziando la necessità per i soccorritori di utilizzare adeguati Dispositivi di Protezione Individuale (DPI) durante le manovre rianimatorie su pazienti positivi o sospetti tali.
Riconoscimento precoce dell’arresto cardiaco e attivazione dell’aiuto
Il riconoscimento rapido e accurato dell’arresto cardiaco è il primo e più critico anello della catena della sopravvivenza. Un’identificazione errata o tardiva compromette l’intera sequenza di soccorso, riducendo drasticamente le possibilità di sopravvivenza del paziente. Pertanto, un paziente deve essere considerato in arresto cardiaco fino a prova contraria se presenta i seguenti segni clinici:
Caricamento…
- stato di coscienza: il paziente è incosciente, ovvero non risponde in alcun modo agli stimoli esterni (chiamata a voce, scuotimento delicato);
- attività respiratoria: il paziente non respira normalmente. Questo include sia l’assenza completa di respiro (apnea) sia la presenza di attività respiratoria anomala.
Alcuni fenomeni possono confondere il soccorritore, ma sono in realtà segni precoci di arresto cardiaco e non devono ritardare l’intervento.
- respiro agonico: durante i primi minuti di un arresto cardiaco, molti pazienti presentano respiri lenti, profondi e rumorosi, spesso descritti come un suono “russante”. Questo non è un respiro efficace ed è un segno patognomonico di arresto cardiaco in un paziente incosciente;
- convulsioni: movimenti simili a convulsioni possono manifestarsi all’esordio dell’arresto cardiaco a causa dell’ipoperfusione cerebrale. La procedura corretta è attendere la fine delle convulsioni e valutare immediatamente lo stato di coscienza e il respiro. Se il paziente non respira normalmente, è in arresto cardiaco.
La ricerca del polso carotideo da parte di soccorritori non esperti è considerata un metodo poco attendibile e non è imprescindibile per la diagnosi di arresto. Anche per gli operatori sanitari, può essere difficile e richiedere tempo prezioso. Pertanto, in caso di dubbio sulla presenza del polso in un paziente incosciente che non respira normalmente, si deve procedere come se l’arresto cardiaco fosse confermato e iniziare immediatamente la RCP.
Una volta identificato l’arresto, è imperativo avviare senza indugio le manovre di Supporto Vitale di Base (BLS).
Supporto Vitale di Base (BLS) nell’adulto
Il BLS (Basic Life Support) è la sequenza standardizzata di azioni finalizzate a mantenere una minima perfusione cerebrale e coronarica attraverso le compressioni toraciche e a fornire ossigenazione tramite le ventilazioni. Queste manovre sono progettate per essere eseguite da chiunque, anche da personale non esperto, in attesa dell’arrivo di soccorsi avanzati e di un defibrillatore.
I pilastri della RCP di alta qualità
Per massimizzare l’efficacia della rianimazione, le linee guida enfatizzano la necessità di una RCP non solo precoce, ma di elevata qualità. I criteri fondamentali sono:
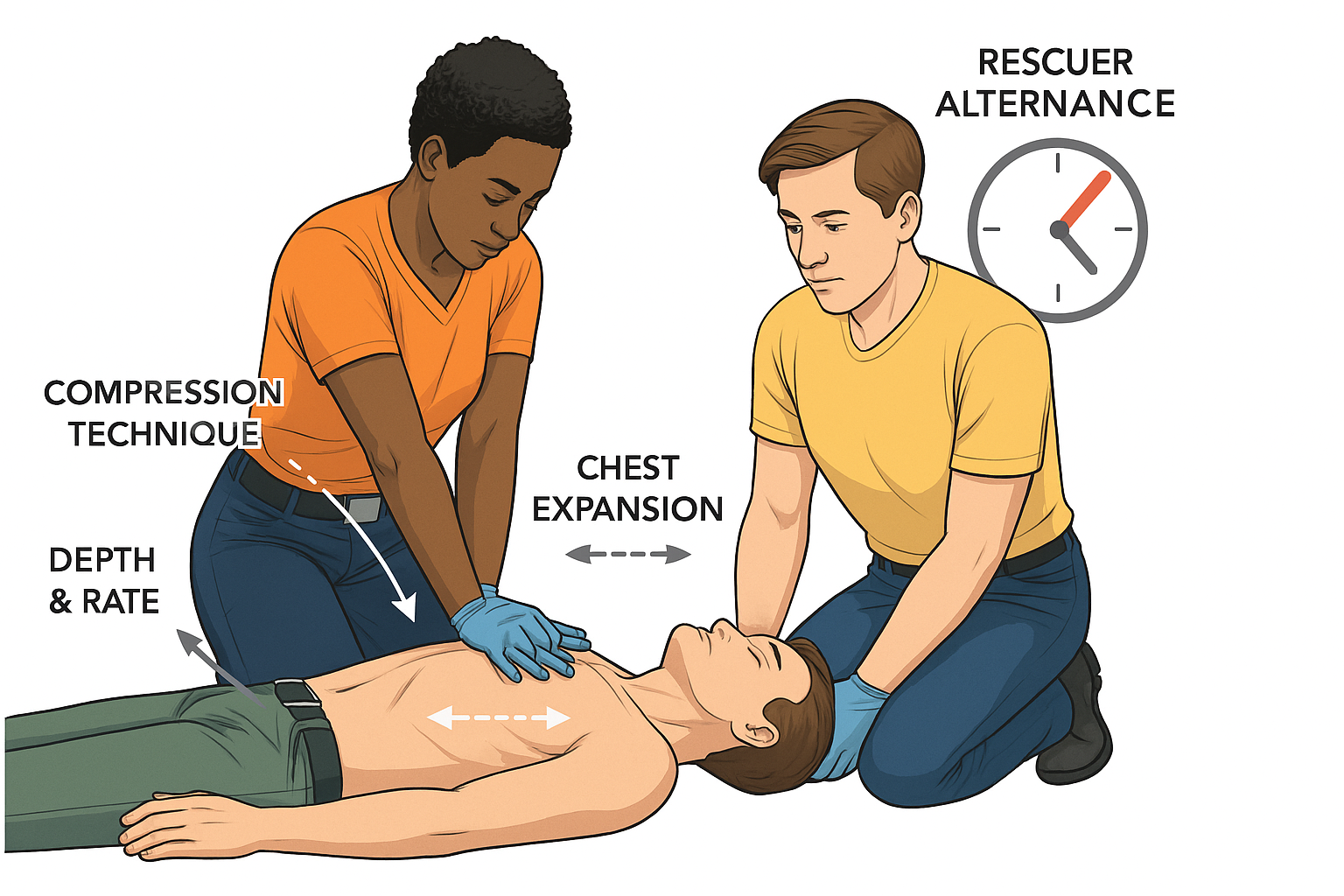
- posizionamento: il paziente deve essere supino su una superficie rigida per massimizzare l’efficacia delle compressioni;
- tecnica delle compressioni: posizionare il calcagno di una mano sulla metà inferiore dello sterno. Sovrapporre l’altra mano e intrecciare le dita. Con le braccia tese e perpendicolari al torace del paziente, comprimere verticalmente;
- profondità e frequenza: La profondità delle compressioni deve essere di 5-6 cm. La frequenza deve essere compresa tra 100 e 120 compressioni al minuto;
- riespansione toracica: dopo ogni compressione, è cruciale rilasciare completamente la pressione sul torace, senza perdere il contatto, per permettere al cuore di riempirsi di sangue (ritorno venoso);
- minimizzazione delle interruzioni: le compressioni devono essere il più continue possibile. Le pause devono essere ridotte al minimo e sono consentite solo per eseguire le ventilazioni, per l’analisi del ritmo da parte del defibrillatore e per l’erogazione dello shock;
- alternanza dei soccorritori: la qualità delle compressioni decade rapidamente a causa della fatica. È raccomandato che i soccorritori si alternino ogni 2 minuti.
La sequenza operativa BLS/AED (defibrillazione)
La sequenza operativa per un adulto integra l’uso del Defibrillatore Automatico Esterno (AED) come priorità assoluta:
- valutare la coscienza e il respiro. Se il paziente non risponde e non respira normalmente, è in arresto cardiaco;
- chiamare i soccorsi (numero unico di emergenza 112 o 118);
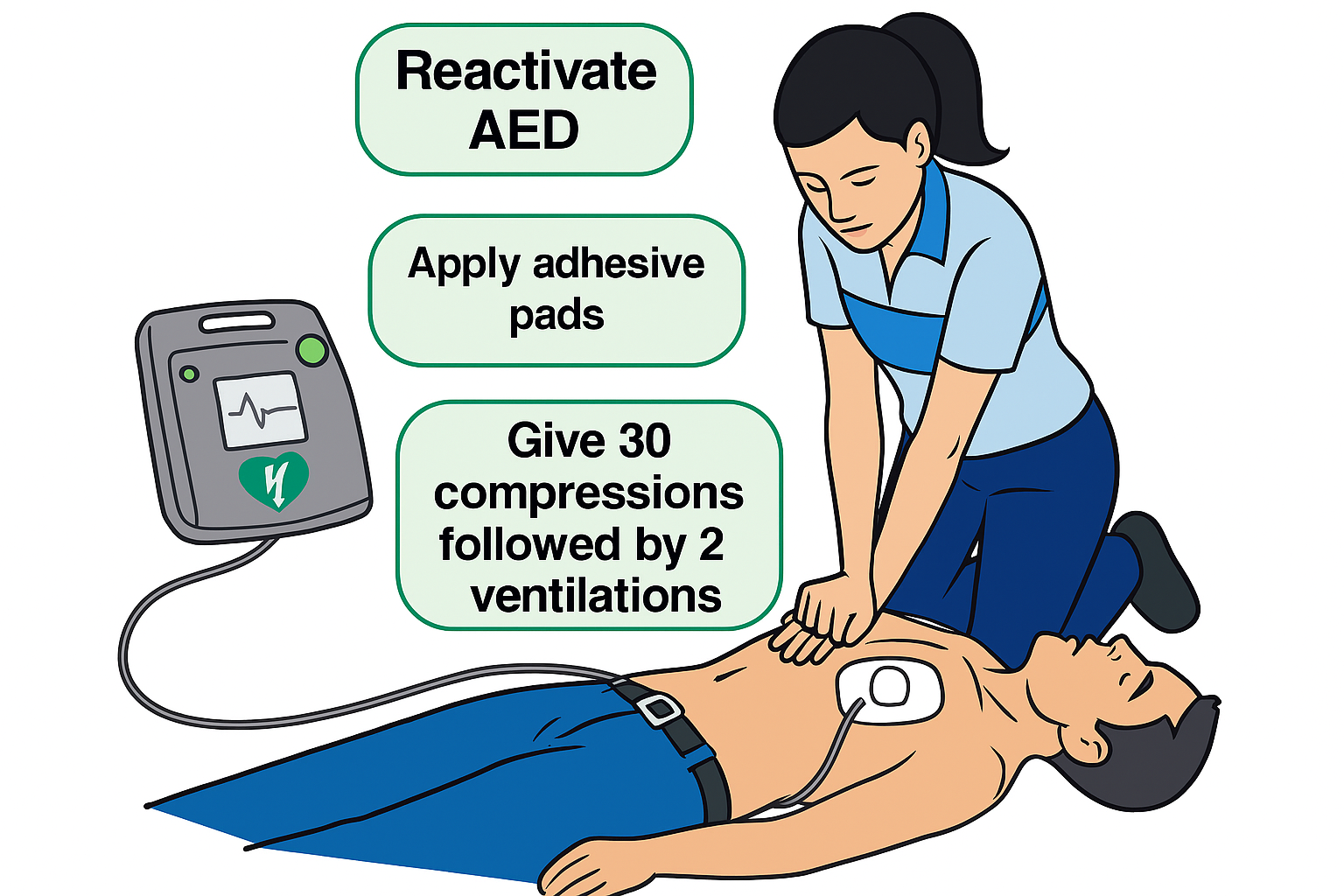
- se un defibrillatore è immediatamente disponibile: accenderlo e applicare le placche adesive sul torace nudo del paziente prima di iniziare le compressioni. Seguire le istruzioni vocali per l’analisi del ritmo e l’eventuale shock;
- se il defibrillatore non è immediatamente disponibile: iniziare subito le compressioni toraciche con un rapporto di 30 compressioni, seguite da 2 ventilazioni efficaci (l’intera manovra di ventilazione deve durare meno di 10 secondi);
- continuare i cicli di 30:2 senza interruzioni;
- appena arriva l’AED: interrompere la RCP solo il tempo strettamente necessario per accenderlo, applicare le placche e seguire le istruzioni vocali/visive;
- dopo l’eventuale shock: riprendere immediatamente la RCP (30:2) senza rivalutare il polso o il ritmo. L’AED guiderà le analisi successive ogni 2 minuti.
Gestione del paziente incosciente ma respirante

Se un paziente è incosciente ma respira normalmente, non è in arresto cardiaco e non necessita di RCP. In questo caso, deve essere posizionato in posizione laterale di sicurezza (PLS). Questa posizione mantiene le vie aeree pervie e riduce il rischio di inalazione di materiale gastrico in caso di vomito.
Supporto Vitale Avanzato (ALS) nell’adulto
L’Advanced Life Support (ALS) rappresenta l’insieme di interventi avanzati che si integrano e si sovrappongono al BLS. Richiede personale sanitario addestrato, attrezzature specifiche e farmaci per ottimizzare la gestione del paziente, diagnosticare e trattare le cause reversibili dell’arresto.
Gestione avanzata delle vie aeree e ventilazione
- Nelle fasi iniziali, la ventilazione viene effettuata con un sistema pallone-maschera, erogando ossigeno al 100%;
- l’intubazione tracheale è considerata il gold standard per la gestione delle vie aeree, ma deve essere eseguita solo da un “intubatore esperto” (tasso di successo >95% in due tentativi). La pausa nelle compressioni toraciche per l’intubazione non deve superare i 5 secondi;
- i presidi sovraglottici (es. maschera laringea) rappresentano un’alternativa valida ed efficace, soprattutto in assenza di un operatore esperto nell’intubazione;
- una volta posizionata una via aerea avanzata (tubo o presidio sovraglottico), la sequenza RCP cambia: le compressioni toraciche diventano continue a una frequenza di 100-120/min, mentre le ventilazioni vengono erogate a una frequenza costante di 10 atti al minuto, senza coordinazione con le compressioni;
- in caso di ripresa del circolo (ROSC), l’obiettivo è mantenere una saturazione di ossigeno (SpO2) tra 94-98% per evitare i danni cellulari da iperossia.
Accesso vascolare e terapia farmacologica
L’accesso vascolare può essere ottenuto tramite una via venosa periferica o, in caso di difficoltà, tramite un accesso intraosseo (omero, tibia).
| Farmaco | Dosaggio e tempistica | Razionale d’uso e note |
|---|---|---|
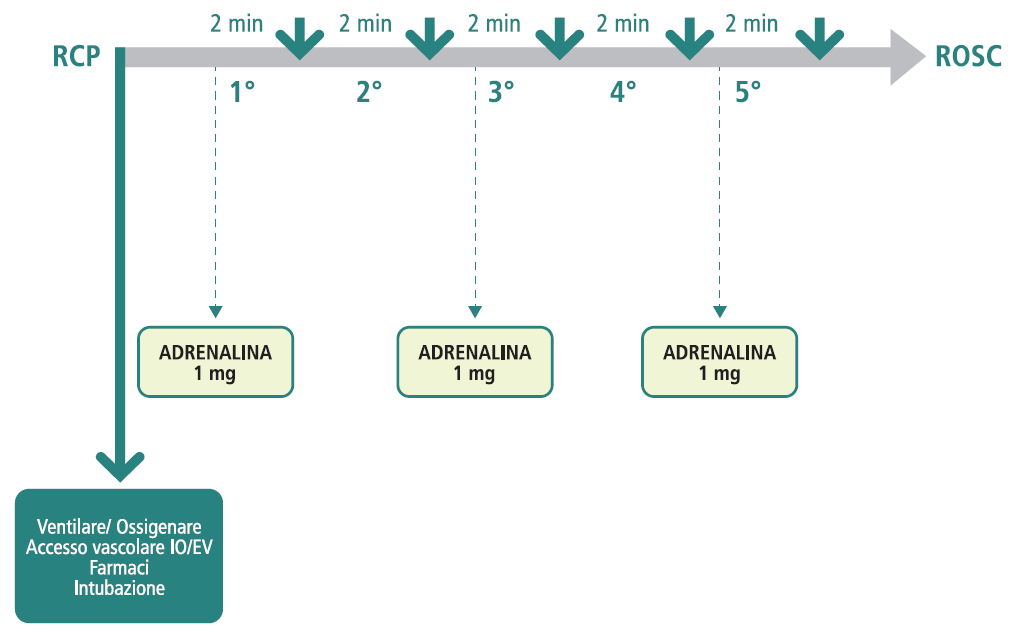
| Adrenalina | 1 mg ogni 3-5 minuti | Farmaco di prima scelta per tutte le cause. Migliora il flusso di sangue al miocardio e al cervello e aumenta la probabilità di successo della defibrillazione nello shock successivo. Nei ritmi defibrillabili, si somministra dopo il 3°, 5° e successivi shock dispari. |
| Amiodarone | 300 mg dopo il 3° shock, 150 mg dopo il 5° shock | Antiaritmico indicato per la Fibrillazione Ventricolare o Tachicardia Ventricolare senza polso refrattaria alla defibrillazione. |
| Lidocaina | 100 mg | Antiaritmico di seconda scelta, da utilizzare in alternativa all’amiodarone per i ritmi defibrillabili refrattari. |
| Cristalloidi | Al bisogno | La somministrazione di fluidi è indicata solo se si sospetta che l’ipovolemia sia la causa o una concausa dell’arresto cardiaco. |
Capnografia a forma d’onda
Il monitoraggio dell’anidride carbonica a fine espirazione (EtCO₂) offre vantaggi cruciali durante la RCP:
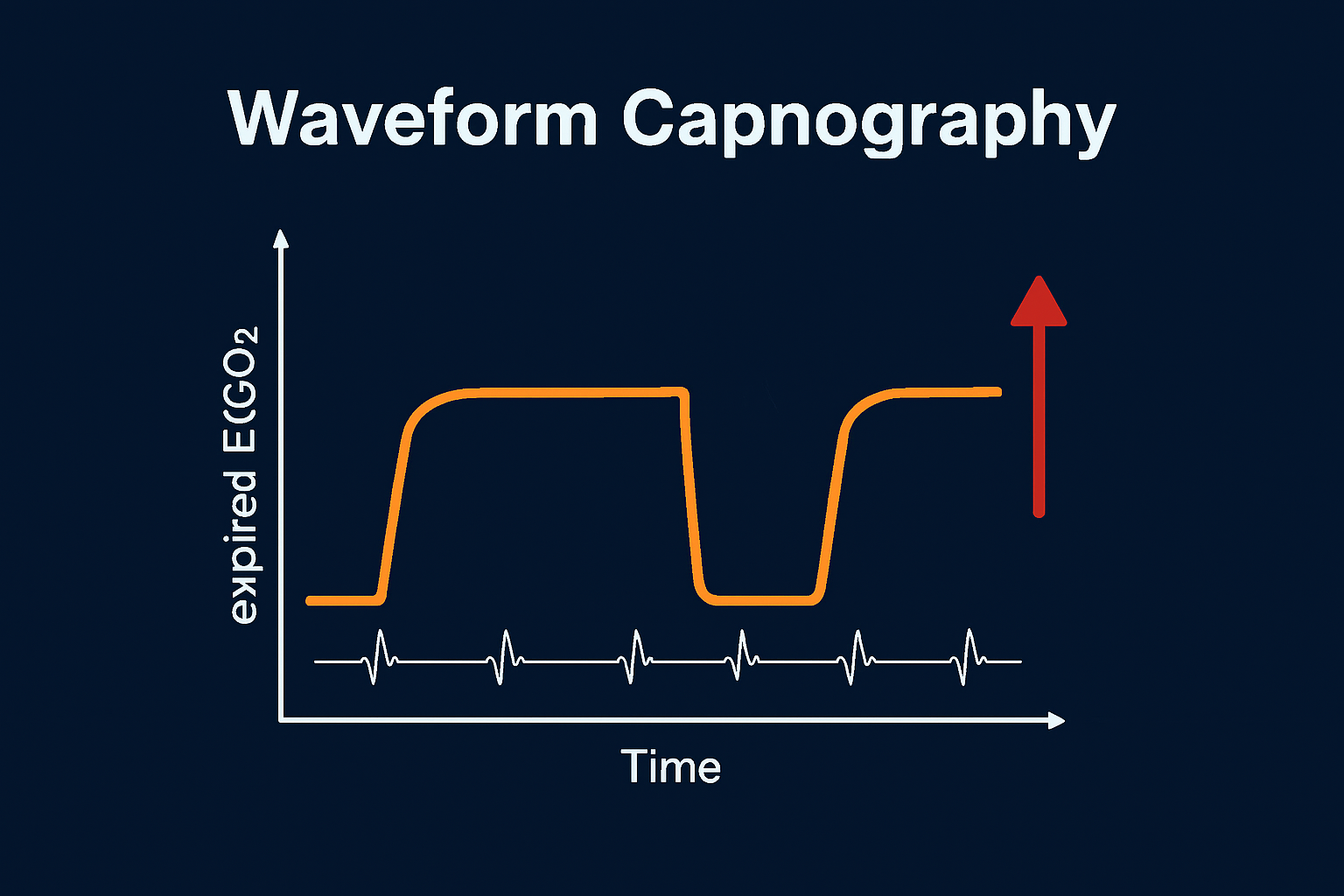
- conferma del corretto posizionamento del tubo tracheale;
- monitoraggio della frequenza di ventilazione;
- monitoraggio della qualità della RCP: un aumento del valore di EtCO₂ indica una migliore gittata cardiaca generata dalle compressioni;
- rilevazione precoce del ROSC: un improvviso e significativo aumento del valore di EtCO₂ è un indicatore precoce di ripresa del circolo spontaneo, spesso rilevabile prima del polso.
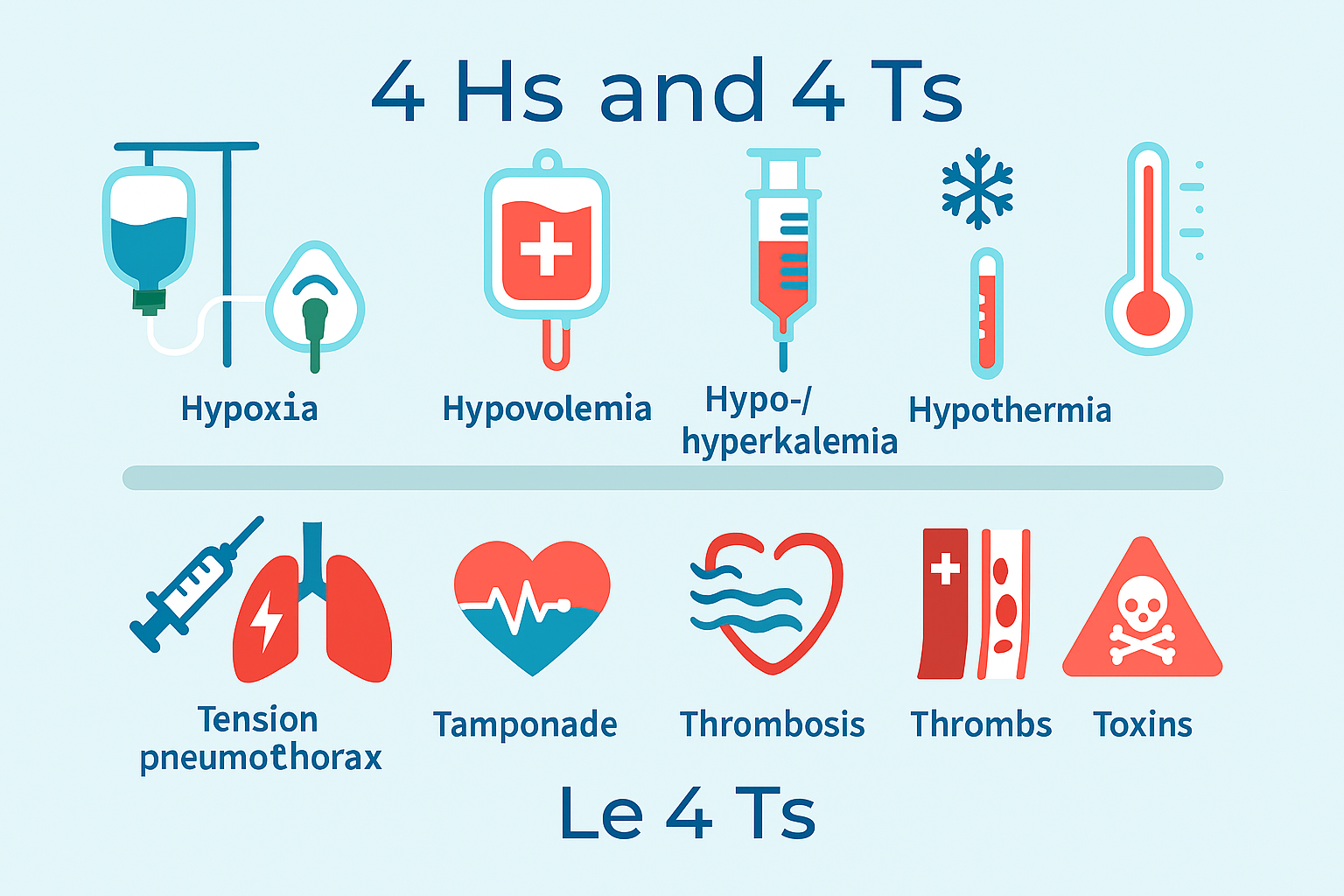
Identificazione e trattamento delle cause reversibili (4I e 4T)
Una parte fondamentale dell’ALS è la ricerca attiva e il trattamento delle cause potenzialmente reversibili di arresto cardiaco.
Le 4 I (o H in inglese)
- Ipossia: gestione avanzata delle vie aeree e ventilazione con ossigeno.
- Ipovolemia: rapida infusione di cristalloidi e controllo dell’emorragia.
- Ipo/Iperkaliemia e altri disordini metabolici: correzione basata su emogasanalisi e clinica.
- Ipotermia: riscaldamento attivo del paziente.
Le 4 T
- Trombosi (coronarica o polmonare): angioplastica post-ROSC per l’infarto; fibrinolisi per l’embolia polmonare massiva.
- Pneumotorace iperteso: decompressione immediata con toracentesi ad ago.
- Tamponamento cardiaco: pericardiocentesi per drenare il fluido dal sacco pericardico.
- Tossici: somministrazione di antidoti specifici, se disponibili.
Strumenti diagnostici aggiuntivi
L’ecografia point-of-care e l’emogasanalisi sono strumenti preziosi durante l’ALS per identificare rapidamente molte delle cause reversibili sopra elencate.
L’applicazione di questi interventi avanzati viene strategicamente modulata in base al ritmo cardiaco specifico presentato dal paziente.
Algoritmi di trattamento basati sul ritmo cardiaco
L’analisi del tracciato elettrocardiografico (ECG) rappresenta il bivio decisionale fondamentale nell’algoritmo ALS. Il ritmo cardiaco determina se il paziente può beneficiare di uno shock elettrico (defibrillazione), dividendo i percorsi di trattamento in due categorie principali: ritmi defibrillabili e ritmi non defibrillabili.
Gestione dei ritmi defibrillabili (FV/TV senza polso)
Questi ritmi, che includono la Fibrillazione Ventricolare (FV) e la Tachicardia Ventricolare senza polso (TV), rappresentano un’attività elettrica caotica o eccessivamente rapida che non produce una contrazione cardiaca efficace. Sono frequentemente associati a un’ischemia miocardica acuta.
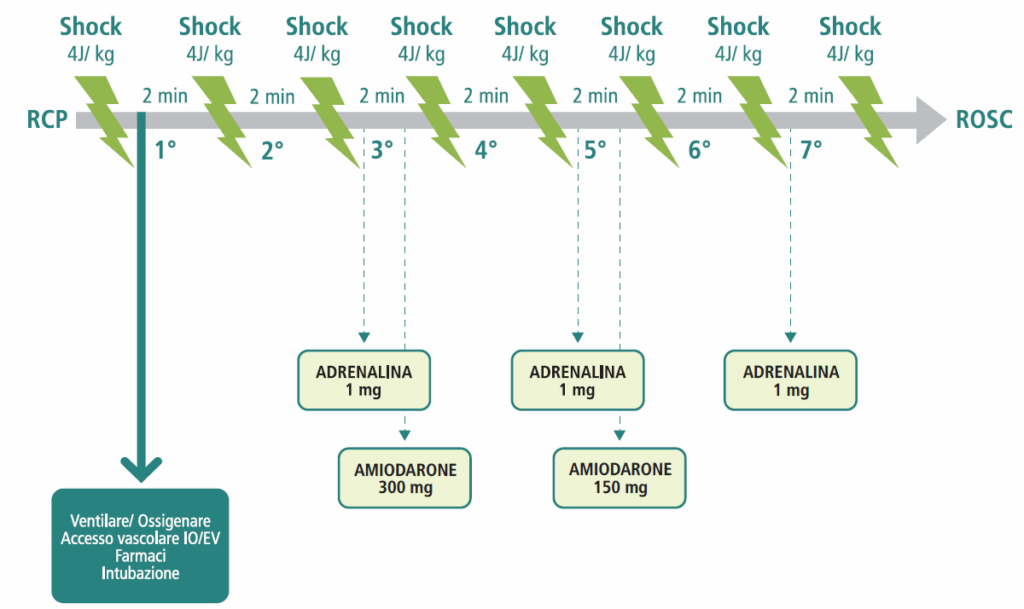
Algoritmo di trattamento:
- identificazione di un ritmo defibrillabile al monitor;
- erogazione di 1 shock singolo (es. 150J con defibrillatore bifasico);
- ripresa immediata della RCP (compressioni e ventilazioni) per 2 minuti, senza controllare il ritmo o il polso;
- dopo 2 minuti, breve pausa per la rivalutazione del ritmo. Se persiste un ritmo defibrillabile, erogare un 2° shock;
- ripresa immediata della RCP per 2 minuti;
- dopo 2 minuti, rivalutazione del ritmo. Se persiste, erogare un 3° shock;
- subito dopo il 3° shock, somministrare Adrenalina 1 mg e Amiodarone 300 mg per via endovenosa o intraossea;
- continuare la sequenza di 2 minuti di RCP seguiti da analisi del ritmo e shock se indicato. Somministrare Adrenalina 1 mg ogni 3-5 minuti (cioè dopo il 5°, 7° shock, ecc.) e una seconda e ultima dose di Amiodarone 150 mg dopo il 5° shock.
Gestione dei ritmi non defibrillabili (PEA/Asistolia)
Questi ritmi includono l’asistolia (assenza completa di attività elettrica, “linea piatta”) e l’attività elettrica senza polso (PEA), in cui è presente un ritmo organizzato all’ECG ma non si genera un polso palpabile. Entrambi sono spesso secondari a cause reversibili e la loro prognosi è infausta se non si identifica e tratta la causa sottostante.
Algoritmo di trattamento:
- identificazione di un ritmo non defibrillabile al monitor;
- somministrare adrenalina 1 mg non appena è disponibile un accesso vascolare;
- continuare la RCP di alta qualità per 2 minuti;
- dopo 2 minuti, breve pausa per la rivalutazione del ritmo;
- continuare la sequenza (cicli di 2 minuti di RCP seguiti da analisi del ritmo), somministrando adrenalina 1 mg ogni 3-5 minuti.
- durante i cicli di RCP, l’obiettivo primario del team è ricercare e trattare attivamente le cause reversibili (le 4I e le 4T).
Oltre alla gestione dell’arresto cardiaco conclamato, il personale sanitario deve essere preparato a gestire le condizioni di instabilità che possono precederlo o seguirlo.
Gestione delle aritmie peri-arresto
Le aritmie peri-arresto sono condizioni di estrema instabilità emodinamica che, se non trattate prontamente e in modo appropriato, possono evolvere rapidamente in un arresto cardiaco o complicare significativamente la fase post-rianimatoria.
Now loading…
Tachicardie con polso
- Tachicardia Ventricolare con polso (emodinamicamente instabile): il trattamento di scelta è la cardioversione elettrica sincronizzata. Si inizia con un’energia di 120-150 Joule (bifasico), con la possibilità di aumentare l’energia negli shock successivi in caso di insuccesso;
- Fibrillazione Atriale emodinamicamente instabile: l’approccio è sequenziale e richiede cautela:
- esclusione di trombi atriali: è necessario assicurarsi che non vi siano trombi in auricola sinistra (tramite ecocardiografia transesofagea) o che l’aritmia sia insorta da meno di 48 ore;
- cardioversione farmacologica: si tenta un primo approccio con amiodarone 300 mg infuso in 10-20 minuti;
- cardioversione elettrica: in caso di fallimento della terapia farmacologica, si procede con una cardioversione elettrica sincronizzata ad alta energia (fino a 300 Joules);
- mantenimento: dopo il ripristino del ritmo sinusale, si imposta un’infusione di mantenimento con amiodarone 900 mg nelle 24 ore.
Bradicardie sintomatiche con polso
- il farmaco di prima linea è l’atropina, somministrata in boli endovenosi da 0.5 mg, ripetibili fino a un dosaggio massimo totale di 3 mg;
- in caso di refrattarietà all’atropina, le alternative sono l’isoprenalina o l’adrenalina in infusione;
- nei pazienti con trapianto cardiaco, che non rispondono all’atropina, il farmaco indicato è l’aminofillina.
Nota sulla sedazione
È mandatorio somministrare un’adeguata sedazione a un paziente cosciente prima di eseguire una cardioversione elettrica. La procedura è dolorosa e stressante e deve essere eseguita in condizioni di comfort e sicurezza per il paziente.
Dalle emergenze di natura elettrica si passa ora a quelle di natura meccanica che possono ostruire le vie aeree.
Ostruzione delle vie aeree da corpo estraneo
Il soffocamento da corpo estraneo è un’emergenza medica ad insorgenza improvvisa, spesso testimoniata, che richiede un intervento immediato. I segni caratteristici includono distress respiratorio, tosse, stridore o l’incapacità di emettere suoni. Le manovre di disostruzione mirano ad aumentare la pressione intratoracica per espellere l’oggetto.
Algoritmo di gestione nell’adulto e bambino cosciente
I passaggi decisionali e operativi si basano sulla valutazione dell’efficacia della tosse della vittima.
- valutazione iniziale: chiedere alla vittima “Ti senti soffocare?“;
- se la tosse è efficace (ostruzione parziale): la vittima è in grado di parlare, tossire e respirare. In questo caso, l’intervento migliore è incoraggiare la vittima a continuare a tossire. Non eseguire altre manovre, che potrebbero peggiorare l’ostruzione;
- se la tosse è inefficace (ostruzione completa): la vittima non riesce a parlare, la tosse è debole o assente, e la respirazione è difficoltosa o impossibile. È necessario un intervento attivo:
- posizionare la vittima leggermente protesa in avanti;
- eseguire fino a 5 colpi interscapolari decisi (colpi dorsali);
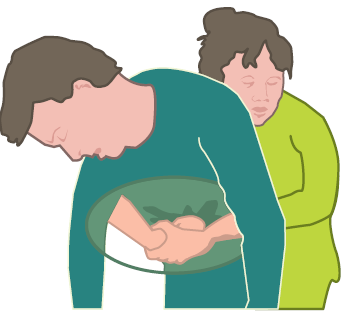
- se l’ostruzione persiste, eseguire fino a 5 compressioni addominali (manovra di Heimlich): posizionarsi dietro la vittima, circondarla con le braccia, porre una mano a pugno tra l’ombelico e lo sterno e afferrarla con l’altra mano, quindi eseguire una compressione energica verso l’interno e verso l’alto;
- alternare cicli di 5 colpi dorsali e 5 compressioni addominali fino alla risoluzione dell’ostruzione o alla perdita di coscienza.
Gestione del lattante cosciente
Il trattamento del lattante (<1 anno) presenta una differenza fondamentale: le compressioni addominali sono vietate a causa dell’alto rischio di lesioni agli organi interni. La sequenza corretta prevede l’alternanza di:
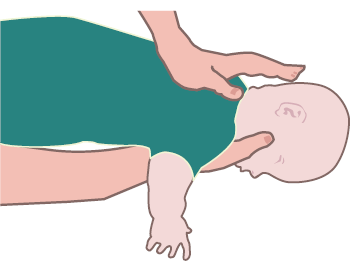
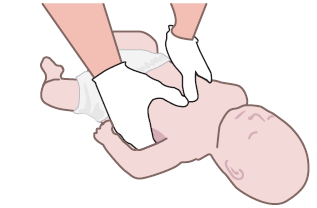
- 5 colpi interscapolari, con il lattante posizionato a pancia in giù sull’avambraccio del soccorritore;
- 5 compressioni toraciche, con il lattante a pancia in su. Le compressioni sono simili a quelle della RCP ma eseguite in modo più brusco e a un ritmo più lento.
Evoluzione in incoscienza
Se in qualsiasi momento la vittima diventa incosciente, deve essere adagiata a terra e si deve iniziare immediatamente la RCP standard (30:2), dopo aver allertato i soccorsi. Le compressioni toraciche, oltre a garantire un minimo di circolo, generano alte pressioni nelle vie aeree e possono contribuire a smuovere il corpo estraneo.
È fondamentale saper adattare tutti i protocolli discussi finora alle specificità anatomiche e fisiologiche dell’età pediatrica.
Specificità della Rianimazione Cardiopolmonare pediatrica
Esistono protocolli specifici per la RCP pediatrica perché l’eziologia dell’arresto cardiaco nel bambino è radicalmente diversa da quella dell’adulto. Mentre nell’adulto la causa è primariamente cardiaca (ischemica/aritmica), nel bambino l’arresto cardiaco è quasi sempre l’evento finale di un’insufficienza respiratoria o di uno shock non trattato. Questa differenza eziologica impone modifiche sostanziali alla sequenza di rianimazione. Le linee guida pediatriche si applicano ai bambini fino all’età della pubertà; il termine “lattante” si riferisce ai bambini di età inferiore a 1 anno.
Quando si interviene su un bambino o un lattante, la sequenza BLS standard viene modificata come segue:
- inizio della sequenza: prima di iniziare le compressioni toraciche, si eseguono 5 ventilazioni di soccorso. Questo intervento mira a correggere l’ipossia, che è la causa più probabile del collasso;
- chiamata d’aiuto (soccorritore singolo): se il soccorritore è solo, deve eseguire 1 minuto di RCP (circa 5 cicli) prima di allontanarsi per chiamare i soccorsi. L’eccezione è il caso, raro, di un collasso improvviso e testimoniato, che potrebbe avere una causa cardiaca e beneficiare di una defibrillazione più precoce;
- rapporto compressioni/ventilazioni: si utilizza un rapporto di 15 compressioni e 2 ventilazioni (15:2) per ottimizzare la ventilazione;
- tecnica di compressione:
- lattante (<1 anno): si utilizzano le punte di due dita o la tecnica a due pollici con le mani che avvolgono il torace;
- bambino (>1 anno): si utilizza il calcagno di una o due mani, a seconda delle dimensioni del bambino, per ottenere la profondità adeguata;
- profondità di compressione: l’obiettivo è comprimere il torace per almeno 1/3 del suo diametro antero-posteriore (corrispondente a circa 4 cm nel lattante e 5 cm nel bambino).
| Parametro | ADULTO | BAMBINO/LATTANTE |
|---|---|---|
| CAUSA PIÙ FREQUENTE | Ischemia cardiaca | Insufficienza respiratoria |
| INIZIO DELLA RCP | Compressioni toraciche | 5 ventilazioni di soccorso, poi compressioni |
| CHIAMARE I SOCCORSI (SINGOLO SOCCORRITORE) | Prima della RCP | Dopo 1 minuto di RCP |
| VALUTAZIONE DEL POLSO (SOLO ESPERTO) | Carotideo | Carotideo o femorale (bambino), brachiale o femorale (lattante) |
| RAPPORTO COMPRESSIONI:VENTILAZIONI | 30:2 | 15:2 |
| TECNICA DI MASSAGGIO | A due mani sullo sterno inferiore | A una o due mani (bambino); due dita o due pollici (lattante) |
| PROFONDITÀ DI COMPRESSIONE | 5-6 cm | 1/3 del diametro del torace (4 cm lattante, 5 cm bambino) |
| DAE | Piastre autoadesive da adulto | <1 anno: sconsigliato. 1-8 anni: piastre autoadesive pediatriche e riduttore (50-75 J). >8 anni: piastre autoadesive da adulto e dosi normali. Nota: in caso questo materiale non fosse disponibile, è meglio utilizzare un DAE in modalità standard che privarsi di questo strumento. |
| PRIMA SCARICA (DEFIBRILLATORE MANUALE) | 150-200 J | ERC: 4 J/kg |
| ADRENALINA EV/IO | 1 mg | 0.01 mg/kg (max 1 mg) |
| AMIODARONE | 300 mg (3° shock), 150 mg (5° shock) | 5 mg/kg (3° e 5° shock) |
| OSTRUZIONE VIE AEREE (TOSSE INEFFICACE) | 5 colpi interscapolari e 5 compressioni addominali | 5 colpi interscapolari e 5 compressioni addominali (bambino); 5 colpi interscapolari e 5 compressioni toraciche (lattante) |
Specificità dell’ALS Pediatrico
Anche il supporto vitale avanzato pediatrico presenta differenze chiave, in particolare nei dosaggi dei farmaci, che sono basati sul peso (adrenalina 0.01mg/kg, amiodarone 5mg/kg), e nell’energia di defibrillazione, che è di 4 Joule/kg secondo le linee guida ERC.
Il successo della rianimazione non si conclude con la ripresa del battito, ma prosegue con una gestione attenta e mirata del paziente una volta che il circolo spontaneo è stato ripristinato.
Caricamento….
Gestione integrata del paziente post-ROSC (Return of Spontaneous Circulation)
La fase successiva al ripristino del circolo spontaneo (ROSC) è un periodo critico e complesso, noto come “sindrome post-arresto cardiaco”. L’obiettivo principale è stabilizzare le funzioni vitali del paziente, identificare e trattare la causa scatenante dell’arresto e implementare strategie per ottimizzare la prognosi, in particolare quella neurologica.
Now loading…
La gestione immediata segue l’approccio sistematico ABCDE per affrontare le priorità fisiologiche:
- A (Airway) e B (Breathing): garantire la pervietà delle vie aeree con un presidio avanzato (es. tubo endotracheale). Ottimizzare la ventilazione per mantenere una SpO2 tra il 94% e il 98% e raggiungere la normocapnia (livelli normali di CO2), monitorata tramite capnografia;
- C (Circulation): eseguire un ECG a 12 derivazioni il prima possibile per identificare cause cardiache come un infarto miocardico. Stabilire un accesso venoso stabile e mirare a mantenere una Pressione Arteriosa Sistolica >100 mmHg, utilizzando fluidi (cristalloidi) e, se necessario, farmaci vasopressori o inotropi;
- D (Disability): dopo aver ristabilito il circolo del paziente, si valuta l’eventuale presenza di deficit neurologici. La natura di tali deficit deve essere approfondita mediante esami strumentali, come TC o angio-TC;
- E: (Exposure): il paziente deve essere svestito (esposto). L’obiettivo è identificare segni di contusione o possibili fonti occulte di sanguinamento che potrebbero essere i fattori scatenanti dell’arresto cardiaco. Questa fase è legata all’identificazione e correzione delle “cause reversibili”.
L’ECG a 12 derivazioni guida il percorso diagnostico-terapeutico successivo:
- se l’ECG mostra un sopraslivellamento del tratto ST (STEMI), il paziente deve essere indirizzato urgentemente a un laboratorio di emodinamica per angiografia coronarica e angioplastica percutanea (PCI);
- se l’ECG non mostra un’elevazione dell’ST ma il sospetto di una causa cardiaca rimane alto, l’angiografia coronarica deve essere comunque presa in considerazione;
- se la causa cardiaca è ritenuta improbabile, si devono eseguire esami diagnostici alternativi, come una TC cranio o un’angio-TC polmonare, per ricercare altre cause (es. embolia polmonare, emorragia cerebrale).
La gestione del paziente in Unità di Terapia Intensiva (ICU) è fondamentale per mitigare il danno multiorgano e migliorare l’outcome neurologico. Gli interventi chiave includono:
- controllo mirato della temperatura (TTM): mantenere una temperatura corporea costante tra 32 °C e 36 °C per almeno 24-48 ore per proteggere il cervello dal danno da riperfusione e prevenzione della febbre (peggioramento dell’outcome neurologico);
- supporto ventilatorio: utilizzare una strategia di ventilazione protettiva per minimizzare il danno polmonare, mantenendo normossia e normocapnia;
- supporto emodinamico: monitorare attentamente la pressione arteriosa e la perfusione d’organo, evitando assolutamente l’ipotensione;
- controllo metabolico: mantenere la normoglicemia per prevenire ulteriori danni neurologici;
- controllo neurologico: monitorare e trattare prontamente le convulsioni, che sono comuni dopo un arresto cardiaco.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.
Now loading…