La comprensione della malattia di Alzheimer (AD) ha subito un’evoluzione paradigmatica negli ultimi decenni, passando da una diagnosi basata esclusivamente sull’osservazione clinica ex post a una caratterizzazione biologica in vivo supportata da biomarcatori avanzati.1 2
In questo contesto, la Tomografia ad Emissione di Positroni (PET) con il radiofarmaco 18F-fluorodeossiglucosio (18F-FDG) si è affermata come uno strumento indispensabile per la valutazione del metabolismo glucidico cerebrale, agendo come un indicatore sensibile della disfunzione sinaptica e della neurodegenerazione.3 4
Il presente articolo analizza in modo esaustivo la natura della patologia, i principi biofisici dell’imaging molecolare, i protocolli operativi standardizzati, la diversità dei fenotipi clinici e le sfide interpretative poste dalla diagnosi differenziale e dai fattori interferenti.
La malattia di Alzheimer: inquadramento patologico e nosologico
La malattia di Alzheimer è definita come unapatologia neurodegenerativa cronica e progressiva che rappresenta la causa principale di demenza nella popolazione anziana.5 Dal punto di vista neuropatologico, la condizione è caratterizzata dalla deposizione extracellulare di placche della proteina beta-amiloide (Aβ) e dall’accumulo intracellulare di grovigli neurofibrillari composti da proteina tau iperfosforilata.
Sebbene l’ipotesi della cascata amiloidea suggerisca che l’accumulo di Aβ sia l’evento scatenante primario nelle fasi precliniche, l’evidenza scientifica attuale indica che la progressione dei sintomi clinici e il danno neuronale sono più strettamente correlati alla distribuzione e alla densità della patologia tau e alla conseguente riduzione del metabolismo sinaptico.6
Evoluzione del concetto di Alzheimer
Storicamente, l’Alzheimer è stato identificato quasi esclusivamente con un deficit della memoria episodica a esordio insidioso. Tuttavia, la ricerca moderna ha evidenziato una notevole eterogeneità fenotipica, classificando la malattia non come una singola entità clinica, ma come uno spettro di presentazioni che riflettono la vulnerabilità selettiva di diverse reti neurali.7
Circa il 25-50% dei pazienti non presenta inizialmente una sindrome amnesica, manifestando invece deficit nel linguaggio, nelle funzioni visuo-spaziali o nelle capacità esecutive.8 9
Queste “varianti atipiche” colpiscono spesso individui in età presenile (sotto i 65 anni) e pongono sfide diagnostiche significative, poiché i sintomi iniziali possono sovrapporsi a quelli di altre malattie neurodegenerative come la demenza frontotemporale (FTD) o la demenza a corpi di Lewy (DLB).10
La diagnosi precoce in questi casi è fondamentale non solo per la gestione clinica, ma anche per l’accesso a futuri trattamenti mirati che potrebbero essere efficaci solo se somministrati nelle fasi iniziali della degenerazione.11
Il principio di funzionamento della PET-FDG nel cervello
La PET con 18F-FDG è una tecnica di imaging funzionale che mappa la distribuzione regionale del consumo di glucosio nel cervello.12 Il cervello è un organo metabolicamente esigente: sebbene rappresenti solo il 2% del peso corporeo, consuma circa il 20% del glucosio totale dell’organismo. Oltre il 95% dell’energia (ATP) richiesta per il mantenimento delle funzioni neuronali, in particolare per il ripristino dei potenziali di membrana dopo la trasmissione sinaptica, deriva dal metabolismo ossidativo del glucosio.
Meccanismo biomolecolare del 18F-FDG
L’uso del 18F-FDG si basa sul principio dell’intrappolamento metabolico. Essendo un analogo del glucosio, il 18F-FDG viene trasportato attraverso la barriera emato-encefalica dai trasportatori del glucosio (GLUT-1 negli astrociti e GLUT-3 nei neuroni).
All’interno della cellula, l’enzima esochinasi fosforila il tracciante in 18F-FDG-6-fosfato. A differenza del glucosio naturale, la struttura del 18F-FDG impedisce l’ulteriore metabolismo attraverso la via glicolitica, e la bassa attività dell’enzima glucosio-6-fosfatasi nel tessuto cerebrale impedisce la defosforilazione e la successiva uscita della molecola dalla cellula.
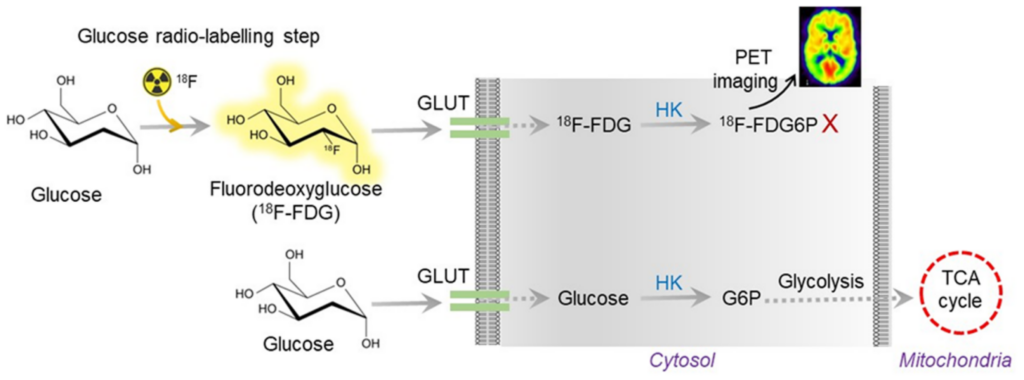
Questo processo determina un accumulo intracellulare di radioattività proporzionale al tasso di consumo regionale di glucosio (rCMRglc) al momento dell’iniezione. Di conseguenza, la PET FDG agisce come un proxy dell’attività sinaptica e dell’integrità neuronale: aree con disfunzione sinaptica o perdita neuronale mostreranno una riduzione della captazione del tracciante, definita ipometabolismo.
È importante sottolineare che l’uptake di FDG dipende anche dalle interazioni funzionali tra astrociti e neuroni e, in condizioni patologiche, può essere influenzato dall’attivazione microgliale legata ai processi infiammatori.
Protocollo operativo e standardizzazione dell’esame
Per ottenere immagini di alta qualità e garantire che i dati siano confrontabili con database normativi, l’esecuzione della PET FDG deve seguire rigidi protocolli di preparazione e acquisizione. La variabilità nei livelli di glucosio plasmatico o negli stimoli sensoriali durante la fase di captazione può introdurre artefatti che rendono difficile l’interpretazione.13
Preparazione del paziente e stato metabolico
La gestione del paziente inizia diverse ore prima dell’esame. Il digiuno è obbligatorio per un periodo di 4-6 ore per minimizzare i livelli di insulina circolante, che guiderebbe il tracciante verso il tessuto muscolare a scapito del cervello.
Un livello di glicemia superiore a 200 mg/dL è considerato un criterio di rinvio o richiede una gestione attenta, poiché il glucosio freddo compete con il 18F-FDG per i trasportatori GLUT, riducendo drasticamente il segnale cerebrale.
| Preparazione | Requisiti e specifiche |
|---|---|
| Digiuno | Minimo 4-6 ore; idratazione orale con sola acqua consentita. |
| Glicemia | Valore ideale <160 mg/dL; limite massimo generalmente 200 mg/dL. |
| Sostanze da evitare | Caffeina, alcol, nicotina e farmaci psicoattivi (se possibile) nelle 24 h precedenti. |
| Riposo sensoriale | Ambiente silenzioso, luce soffusa, assenza di interazione verbale. |
| Posizionamento | Allineamento sulla linea orbito-meatale per standardizzare l’orientamento spaziale. |
Iniezione, captazione e acquisizione delle immagini
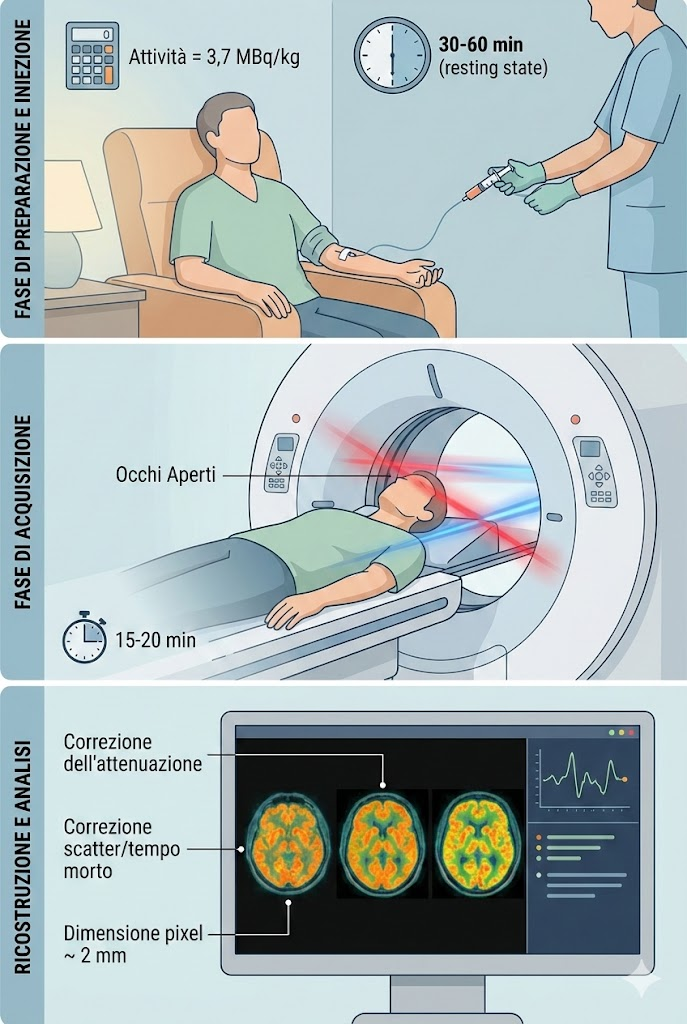
L’attività somministrata deve essere calcolata in base al peso del paziente (solitamente circa 3,7 MBq/kg). Dopo l’iniezione, segue un intervallo di captazione di 30-60 minuti. Durante questa fase, il cervello deve trovarsi in uno “stato di riposo” (resting state).
È fondamentale mantenere la coerenza nelle condizioni ambientali: se l’esame viene eseguito con gli occhi aperti, la captazione nella corteccia occipitale sarà superiore rispetto a un esame eseguito con gli occhi chiusi. La maggior parte delle linee guida raccomanda che il paziente tenga gli occhi aperti per evitare cali fisiologici di metabolismo che potrebbero simulare una demenza a corpi di Lewy.
L’acquisizione dura tipicamente 15-20 minuti. L’impiego della PET/CT consente l’uso della TC per la correzione dell’attenuazione, riducendo i tempi rispetto alle vecchie sorgenti radioattive e fornendo mappe anatomiche precise.
I parametri di ricostruzione devono includere correzioni per lo scatter, il tempo morto e la normalizzazione, con una dimensione dei pixel preferibilmente attorno ai 2 mm per massimizzare la risoluzione spaziale.
Fenotipi dell’Alzheimer e pattern di ipometabolismo
L’identificazione dell’Alzheimer si basa sul riconoscimento di pattern spaziali di ipometabolismo che riflettono la distribuzione del danno neuronale. La “firma” metabolica dell’AD tipico è ben documentata, ma le varianti atipiche richiedono una conoscenza approfondita delle reti neurali coinvolte.
Alzheimer tipico (amnesico)
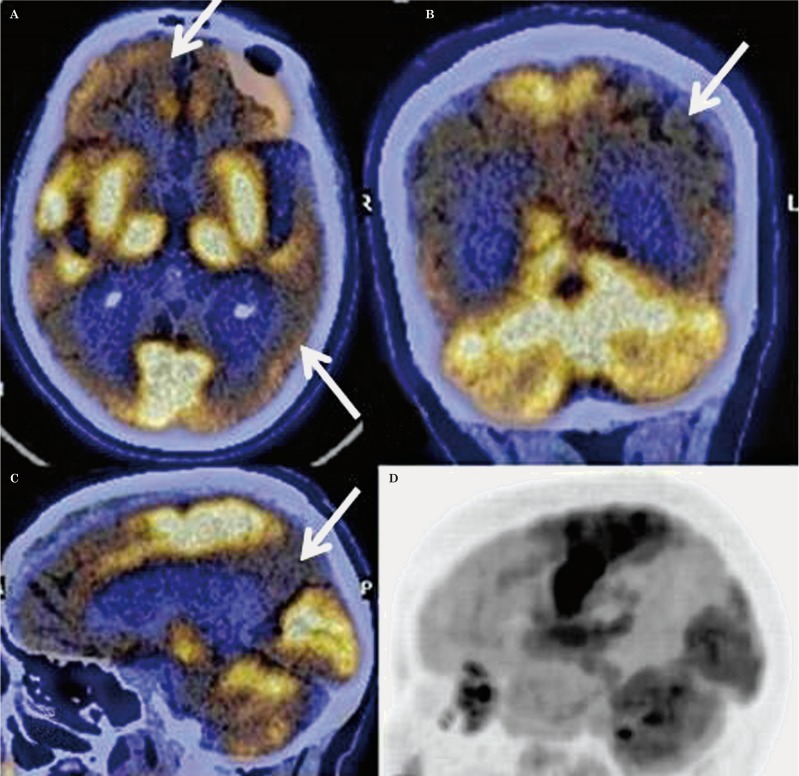
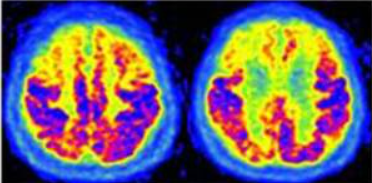
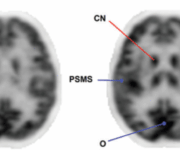
Nella forma classica, l’ipometabolismo inizia solitamente nelle regioni della Default Mode Network (DMN). Le aree precocemente colpite includono la corteccia cingolata posteriore e il precuneo.14 Successivamente, il deficit si estende alle cortecce associative temporo-parietali (giro angolare, giro temporale medio e inferiore) e, nelle fasi più avanzate, ai lobi frontali (cortecce prefrontali associative).
Un segno distintivo dell’AD è il risparmio relativo della corteccia motoria e sensoriale primaria, della corteccia visiva primaria, dei gangli della base, del talamo e del cervelletto.
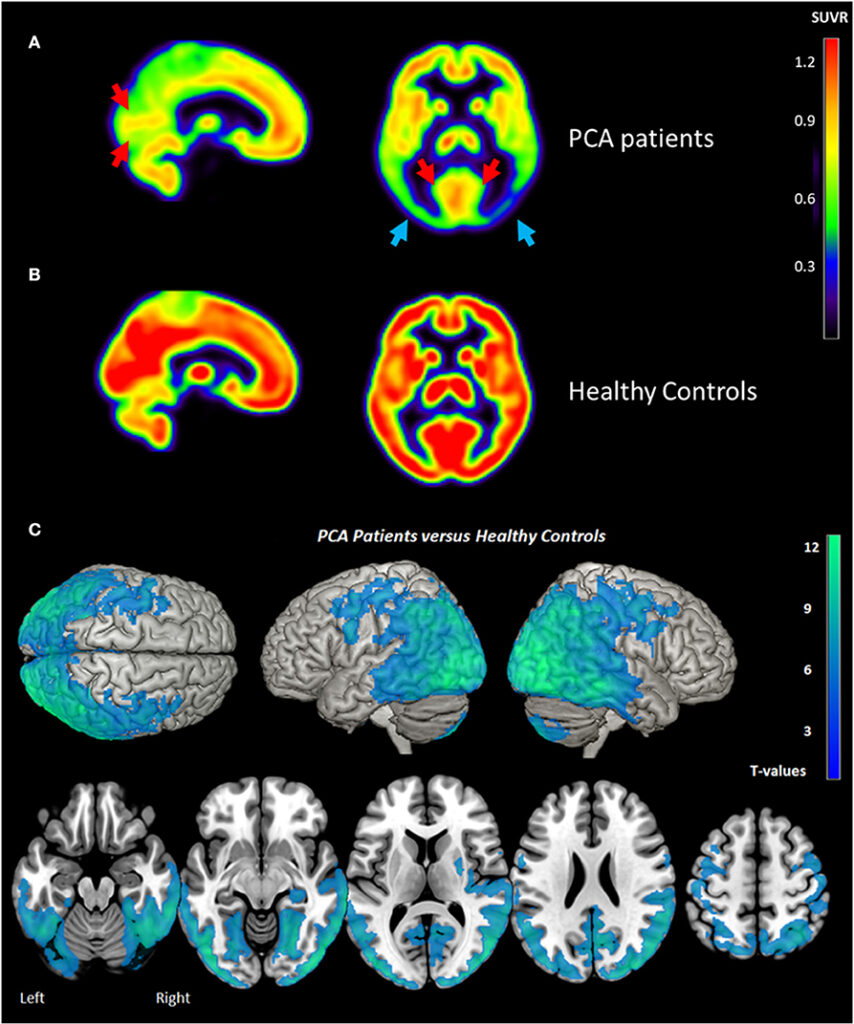
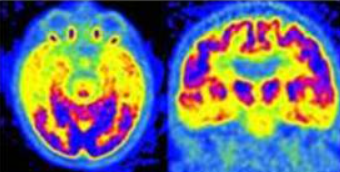
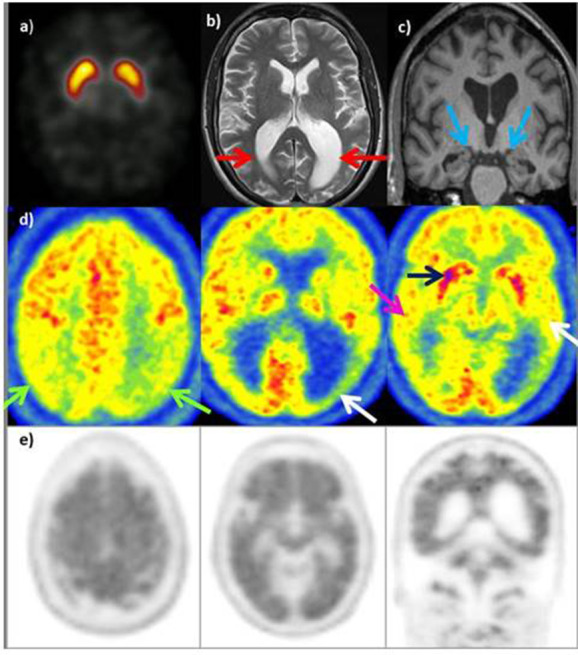
Atrofia Corticale Posteriore (PCA) – Variante visiva
La PCA rappresenta una variante “posteriore” dell’Alzheimer, caratterizzata da un esordio con disturbi della visione di alto livello.15
Dal punto di vista metabolico, si osserva un ipometabolismo marcato nelle regioni occipito-parietali e temporali posteriori.16 A differenza dell’AD tipico, il coinvolgimento della corteccia visiva primaria può essere presente, e il deficit parietale è spesso più grave ed esteso.
Variante Logopenica della PPA (lvPPA) – Variante linguistica
La lvPPA (Afasia Primaria Progressiva variante logopenica) è quasi invariabilmente causata dalla patologia Alzheimer. Il pattern metabolico è fortemente asimmetrico, con un ipometabolismo localizzato nella regione temporo-parietale sinistra, in particolare attorno al giro temporale superiore posteriore e al giro angolare. Questo riflette clinicamente l’incapacità di recuperare le parole e la compromissione della memoria di lavoro fonologica.
Variante disecutiva e comportamentale
Meno comune, questa variante colpisce le aree prefrontali dorsolaterali e parietali superiori, manifestandosi con deficit della pianificazione e del controllo inibitorio.
In questi casi, la PET FDG può mostrare un ipometabolismo frontale che simula la FTD, rendendo necessari biomarcatori di amiloide per una corretta diagnosi eziologica.
Caricamento….
Distinguere l’Alzheimer da altre demenze
La capacità della PET FDG di distinguere tra i diversi sottotipi di demenza è uno dei suoi contributi clinici più rilevanti, specialmente quando la presentazione clinica è ambigua o “mista”.
Confronto tra AD e Demenza Frontotemporale (FTD)
La distinzione tra AD e FTD è cruciale per la gestione farmacologica (ad esempio, l’uso di inibitori dell’acetilcolinesterasi è indicato nell’AD ma può peggiorare i sintomi comportamentali nella FTD).17
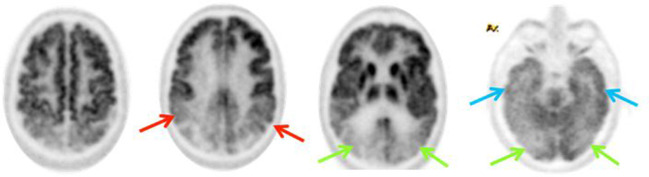
Pattern FTD: ipometabolismo predominante nei lobi frontali, nelle porzioni anteriori dei lobi temporali e nella corteccia cingolata anteriore.
Accuratezza: la PET FDG mostra una sensibilità del 96% e una specificità dell’84% nel differenziare queste due condizioni.
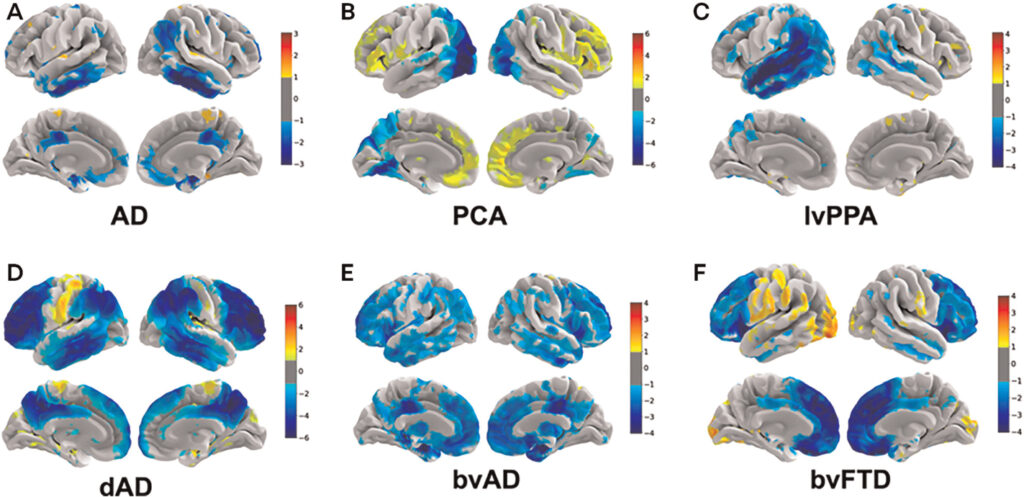
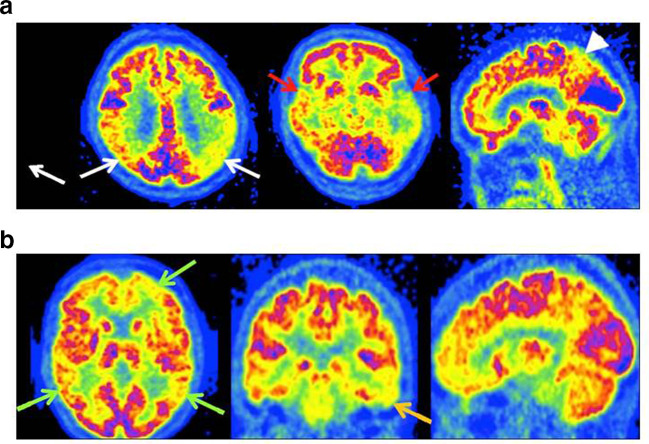
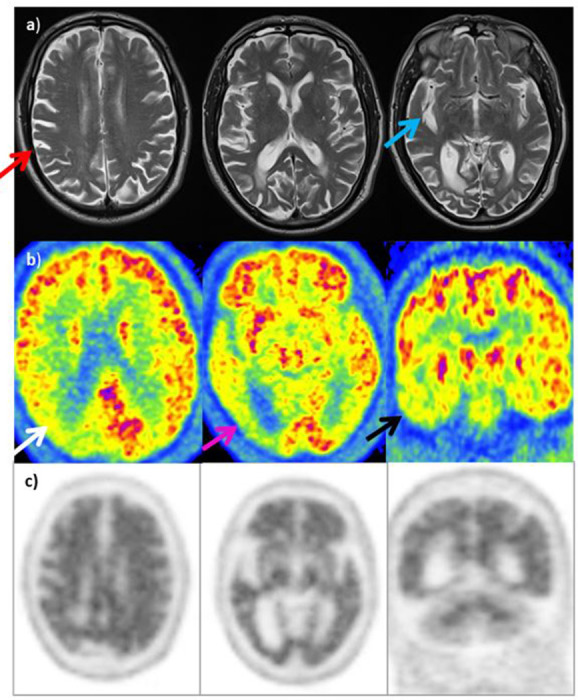
(B) PCA: ipometabolismo nelle aree occipitali e parietali e un relativo ipermetabolismo nel lobo frontale.
(C) Variante logopenica dell’afasia primaria progressiva (lvPPA): mostra ipometabolismo nelle aree temporali e parietali sinistre.
(D) AD disesecutiva (dAD): ipometabolismo nella corteccia associativa eteromodale e ipermetabolismo nelle cortecce sensoriali e motorie primarie.
(E) Variante comportamentale dell’AD (bvAD): ipometabolismo nelle cortecce frontali, temporali mediali e del cingolo.
(F) bvFTD: ipometabolismo nel lobo frontale e ipermetabolismo nelle aree occipitali e parietali.
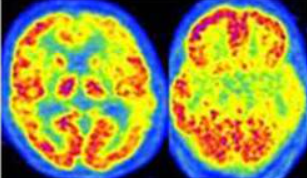
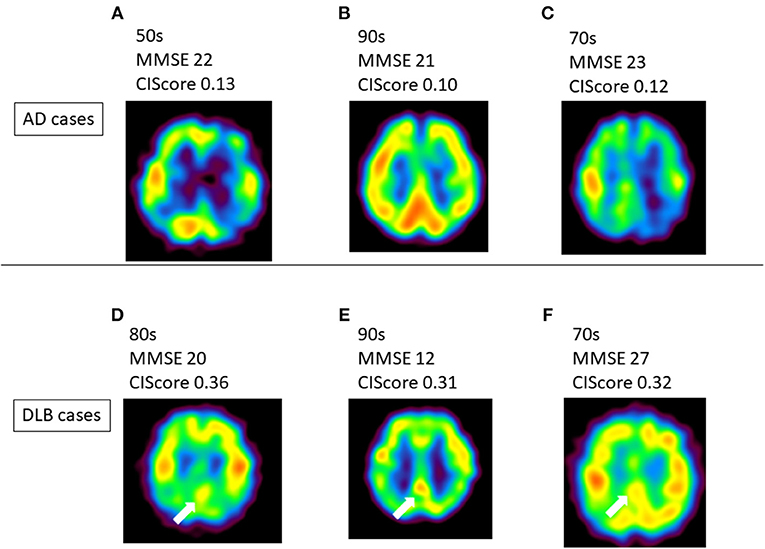
La Demenza a Corpi di Lewy (DLB) e il “Cingulate Island Sign“
La DLB si manifesta spesso con ipometabolismo parieto-occipitale, simile alla PCA, ma con una distinzione fondamentale riguardante il cingolo posteriore.
Cingulate Island Sign (CIS): si riferisce alla relativa preservazione del metabolismo nella corteccia cingolata posteriore nonostante il marcato ipometabolismo nel precuneo e nelle aree occipitali circostanti.18
Il CIS ha una specificità estremamente elevata (fino al 100% in alcuni studi) per la DLB rispetto all’AD, dove il cingolo posteriore è tipicamente una delle prime aree a diventare ipometaboliche.19
Demenza vascolare (VaD)
Nella VaD, la PET FDG rivela spesso un pattern asimmetrico e focale, con aree di ipometabolismo “a macchia” che non seguono la distribuzione dei circuiti neurodegenerativi classici. Spesso si osserva il coinvolgimento di strutture sottocorticali come i gangli della base e il talamo, oltre alla possibile presenza di diaschisi cerebellare crociata (riduzione del metabolismo in un emisfero cerebellare secondaria a un insulto corticale controlaterale).
| Confronto diagnostico | Sensibilità (media) | Specificità (media) |
|---|---|---|
| AD vs. soggetti sani | 99% | 98% |
| AD vs. FTD | 96% | 84% |
| AD vs. DLB | 93% | 92% |
| AD vs. tutte le non-AD | 86% | 88% |
Pitfalls, artefatti e sfide nell’interpretazione
L’accuratezza della PET FDG può essere compromessa da numerosi fattori che il lettore esperto deve saper identificare e mitigare.
Effetto volume parziale (PVE) e atrofia
L’effetto volume parziale è una limitazione fisica intrinseca della PET dovuta alla sua risoluzione spaziale finita (4-6 mm FWHM).20
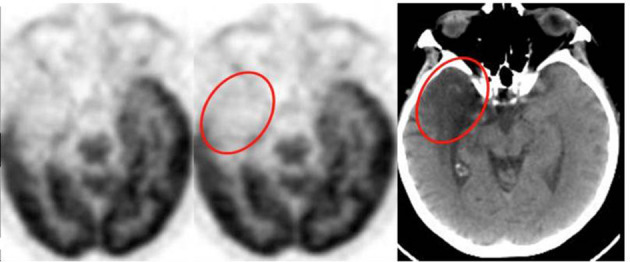
Quando la corteccia cerebrale si assottiglia a causa dell’atrofia, i voxel PET includono una miscela di segnale proveniente dalla sostanza grigia e dal fluido cerebrospinale metabolicamente inattivo.21 Ciò si traduce in un apparente ipometabolismo che può essere puramente strutturale piuttosto che funzionale. Per correggere questo fenomeno, sono stati sviluppati metodi di correzione (PVC) come l’algoritmo di Müller-Gärtner, che utilizza l’informazione anatomica della RM per “riportare” i valori metabolici alla reale concentrazione della sostanza grigia.
Interferenze farmacologiche
Now loading…
Molte classi di farmaci comunemente prescritte nella popolazione anziana alterano il metabolismo glucidico cerebrale:22
- benzodiazepine: causano una riduzione globale e progressiva dell’uptake di FDG (fino al 23% in caso di uso cronico), sebbene solitamente preservino i pattern regionali;
- corticosteroidi: possono indurre iperglicemia e alterare la permeabilità della barriera emato-encefalica, riducendo la captazione globale;
- levodopa: nei pazienti con parkinsonismo, può ridurre regionalmente il metabolismo; le linee guida suggeriscono di eseguire l’esame in stato “off”.
Artefatti tecnici e varianti normali
Il movimento del paziente durante l’acquisizione è una causa comune di artefatti, specialmente nelle aree periferiche del cervello o nella base cranica, dove l’errore di registrazione con la TC di correzione dell’attenuazione può generare falsi deficit.
Inoltre, il normale invecchiamento comporta una riduzione fisiologica del metabolismo, prevalentemente nelle regioni frontali e nel cingolo anteriore, che non deve essere confusa con una demenza in fase iniziale.
Caricamento….
Integrazione tra clinica, neuropsicologia e imaging
La PET FDG raggiunge il suo massimo valore diagnostico quando integrata con i test neuropsicologici, che forniscono la misura della riserva cognitiva e del deficit funzionale attuale.23
Correlazioni tra MMSE, MoCA e pattern metabolici
I punteggi dei test di screening globale come il Mini-Mental State Examination (MMSE) e il Montreal Cognitive Assessment (MoCA) mostrano una correlazione significativa con l’estensione dell’ipometabolismo nelle regioni temporo-parietali e nella DMN.24
Tuttavia, l’MMSE è spesso criticato per la sua bassa sensibilità nelle fasi precoci e per la dipendenza dal livello di scolarità; in questo ambito, la PET FDG può mostrare anomalie anche quando i punteggi dei test sono ancora nel range di normalità.
Test di dominio specifico
L’analisi dei singoli domini cognitivi permette di prevedere con precisione l’area di ipometabolismo sottostante:
- Rey-Osterrieth Complex Figure (ROCF): le prestazioni nella copia di questa figura complessa correlano strettamente con l’integrità metabolica delle regioni parieto-occipitali bilaterali e della corteccia frontale destra.25 Un deficit isolato in questo test suggerisce un coinvolgimento delle aree visuo-costruttive posteriore (tipico della PCA o dell’AD a esordio posteriore);
- Trail Making Test (TMT) e fluenza verbale: correlano con il metabolismo nelle regioni frontali e temporali laterali, fornendo indicazioni sulla funzionalità dei circuiti esecutivi e linguistici;
- Boston Naming Test (BNT): un deficit nel recupero dei nomi è un marker sensibile per la variante logopenica (ipometabolismo temporale posteriore sinistro) o per la variante semantica (ipometabolismo temporale anteriore sinistro).
Analisi quantitativa tramite software avanzati
L’interpretazione visiva può essere soggettiva e soggetta a bias. L’uso di software di quantificazione automatizzata aumenta significativamente l’accuratezza e la fiducia del clinico. Strumenti come CortexID Suite e MIMneuro permettono di generare mappe di Z-score che confrontano l’uptake del paziente con database normativi, evidenziando aree con ipometabolismo superiore a 2 o 3 deviazioni standard.
| Software | Metodologia di analisi | Punti di forza |
|---|---|---|
| MIMneuro | Registrazione deformabile (BrainAlign), analisi basata su cluster e voxel. | Elevata precisione nella registrazione; supporto multi-tracciante. |
| CortexID Suite | Proiezioni superficiali stereotassiche (SSP), database proprietario GE. | Facilità d’uso clinico; ampiamente validato per l’AD. |
| Neurophet SCALE PET | Segmentazione anatomica automatizzata basata su atlante. | Eccellente per il calcolo di SUVR e Z-score in regioni specifiche. |
Caricamento….
Valore prognostico e ruolo nel framework diagnostico moderno
La PET FDG non è solo uno strumento diagnostico, ma possiede un potente valore prognostico, specialmente nella fase di Mild Cognitive Impairment (MCI).
Predizione della conversione da MCI ad Alzheimer
I pazienti con MCI “convertitori” (ovvero che evolveranno verso la demenza di Alzheimer entro 1-3 anni) mostrano un pattern di ipometabolismo nel cingolo posteriore e nel precuneo già nella fase prodromica.26 La presenza di ipometabolismo in queste aree aumenta di oltre 11 volte il rischio di conversione rispetto a pazienti con metabolismo preservato.
In termini di analisi predittiva, la PET FDG ha dimostrato di avere un valore predittivo negativo (NPV) superiore al 94% nel primo anno, indicando che un esame normale è un segnale molto forte di stabilità clinica a breve termine.
Integrazione cIntegrazione con biomarcatori di amiloide (framework ATN)
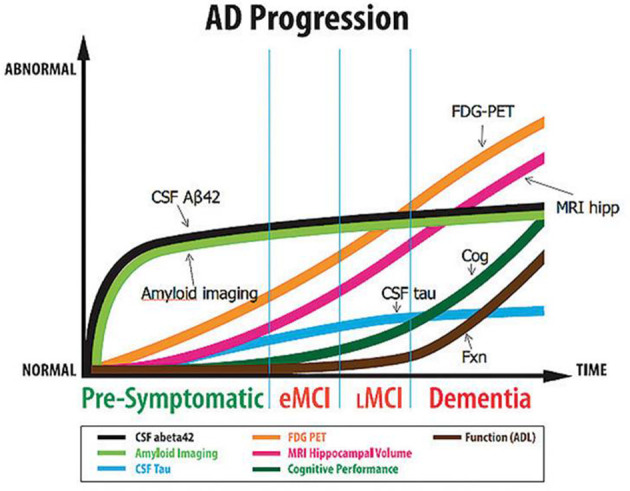
Il framework diagnostico NIA-AA definisce l’Alzheimer sulla base di tre classi di biomarcatori: Amiloide (A), Tau (T) e Neurodegenerazione (N). La PET FDG rappresenta il biomarcatore standard per la categoria “N“.
Sebbene la PET dell’amiloide sia più specifica per identificare la patologia proteica, la PET FDG è più strettamente correlata alla gravità clinica e al deficit cognitivo attuale. La combinazione dei due test (A+/N+) identifica i pazienti a più alto rischio di progressione rapida (tempo medio di conversione di 27 mesi contro i 37 mesi dei pazienti A+/N-).
Considerazioni conclusive
La PET con 18F-FDG rappresenta una pietra miliare nella gestione clinica della malattia di Alzheimer e delle demenze correlate. Attraverso la mappatura del metabolismo glucidico, essa fornisce una finestra diretta sulla vitalità sinaptica, permettendo di identificare la patologia anni prima che l’atrofia diventi evidente alla RM o che i sintomi diventino invalidanti.
L’identificazione dei pattern tipici (cingolo posteriore, precuneo, temporo-parietale) e il riconoscimento delle varianti atipiche (PCA, lvPPA) consentono un inquadramento nosografico preciso, fondamentale per la prognosi e per la futura selezione dei pazienti per terapie disease-modifying. Tuttavia, il successo della tecnica risiede nell’integrità del processo: dalla rigorosa preparazione metabolica del paziente alla correzione sofisticata degli effetti di volume parziale, fino alla sintesi critica con i dati clinici e neuropsicologici.
Mentre la ricerca si sposta verso biomarcatori sempre più specifici (come la PET della proteina Tau o i biomarcatori plasmatici), la PET FDG rimane lo standard di riferimento per valutare l’impatto funzionale della malattia sul cervello umano, mantenendo un ruolo insostituibile nella pratica clinica quotidiana per la sua ampia disponibilità e la solida base di evidenze accumulate in decenni di studio.
Caricamento…
Fonti:
- Clinical 18F-FDG and amyloid brain positron emission tomography/CT in the investigation of cognitive impairment: where are we now? – NIH ↩︎
- Distinct tau PET imaging patterns in typical and atypical Alzheimer’s disease | Brain | Oxford Academic ↩︎
- EANM procedure guidelines for brain PET imaging using [18F]FDG, version 3 – PMC ↩︎
- Differential Diagnosis of Neurodegenerative Dementias Using Metabolic Phenotypes on F-18 FDG PET/CT – PMC ↩︎
- Markers for the detection of Lewy body disease versus Alzheimer’s disease in mild cognitive impairment: a systematic review and meta-analysis – PMC ↩︎
- Atypical clinical variants of Alzheimer’s disease: are they really … ↩︎
- Multidimensional cognitive deficits in the typical and atypical variants of Alzheimer’s disease ↩︎
- Behavioral and neuropsychiatric differences across two atypical Alzheimer’s disease variants: Logopenic Progressive Aphasia and Posterior Cortical Atrophy – PMC ↩︎
- Atypical Presentations of Alzheimer Disease – PMC ↩︎
- Clinical impact of 18F-FDG-PET among memory clinic patients with uncertain diagnosis ↩︎
- Combination of amyloid and FDG PET for the prediction of short … ↩︎
- SNMMI Procedure Standard/EANM Practice Guideline for Brain [ 18 F]FDG PET Imaging, Version 2.0 – Journal of Nuclear Medicine ↩︎
- Brain PET in Suspected Dementia: Patterns of Altered FDG … ↩︎
- Brain FDG PET and the Diagnosis of Dementia – AJR Online ↩︎
- Posterior Cortical Atrophy: Does Complaint Match the Impairment? A Neuropsychological and FDG-PET Study – Frontiers ↩︎
- Posterior Cortical Atrophy: Primary Occipital Variant – PMC – NIH ↩︎
- The Usefulness of 18F-FDG PET to Differentiate Subtypes of Dementia: The Systematic Review and Meta-Analysis – NIH ↩︎
- Evaluating 2-[18F]FDG-PET in differential diagnosis of dementia using a data-driven decision model – PMC ↩︎
- Differentiating Mild Cognitive Impairment, Alzheimer’s Disease, and Dementia With Lewy Bodies Using Cingulate Island Sign on Perfusion IMP-SPECT – Frontiers ↩︎
- Partial volume correction of brain PET studies using iterative deconvolution in combination with HYPR denoising – PMC – PubMed Central ↩︎
- Evaluation of partial volume effect correction methods for brain positron emission tomography: Quantification and reproducibility – PubMed Central ↩︎
- [18F]FDG PET metabolic patterns of the rapid-acting antidepressant effects of NLX-101, a 5-HT1A receptor biased agonist – PMC ↩︎
- The congruency of neuropsychological and F18-FDG brain PET/CT … ↩︎
- The Association Between Brain Metabolic Biomarkers Using 18F-FDG and Cognition and Vascular Risk Factors, as well as Its Usefulness in the Diagnosis and Staging of Alzheimer’s Disease – PMC ↩︎
- Association between cerebral metabolism and Rey-Osterrieth Complex Figure Test performance in Alzheimer’s disease – NIH ↩︎
- Predicting conversion from mild cognitive impairment to Alzheimer’s … ↩︎
Now loading…