ESERCITAZIONE: Distillazione
OGGETTO: Verifica sperimentale sulla differenza tra distillazione semplice e distillazione frazionata di una miscela omogenea di acqua e alcol.

Caricamento…
TABELLA:
|
DISTILLAZIONE SEMPLICE |
DISTILLAZIONE FRAZIONATA |
||
|
Volume (ml) |
Temp. (°C) |
Volume (ml) |
Temp. (°C) |
|
5 |
76 |
5 |
76 |
|
10 |
76 |
10 |
76 |
|
15 |
77 |
15 |
76 |
|
20 |
77 |
20 |
77 |
|
25 |
78 |
25 |
77 |
|
30 |
78 |
30 |
77 |
|
35 |
79 |
35 |
77 |
|
40 |
80 |
40 |
77 |
|
45 |
84 |
45 |
78 |
|
50 |
91 |
50 |
81 |
|
55 |
94 |
55 |
96 |
|
60 |
94 |
60 |
96 |
|
65 |
94 |
65 |
96 |
|
70 |
94 |
70 |
96 |
GRAFICO:
STRUMENTI, APPARECCHI e SOSTANZE:
- Matracci con raccordi;
- Contenitore della miscela;
- Cilindri graduati
- Pietra pomice;
- Colonna di Vigreux;
- Raccordo di Claisen;
- Riscaldatore elettrico;
- Termometro a mercurio;
- Sostegni;
- Tubi di collegamento per refrigerante;
- Tubi di vetro Refrigeranti;
- Alcol Etilico Denaturato;
- Acqua Distillata.
RELAZIONE:
CONOSCENZE TEORICHE:
La tensione di vapore è una caratteristica individuale di liquido. Essa è in funzione della temperatura, infatti al crescere della temperatura la tensione di vapore aumenta. Quando la tensione di vapore eguaglia la pressione atmosferica, il liquido bolle. Si può quindi sottintendere che al cambiare della pressione atmosferica varia anche la temperatura di ebollizione.
La distillazione è un processo costoso che richiede parecchia energia utilizzato per separare due o più componenti allo stato liquido in miscela omogenea che hanno una temperatura di ebollizione diversa. La distillazione si usa quando uno dei due componenti (di solito quello più volatile) è un componente che ha un certo ritorno economico o ambientale (magari è una sostanza inquinante che bisogna per forza recuperare). Durante qualsiasi distillazione il vapore è più ricco del componente più volatile. Molte distillazioni ripetute portano ad avere un liquido puro. La distillazione è quindi un metodo di purificazione. Abbiamo diversi tipi di distillazione. I più importanti sono quella semplice, quella frazionata e quella sotto vuoto.
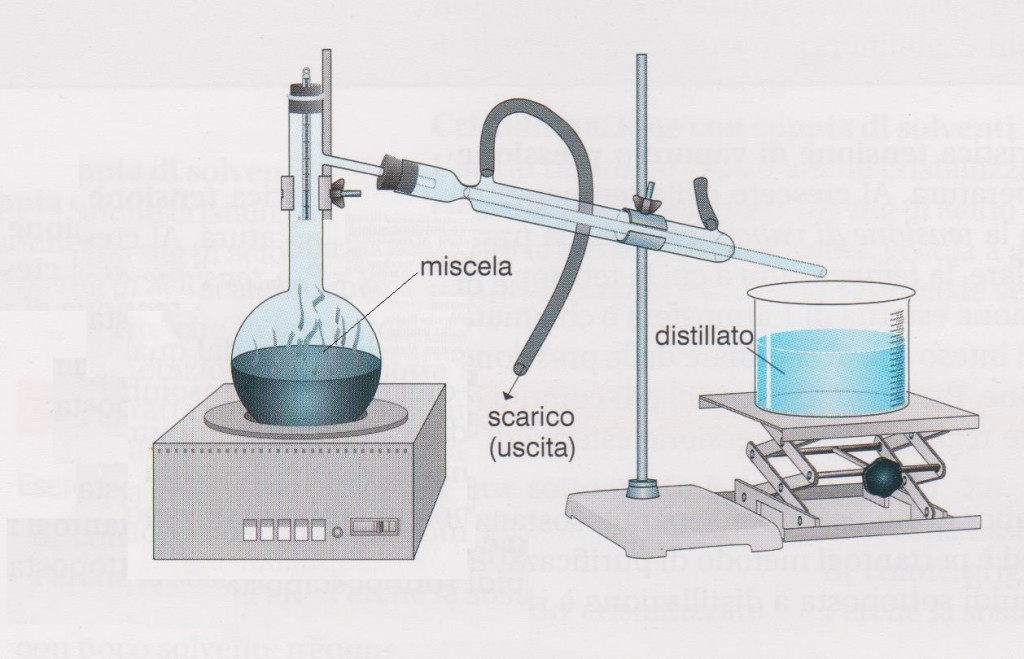
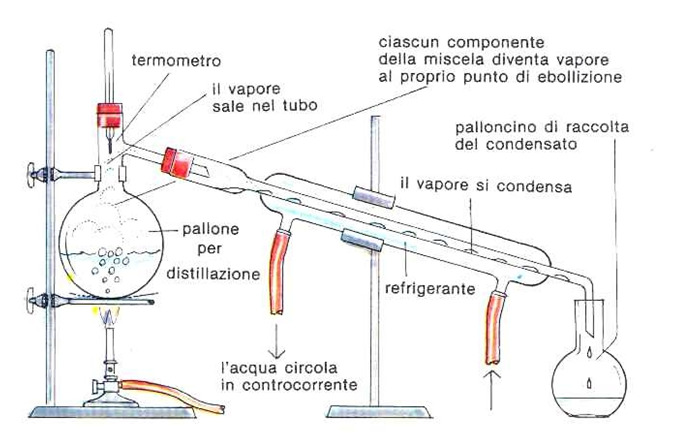
Nella distillazione semplice si riscalda la miscela tramite un bunsen o un riscaldatore, i vapori liberati passeranno tramite un tubo che li porta in un refrigerante che condensa il distillato il quale cade e viene raccolto in un altro contenitore. Il refrigerante è un tubo esterno al tubo dove passa il vapore, con due aperture: un ingresso posto in basso, un’uscita posta in alto in modo da raffreddare tramite l’acqua contro corrente. Il raffreddamento contro corrente evita gli shock termici dei vapori (alcune sostanze non possono ricevere sbalzi enormi di temperatura). La distillazione semplice è consigliata per sostanze con differenza di temperature di ebollizione superiore ai 30 °C.
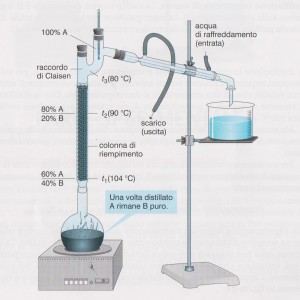
Nella distillazione frazionata i vapori prima di passare per il tubo refrigerante attraversano una colonna di Vigreux, un tubo di vetro che sulla superficie interna presenta delle digitazioni, sulle quali il vapore condensa ricadendo nel pallone di distillazione; man mano che la distillazione prosegue la condensazione del vapore avviene su digitazioni posizionate più in alto, fino al tubo di Claisen che porta i vapori più volatili nel refrigerante. La distillazione frazionata è consigliata per separare sostanze con temperatura di ebollizione vicine.
Quando le temperature di ebollizione sono molto alte superiori ai 150 °C, conviene fare una distillazione ridotta o sottovuoto. La distillazione sottovuoto conviene applicarla anche quando le sostanze utilizzate sono soggette a degradazioni e decomposizioni. Per il sottovuoto solitamente si utilizza una pompa ad acqua che dà una pressione dell’ordine di 15-20 mm di Hg, cioè un vuoto soddisfacente.
Non tutte le miscele possono essere separate per distillazione frazionata, come ad esempio gli Azeotropi. Essi sono miscele che si comportano come un composto puro: bollono a temperatura costante, producono vapori che hanno la stesso composizione del liquido. Il punto di ebollizione di un azeotropo può essere più alto o più basso dei punti di ebollizione dei suoi componenti.
DESCRIZIONE DELLA PROVA:
Lo scopo della prova è di determinare la differenza tra la distillazione semplice e quella frazionata separando i composti della miscela binaria acqua-alcol allo stato liquido.
Acqua e alcol hanno temperatura di ebollizione diversa quindi è possibile applicare la distillazione sia semplice che frazionata. Nella distillazione semplice si collega un matraccio contenente la miscela ad un tubo nel quale viene inserito un termometro per controllare la temperatura dei vapori e si collega ad un altro tubo refrigerante che porta poi ad un cilindro graduato.
Nella distillazione frazionata invece si inserisce anche una colonna di Vigreux che rende difficile il passaggio dei vapori più pesanti.
Per una prova ottimale bisognerebbe avere anche un termometro che misura la temperatura di ebollizione della miscela (temperatura che dovrebbe essere uguale a quella dei vapori, anche se però è superiore).
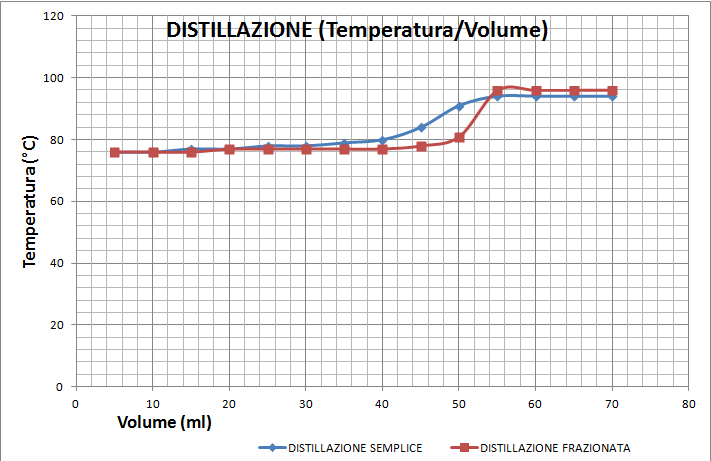
La nostra miscela è composta da 50 ml di Alcol Etilico denaturato e 50 ml di acqua distillata. La miscela viene posta nel matraccio insieme a della pietra pomice per regolare l’ebollizione. Inoltre il contenitore con la miscela non deve essere pieno più di 2/3. L’alcol ha una temperatura di ebollizione a 78,4 °C. L’acqua bolle a 100 °C. Ogni 5 ml di distillato ricavato bisogna riportare il valore della temperatura dei vapori fino a 70 ml di distillato. Con questi dati si può costruire un grafico per poter osservare la differenza tra la distillazione frazionata e quella semplice.
Dalla tabella e dal grafico si può notare come la temperatura resta costante fino ai 50 ml, cambia di molto quando li si superano, questo è dovuto dal fatto che la miscela è composta solo da 50 ml di alcol, una volta distillati quei 50 ml, le gocce che evaporano sono solo di acqua e la temperatura è relativa alla sua temperatura di ebollizione. Inoltre la distillazione frazionata a differenza di quella semplice ha una variazione più netta, questo fa capire come essa sia più precisa.
La distillazione oltre ad aver separato l’alcol dall’acqua ha separato anche il colorante presente nell’alcol. Infatti il distillato risulta incolore, mentre la miscela di acqua si scurisce sempre di più.
La temperatura di ebollizione massima è stata 94 °C perché parte della miscela è diventata azeotropo e quindi non poteva essere separato ed ha un punto di ebollizione più basso rispetto a quello dei suoi componenti.
La temperatura di ebollizione della miscela invece di essere 78,4 è scesa a 76 per diversi fattori, innanzi tutto per la pressione atmosferica, infatti il tempo atmosferico non era in ottime condizioni, inoltre il laboratorio non si trova al livello del mare ma in zona collinare, infine bisogna anche considerare il fatto che il termometro ha misurato la temperatura del vapore, il quale è leggermente inferiore a quella del miscuglio in ebollizione.
Per concludere possiamo dire che la distillazione frazionata è il metodo migliore per separare un miscuglio omogeneo, anche se i tempi impiegati sono molto più lunghi.