I macronutrienti (glucidi, lipidi e proteine) rappresentano i composti fondamentali utilizzati dal nostro organismo per ottenere l’energia indispensabile per il metabolismo, la crescita e il mantenimento delle funzioni vitali. Tra questi, i glucidi (o carboidrati) rivestono un ruolo preminente, costituendo la principale e più prontamente utilizzabile fonte energetica per la maggior parte delle cellule, in particolare per tessuti critici come il sistema nervoso centrale.
Per apprezzare le complesse funzioni metaboliche dei glucidi, è essenziale comprendere preliminarmente la loro classificazione strutturale, che ne determina le proprietà e il destino biologico.
Classificazione strutturale e funzionale
La classificazione dei glucidi è una necessità strategica per comprendere la loro funzione biologica. La loro struttura, che spazia da semplici unità monomeriche a complessi polimeri ramificati, determina direttamente il loro ruolo nell’organismo: dal trasporto di energia a rapido utilizzo, alla funzione di riserva a lungo termine, fino al supporto strutturale per cellule e tessuti.
Monosaccaridi
I monosaccaridi rappresentano i carboidrati più semplici e costituiscono la principale risorsa per il metabolismo energetico cellulare. La loro classificazione si basa su un duplice sistema che considera sia il gruppo funzionale carbonilico che il numero di atomi di carbonio presenti nella molecola.
| Criterio di classificazione | Descrizione ed esempi |
|---|---|
| Gruppo funzionale | Aldosi: contengono un gruppo aldeidico; Chetosi: contengono un gruppo chetonico. |
| Numero di atomi di carbonio | Classificati in base al numero di atomi di carbonio (da 3 a 7), i più comuni sono Triosi (3 C), Pentosi (5 C) ed Esosi (6 C). Esempi combinati includono il glucosio (un aldoesoso), il fruttosio (un chetoesoso) e il ribosio (un aldopentoso). |
Now loading…
Disaccaridi
I disaccaridi sono formati dall’unione di due unità monosaccaridiche attraverso un legame covalente detto legame O-glicosidico. Questa unione avviene tra il gruppo ossidrilico di uno zucchero e l’atomo di carbonio anomerico dell’altro. Tra i disaccaridi più comuni troviamo:
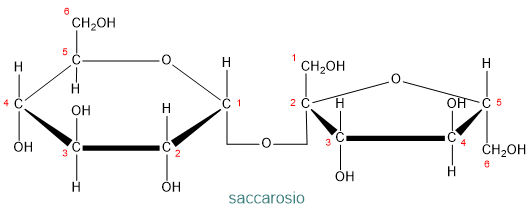
- saccarosio: il comune zucchero da cucina, composto da una molecola di glucosio e una di fruttosio, unite da un legame 1-2 α-glicosidico;
- maltosio: composto da due molecole di α-D-glucosio, unite da un legame α(1→4′);
- lattosio: lo zucchero presente nel latte, formato da glucosio e galattosio, uniti da un legame β(1→4′).
Polisaccaridi
I polisaccaridi, noti anche come glicani, sono polimeri complessi costituiti da più di dieci unità monosaccaridiche. Si distinguono in omopolisaccaridi, se formati da un solo tipo di monomero, ed eteropolisaccaridi, se composti da due o più tipi di monomeri. La loro struttura, in particolare il tipo di legame glicosidico e il grado di ramificazione, ne definisce la funzione, che può essere di riserva energetica o strutturale.
L’amido è il principale polisaccaride di riserva delle piante. È composto da due polimeri di glucosio: l’amilosio, una catena lineare con legami α(1→4′), e l’amilopectina, una struttura ramificata che presenta legami α(1→6′) ogni 24-30 unità di glucosio.
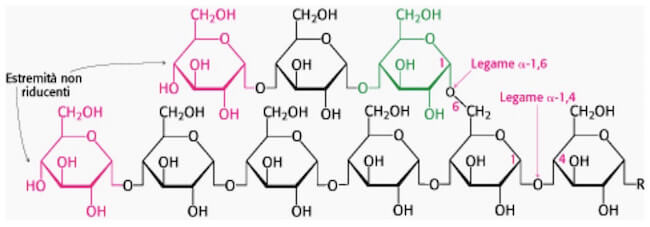
Il glicogeno rappresenta il polisaccaride di riserva negli animali, tanto da essere talvolta definito “amido animale”. La sua struttura è simile all’amilopectina ma molto più densamente ramificata, con un legame α(1→6′) ogni 8-12 residui di glucosio. Questa elevata ramificazione crea numerose estremità non riducenti, permettendo agli enzimi di degradare la molecola simultaneamente in più punti. Ciò garantisce un rilascio di glucosio molto più rapido rispetto all’amido, una caratteristica funzionale che si adatta perfettamente alle esigenze energetiche della vita attiva degli animali. Questa architettura molecolare è un adattamento evolutivo cruciale, che consente una rapida mobilitazione del glucosio per rispondere a esigenze energetiche immediate, come nella reazione “combatti o fuggi” mediata dall’adrenalina. Nell’uomo, il glicogeno è immagazzinato principalmente nel fegato e nel muscolo scheletrico.
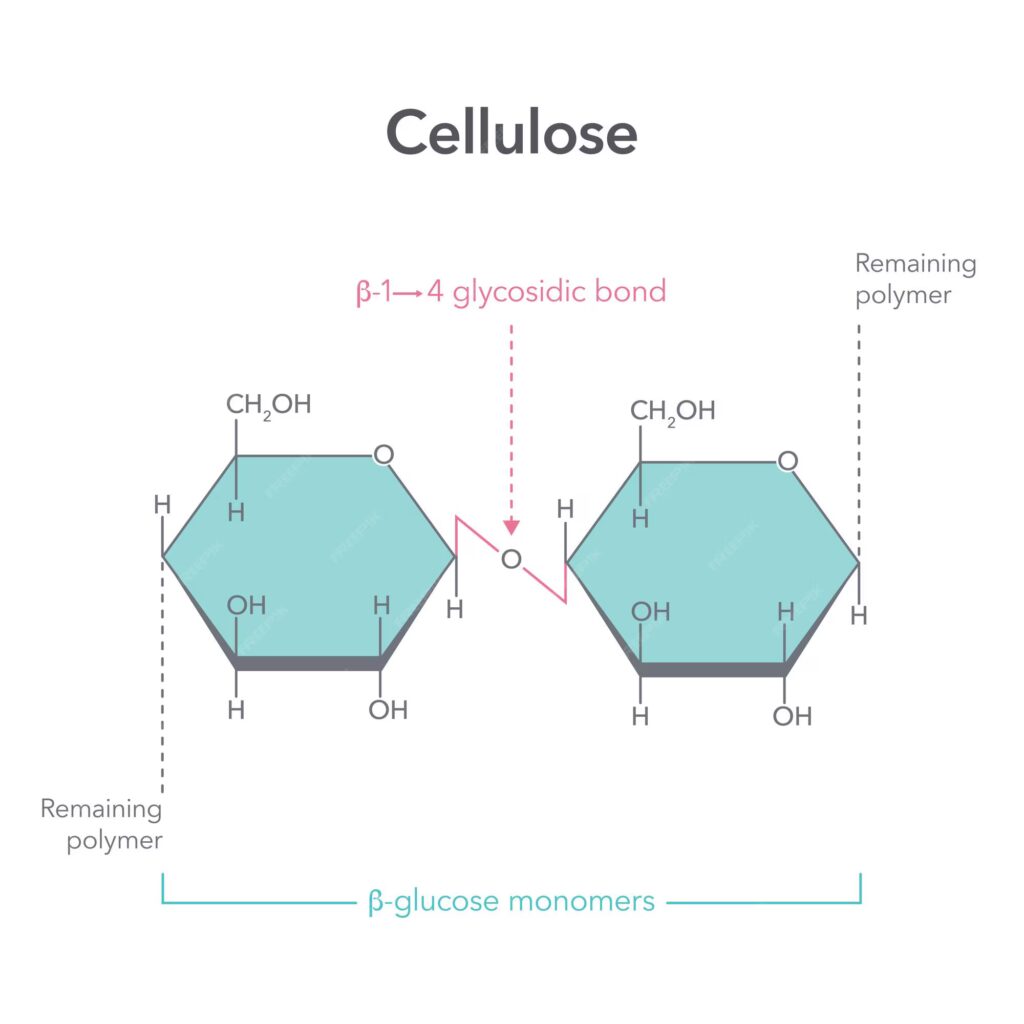
La cellulosa è il polisaccaride strutturale per eccellenza nel regno vegetale, componente fondamentale delle pareti cellulari. Pur essendo un polimero del D-glucosio come l’amido e il glicogeno, presenta una differenza critica: le unità di glucosio sono unite da legami β(1→4′). Questa configurazione conferisce alla cellulosa una struttura lineare e fibrosa. La maggior parte degli animali, incluso l’uomo, non possiede gli enzimi necessari per idrolizzare i legami β(1→4′), rendendo la cellulosa non digeribile.
La comprensione della struttura ramificata del glicogeno è fondamentale per analizzare le vie metaboliche che ne regolano la sintesi e la degradazione in risposta alle necessità energetiche dell’organismo.
Vie metaboliche centrali del glucosio
Una volta assorbiti e resi disponibili, i glucidi, e in particolare il glucosio, entrano in un complesso network di vie metaboliche che l’organismo utilizza per gestire dinamicamente le proprie risorse. I processi di glicogenolisi, gluconeogenesi, glicogenosintesi e la via del pentoso fosfato non sono vie isolate, ma un sistema finemente integrato per il mantenimento dell’omeostasi energetica, ovvero l’equilibrio tra produzione, utilizzo e immagazzinamento di energia.
Glicogenolisi
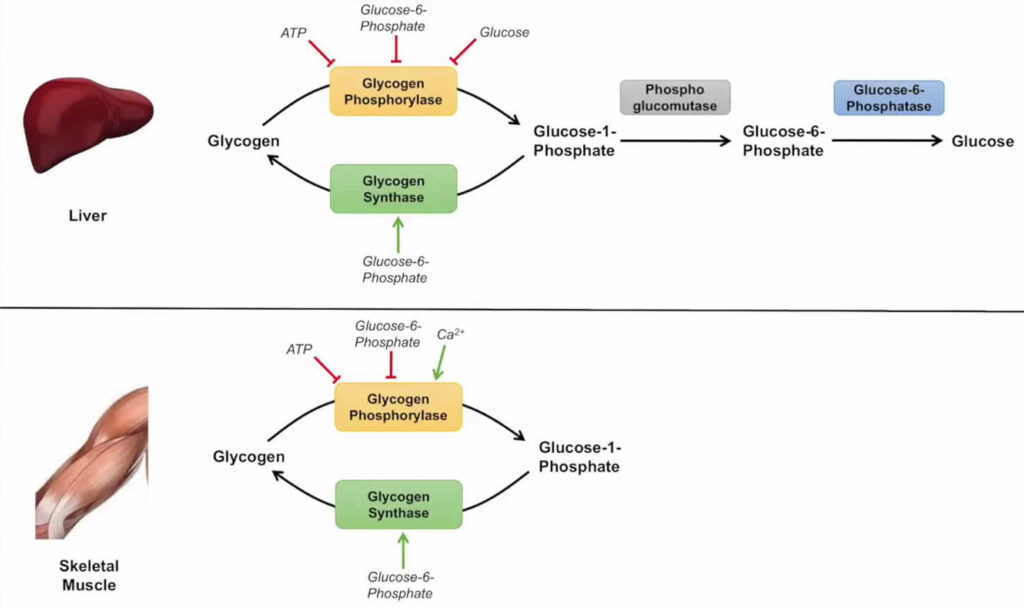
La glicogenolisi è il processo catabolico di degradazione del glicogeno, attivato per mantenere costante la concentrazione di glucosio nel sangue (glicemia), soprattutto tra un pasto e l’altro. Il processo è orchestrato da enzimi chiave: la glicogeno fosforilasi rompe sequenzialmente i legami α(1→4′) all’estremità non riducente della catena, rilasciando glucosio-1-fosfato. Successivamente, l’enzima fosfoglucomutasi converte il glucosio-1-fosfato in glucosio-6-fosfato, la molecola pronta a entrare nelle vie metaboliche successive. I punti di ramificazione sono gestiti dall’enzima deramificante.
La struttura altamente ramificata del glicogeno si rivela qui un vantaggio strategico: permette a molteplici enzimi di glicogeno fosforilasi di agire contemporaneamente su diverse ramificazioni, garantendo un rilascio di glucosio molto più rapido di quanto sarebbe possibile con una struttura lineare.
È cruciale distinguere la funzione del glicogeno nei due principali siti di deposito:
- glicogeno epatico: la sua funzione è mantenere l’omeostasi glicemica dell’intero organismo. Il fegato è l’unico organo in grado di rilasciare glucosio nel circolo ematico, grazie alla presenza dell’enzima glucosio-6-fosfatasi, che converte il glucosio-6-fosfato in glucosio libero;
- glicogeno muscolare: costituisce una riserva energetica ad uso esclusivo del muscolo stesso, per sostenere la contrazione durante l’attività fisica. Il muscolo è privo di glucosio-6-fosfatasi e non può quindi contribuire al mantenimento della glicemia sistemica.
Gluconeogenesi
Quando le riserve di glicogeno epatico si esauriscono (dopo circa 16 ore di digiuno), l’organismo attiva la gluconeogenesi, la via metabolica per la sintesi di nuovo glucosio. Questo processo è un meccanismo metabolico indispensabile per la sopravvivenza dei tessuti glucosio-dipendenti obbligati, come il sistema nervoso centrale (che da solo consuma circa 120 g di glucosio al giorno) e gli eritrociti.
La gluconeogenesi, che avviene principalmente nel fegato, utilizza precursori non glucidici come il lattato (dal muscolo in anaerobiosi, attraverso il ciclo di Cori), l’alanina (dal catabolismo proteico muscolare, ciclo glucosio-alanina) e il glicerolo (dall’idrolisi dei trigliceridi). Sebbene condivida sette reazioni con la glicolisi, non è semplicemente il suo processo inverso. Le tre tappe irreversibili della glicolisi vengono bypassate da enzimi specifici della gluconeogenesi. Sebbene sia un processo energeticamente dispendioso, la sua funzione nel mantenimento della glicemia durante il digiuno prolungato lo rende assolutamente essenziale.
Caricamento….
Glicogenosintesi
In condizioni di abbondanza di glucosio (ad esempio, dopo un pasto), l’eccesso viene convertito e immagazzinato sotto forma di glicogeno attraverso il processo anabolico della glicogenosintesi. Le tappe chiave sono:
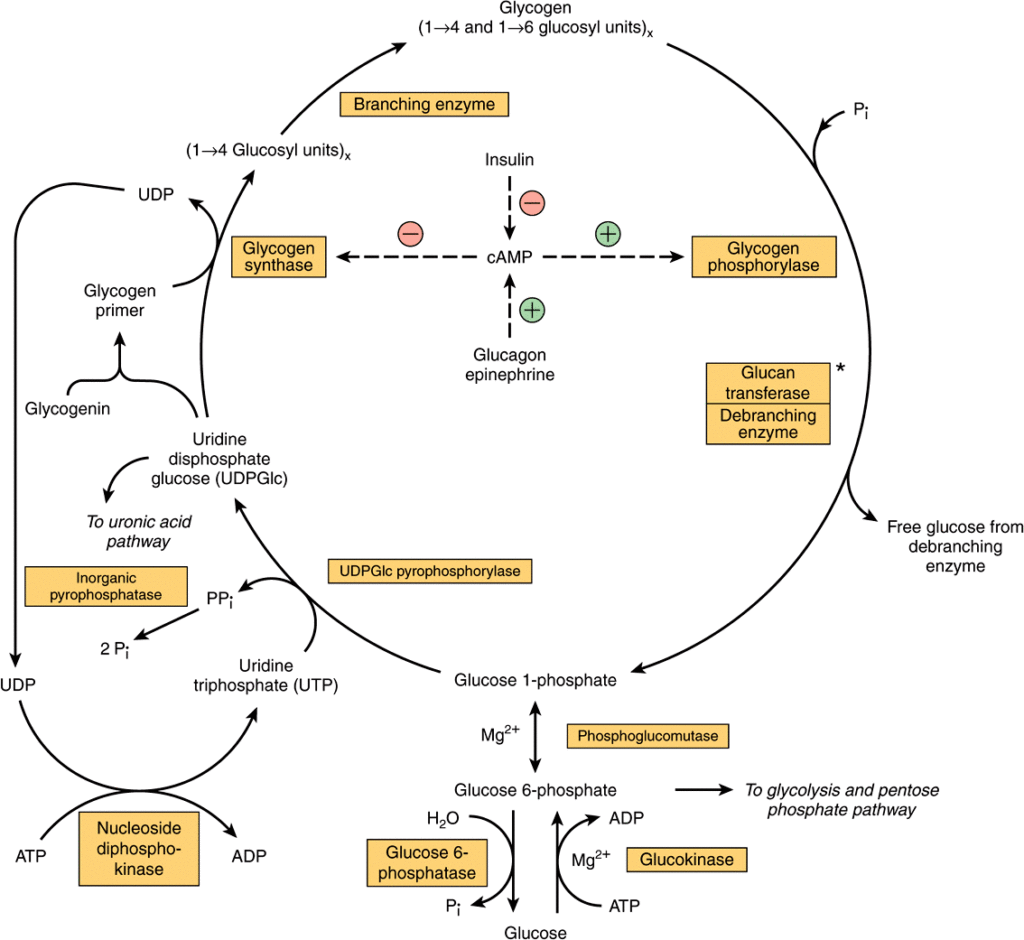
- fosforilazione: il glucosio viene fosforilato a glucosio-6-fosfato da enzimi specifici: la glucochinasi nel fegato e l’esochinasi nel muscolo;
- isomerizzazione: il glucosio-6-fosfato viene convertito in glucosio-1-fosfato;
- attivazione: il glucosio-1-fosfato viene “attivato” legandosi a UTP per formare uridina difosfoglucosio (UDPG). La reazione, catalizzata dalla UDP-glucosio pirofosfatasi, è resa termodinamicamente irreversibile in vivo dalla successiva e immediata idrolisi del pirofosfato (PPi) in due molecole di fosfato inorganico (Pi) ad opera della pirofosfatasi inorganica;
- allungamento: la glicogeno sintasi trasferisce il glucosio dall’UDPG all’estremità non riducente di una catena di glicogeno, partendo da un innesco proteico, la glicogenina;
- ramificazione: l’enzima ramificante crea i legami α(1→6′), trasferendo segmenti della catena lineare per formare la caratteristica struttura ramificata del glicogeno.
La via del pentoso fosfato
La via del pentoso fosfato è una via metabolica citoplasmatica che rappresenta un destino alternativo per il glucosio-6-fosfato. Essa non ha come scopo primario la produzione di ATP, ma serve a due funzioni biologiche cruciali:
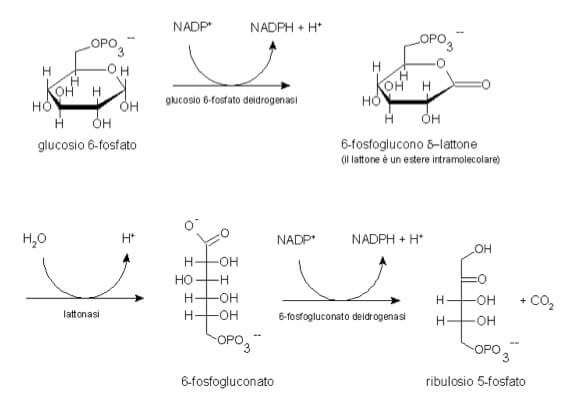
- produzione di NADPH: questo coenzima ridotto è fondamentale per le biosintesi riduttive (come la sintesi di acidi grassi e colesterolo) e, soprattutto, per la rigenerazione del glutatione ridotto (GSH). Il GSH è un potente antiossidante che protegge le cellule dallo stress ossidativo causato dalle specie reattive dell’ossigeno (ROS);
- produzione di ribosio-5-fosfato: è il precursore essenziale per la sintesi dei nucleotidi, i mattoni costitutivi di DNA e RNA.
L’enzima che controlla la velocità di questa via (enzima limitante) è la glucosio-6-fosfato deidrogenasi. L’attivazione e la disattivazione coordinata di queste vie metaboliche non è un evento casuale, ma è finemente orchestrata da un complesso sistema di segnali ormonali.
Caricamento…
La regolazione ormonale dell’omeostasi glucidica
Le vie metaboliche del glucosio non sono regolate in modo autonomo, ma sono subordinate a un sofisticato sistema di controllo gerarchico orchestrato da segnali ormonali. Questi mediatori chimici integrano lo stato nutrizionale e le richieste fisiologiche dell’intero organismo, modulando l’attività enzimatica per mantenere una stretta omeostasi glicemica.
Insulina
L’insulina è l’ormone anabolico chiave secreto dalle cellule β del pancreas in risposta a un aumento della glicemia, tipicamente dopo un pasto ricco di carboidrati. La sua azione principale è ipoglicemizzante, ovvero promuove la riduzione della concentrazione di glucosio nel sangue. Nel contesto del metabolismo del glicogeno, l’insulina stimola la glicogenosintesi sia nel fegato che nel muscolo. Il suo meccanismo d’azione prevede la promozione della defosforilazione della glicogeno sintasi, convertendola dalla sua forma inattiva (fosforilata) a quella attiva.
Glucagone
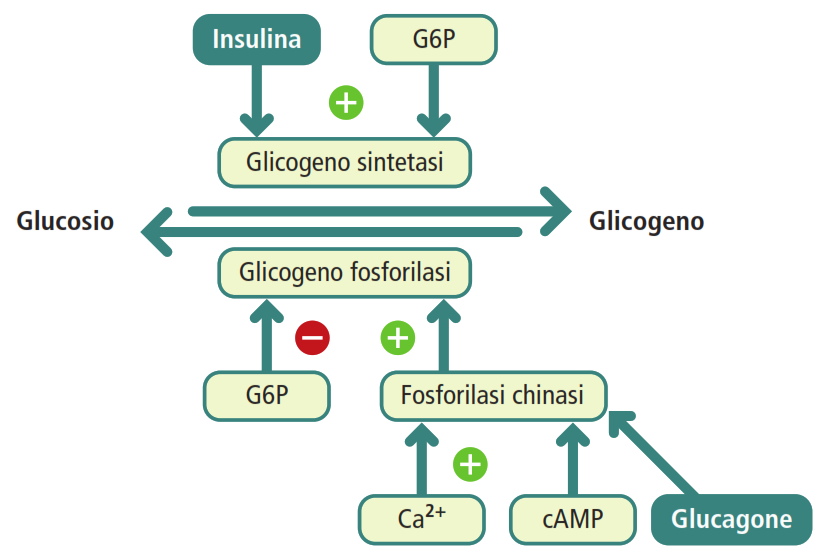
Il glucagone, secreto dalle cellule α del pancreas, è l’ormone antagonista dell’insulina. Viene rilasciato in risposta a una bassa concentrazione di glucosio nel sangue (ipoglicemia). Il suo principale effetto è iperglicemizzante: agisce quasi esclusivamente a livello epatico, dove stimola potentemente la glicogenolisi, promuovendo la degradazione del glicogeno e il conseguente rilascio di glucosio nel circolo sanguigno per ristabilire i livelli normali.
Adrenalina e cortisolo
In situazioni di stress, altri ormoni intervengono per garantire un adeguato apporto energetico all’organismo, distinguendosi per scala temporale e obiettivo metabolico.
- adrenalina: rilasciata in risposta a uno stress acuto (la reazione di “combatti o fuggi”), stimola potentemente la glicogenolisi a livello muscolare, fornendo un substrato immediato per la glicolisi e la conseguente produzione di ATP necessaria a sostenere un’intensa contrazione muscolare;
- cortisolo: è un ormone steroideo la cui azione è più lenta e sostenuta, tipica dello stress prolungato. Il suo ruolo principale è quello di stimolare l’espressione genica degli enzimi della gluconeogenesi epatica, aumentando la sintesi di nuovo glucosio per garantire la disponibilità energetica a livello sistemico.
L’omeostasi glicemica è il risultato di un equilibrio dinamico e finemente regolato tra l’azione dell’insulina e quella del glucagone, modulato dagli ormoni dello stress. L’interazione ormonale è finemente orchestrata a livello molecolare: la stessa via di segnalazione attivata dal glucagone (es. fosforilazione) che attiva la glicogenolisi, contemporaneamente inibisce la glicogenosintesi. Questa regolazione reciproca previene cicli futili, in cui sintesi e degradazione avvengono simultaneamente, e garantisce una risposta metabolica efficiente e univoca alle fluttuazioni dello stato energetico dell’organismo.