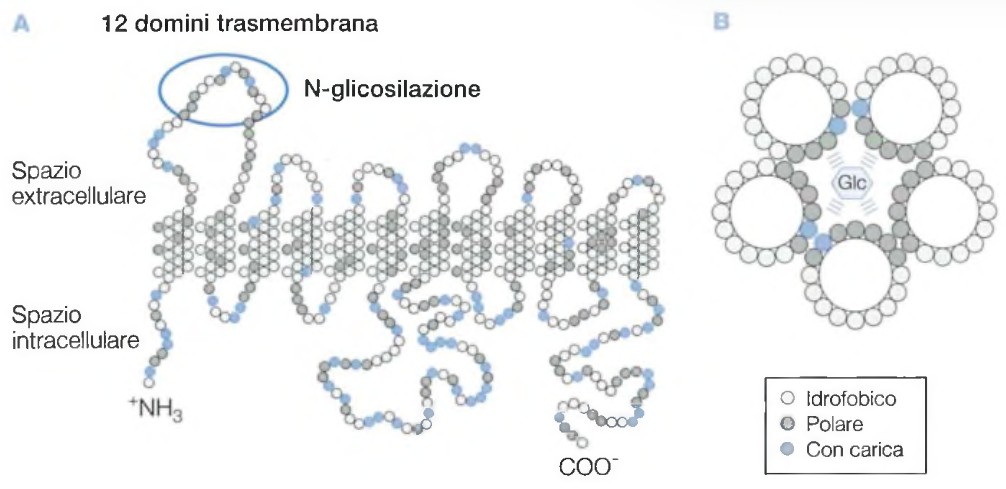
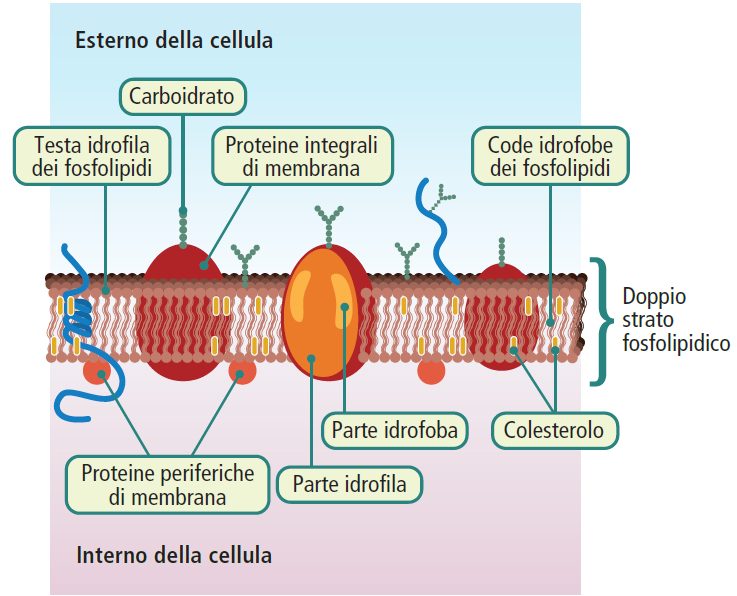
Per mantenere la propria struttura, crescere e moltiplicarsi, ogni organismo vivente necessita di un costante scambio di materia ed energia con l’ambiente circostante. Questo scambio è governato da una complessa rete di reazioni biochimiche coordinate. L’insieme delle reazioni chimiche che avvengono all’interno dell’organismo è definito metabolismo (dal greco “metabole“, cambiamento). Il metabolismo cellulare rappresenta quindi il fondamento della vita stessa, un sistema finemente regolato in cui migliaia di reazioni, ciascuna catalizzata da un enzima specifico, assicurano che la cellula disponga delle risorse necessarie per le sue funzioni vitali, evitando al contempo deficit o surplus di molecole chiave.
Il metabolismo si articola in due direzioni funzionali principali, strettamente interconnesse:
- vie cataboliche: comprendono l’insieme dei processi di degradazione che scompongono molecole complesse in composti più semplici. Queste reazioni sono definite esoergoniche, poiché liberano l’energia immagazzinata nei legami chimici delle molecole di partenza;
- vie anaboliche: rappresentano l’insieme dei processi di sintesi che utilizzano energia per costruire molecole complesse a partire da precursori semplici. Queste reazioni sono definite endoergoniche, in quanto richiedono un apporto energetico per poter avvenire.
Le vie cataboliche e anaboliche sono accoppiate attraverso un ciclo energetico il cui protagonista è l’adenosina trifosfato (ATP). L’energia liberata durante le reazioni “in discesa” del catabolismo viene catturata e immagazzinata nei legami ad alta energia dell’ATP. Successivamente, l’idrolisi di questa molecola rilascia l’energia necessaria per alimentare le reazioni “in salita” dell’anabolismo, oltre a sostenere altri processi cellulari vitali come il trasporto attivo di molecole attraverso le membrane e i movimenti cellulari.
Data la sua funzione cruciale di intermediario energetico, un’analisi dettagliata della struttura e della funzione dell’adenosina trifosfato (ATP), la “moneta di scambio energetico” della cellula, è propedeutica alla comprensione approfondita dei meccanismi metabolici.
Analisi delle molecole chiave del metabolismo
Il flusso di energia all’interno delle vie metaboliche è mediato da molecole specializzate e catalizzato da agenti biologici di straordinaria efficienza.
Struttura e funzione dell’Adenosina Trifosfato (ATP)
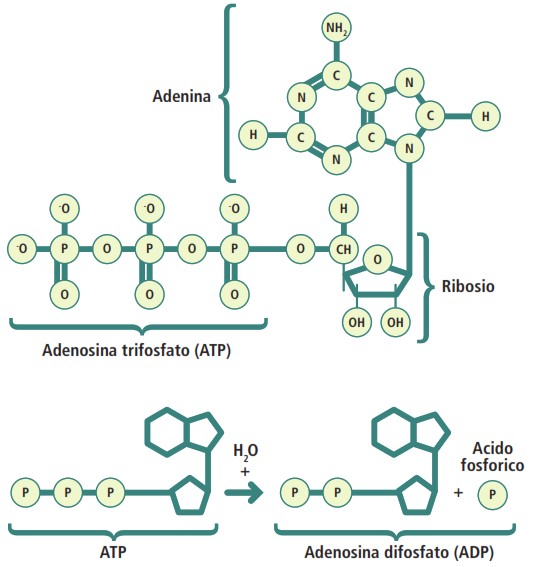
L’ATP è una molecola complessa la cui struttura è ottimizzata per il suo ruolo energetico. È composta da tre elementi fondamentali:
- una base azotata: l’adenina;
- uno zucchero a cinque atomi di carbonio: il ribosio;
- una catena di tre gruppi fosfato, designati come alfa (α), beta (β) e gamma (γ).
I legami chimici all’interno della molecola presentano caratteristiche energetiche distinte. Il legame tra l’adenosina (adenina + ribosio) e il primo gruppo fosfato (α) è un legame estere a bassa energia. Al contrario, i legami che uniscono i gruppi fosfato tra loro (β e γ) sono legami anidridici ad alta energia. Tale elevato potenziale energetico è dovuto alla repulsione elettrostatica tra i gruppi fosfato adiacenti, carichi negativamente, e alla maggiore stabilità per risonanza dei prodotti dell’idrolisi (ADP e Pi).
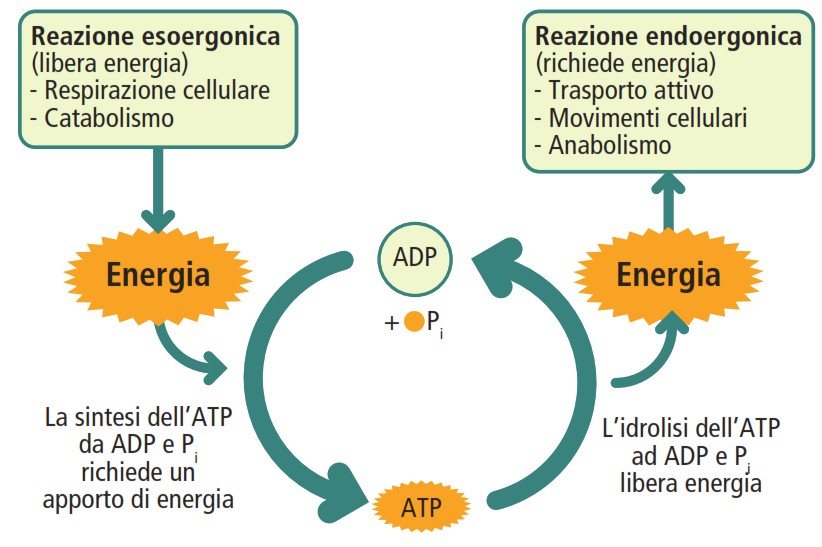
L’energia viene rilasciata attraverso una reazione di idrolisi, in cui una molecola d’acqua rompe il legame anidridico terminale. Questo processo converte l’ATP in adenosina difosfato (ADP) e un gruppo fosfato inorganico (Pi), liberando 7,3 kcal/mol:
ATP + H2O → ADP + Pi
Se necessario, un’ulteriore idrolisi può scindere l’ADP in adenosina monofosfato (AMP) e un altro gruppo fosfato. L’ATP svolge un duplice ruolo cruciale: funge da molecola primaria per l’accoppiamento energetico nelle reazioni metaboliche e costituisce uno dei nucleotidi trifosfato necessari per la sintesi dell’RNA.
Analisi funzionale degli enzimi
Gli enzimi sono catalizzatori biologici che accelerano le reazioni chimiche cellulari senza essere consumati nel processo. La loro funzione è quella di abbassare l’energia libera di attivazione, ovvero l’energia richiesta dai reagenti per raggiungere lo stato di transizione, una forma instabile in cui i legami possono essere rotti più facilmente.
Il meccanismo di catalisi enzimatica si svolge in più fasi:
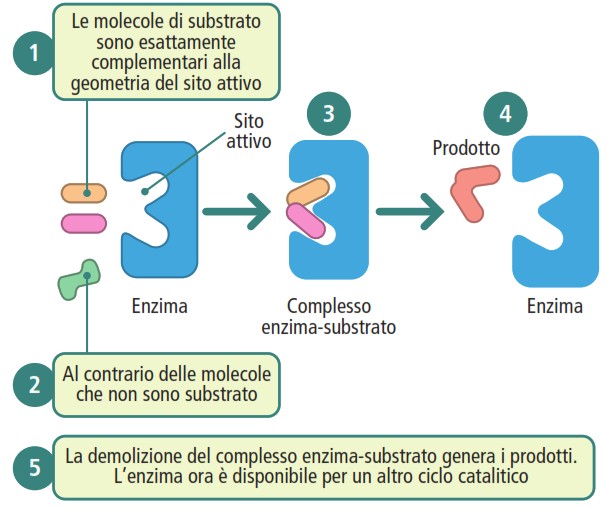
- la molecola da trasformare, il substrato, si lega a una regione specifica dell’enzima chiamata sito attivo;
- si forma un complesso transitorio enzima-substrato;
- all’interno del sito attivo, il substrato viene convertito in prodotto;
- il prodotto viene rilasciato e l’enzima torna alla sua conformazione originale, pronto per un nuovo ciclo catalitico.
Per funzionare, alcuni enzimi richiedono la presenza di molecole non proteiche di supporto:
- cofattori: ioni inorganici come Fe²⁺, Mg²⁺, Mn²⁺ o Zn²⁺;
- coenzimi: molecole organiche complesse, come il NADH e il FADH₂, che spesso agiscono come trasportatori di gruppi chimici o elettroni.
L’attività enzimatica è finemente regolata per rispondere alle esigenze metaboliche della cellula. Un meccanismo chiave è l’inibizione, che può essere reversibile o irreversibile (in questo caso si parla di inibitori suicidi). Gli inibitori reversibili si classificano in tre categorie principali:
- inibitori competitivi: competono direttamente con il substrato per il legame al sito attivo dell’enzima;
- inibitori non competitivi: si legano a un sito dell’enzima diverso dal sito attivo, alterandone la conformazione e l’efficienza catalitica;
- inibitori misti: hanno la capacità di legarsi sia al sito attivo che ad altri siti dell’enzima.
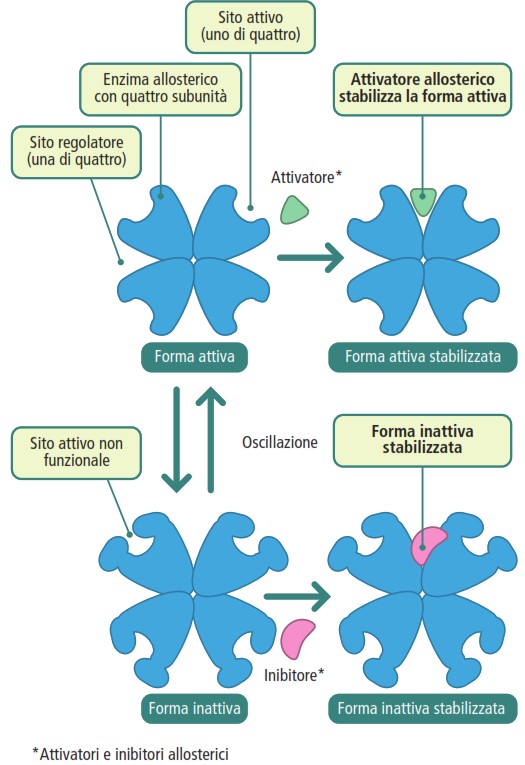
Un’altra modalità di regolazione fondamentale è la regolazione allosterica. Gli enzimi allosterici, spesso composti da più subunità, possono oscillare tra una conformazione attiva e una inattiva. Il legame di una molecola regolatrice (un attivatore o un inibitore) a un sito specifico, detto sito allosterico, influenza questo equilibrio. Un attivatore stabilizza la forma attiva dell’enzima, mentre un inibitore stabilizza la forma inattiva, modulando così l’attività catalitica complessiva.
Molte delle reazioni metaboliche catalizzate da enzimi, in particolare quelle legate alla produzione di energia, sono reazioni di ossidoriduzione (redox). Questo processo di trasferimento energetico è mediato da coenzimi specializzati che agiscono come navette molecolari, introducendo così il concetto fondamentale dei trasportatori di elettroni.
Now loading…
Reazioni di ossidoriduzione e trasportatori di elettroni
La respirazione cellulare è il processo biochimico primario attraverso cui la cellula converte l’energia chimica contenuta nei nutrienti, come il glucosio, in molecole di ATP prontamente utilizzabili. Questo processo si fonda su una serie controllata di reazioni di ossidoriduzione (redox), in cui gli elettroni vengono trasferiti da una molecola donatrice ad una accettrice.
L’ossidazione completa del glucosio in presenza di ossigeno può essere riassunta dalla seguente reazione globale:
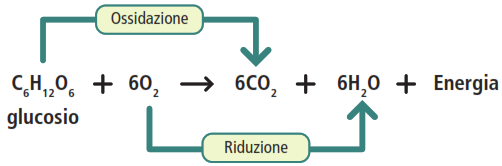
In questa reazione redox:
- il glucosio (C6H12O6) agisce da agente riducente: si ossida, perdendo elettroni (associati ad atomi di idrogeno) e trasformandosi in anidride carbonica (CO₂);
- l’ossigeno (O₂) agisce da agente ossidante: si riduce, accettando elettroni e trasformandosi in acqua (H₂O).
Il trasferimento di elettroni dal glucosio all’ossigeno non è un evento diretto. Una reazione diretta, analoga alla combustione, rilascerebbe l’energia in modo incontrollato, come un’esplosione di calore. La strategia biologica consiste nell’utilizzare un processo a più stadi, mediato da trasportatori di elettroni, per rilasciare l’energia in pacchetti piccoli e gestibili, che possono essere catturati in modo efficiente per la sintesi di ATP.
Il trasferimento graduale di elettroni dal glucosio all’ossigeno avviene attraverso l’intermediazione di coenzimi specializzati che agiscono come trasportatori di potenziale riducente. I principali sono il NADH (nicotinammide-adenin-dinucleotide) e il FADH₂ (flavin-adenin-dinucleotide).
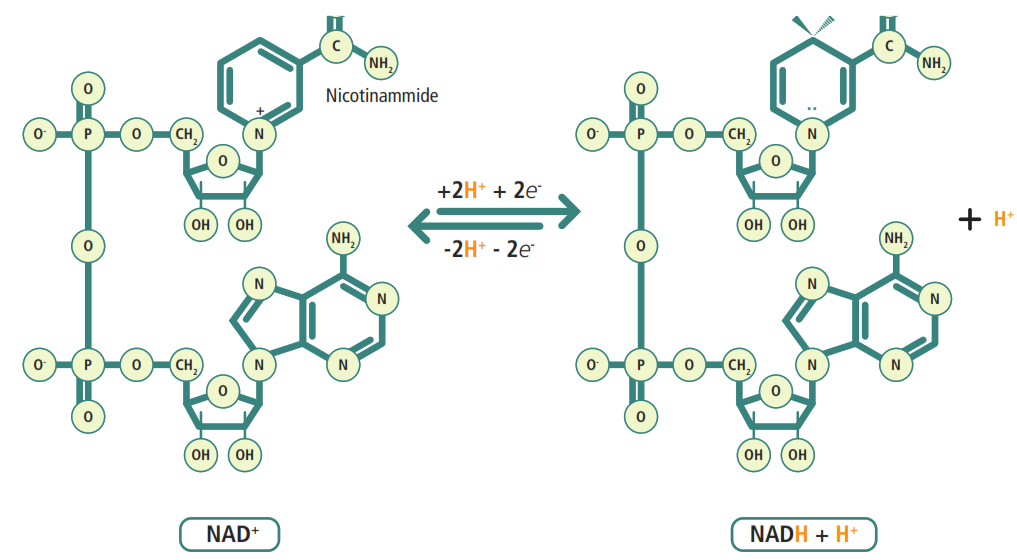
NADH: è un dinucleotide in cui l’adenosina monofosfato (AMP) è legata a un altro nucleotide la cui base azotata è la nicotinammide, un derivato della vitamina PP (Pellagra Preventing). La nicotinammide è il gruppo funzionale che accetta e cede elettroni, passando dalla forma ossidata (NAD⁺) alla forma ridotta (NADH).
FADH₂: è anch’esso un dinucleotide, costituito da AMP e flavin mononucleotide, un derivato della vitamina B₂ (riboflavina). Il suo gruppo funzionale, l’isoallosazina, è responsabile del trasporto di elettroni, permettendo al coenzima di passare dalla forma ossidata (FAD) a quella ridotta (FADH₂).
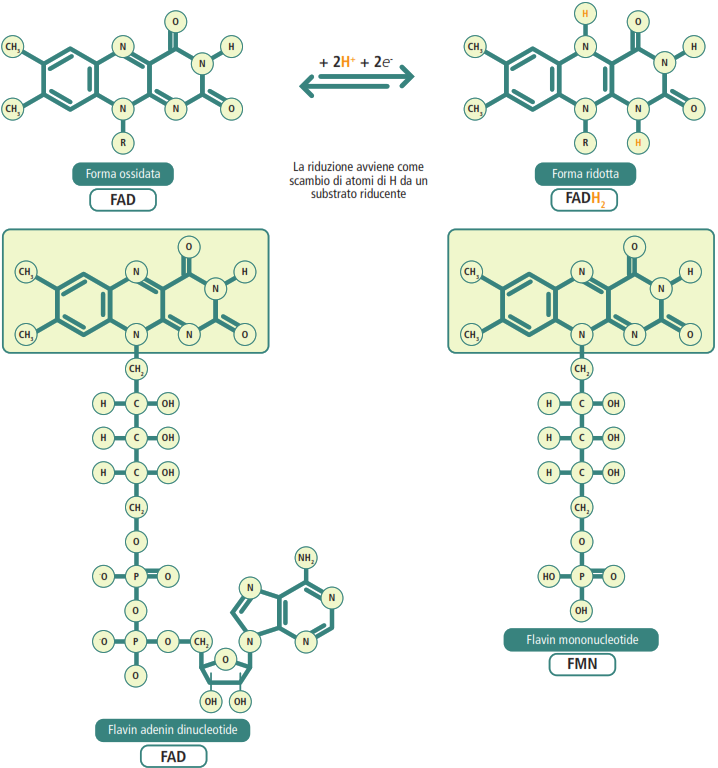
Il ruolo delle vitamine come precursori di molti coenzimi essenziali sottolinea la loro importanza fondamentale nei processi metabolici.
Now loading…
Le fasi della respirazione cellulare aerobica
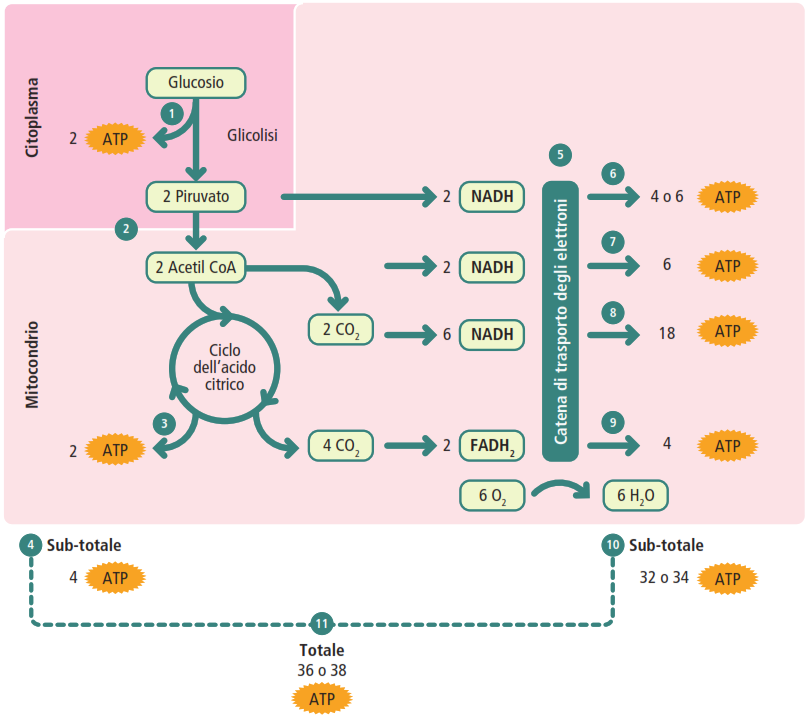
L’estrazione di energia dal glucosio non avviene in un unico passaggio esplosivo, ma attraverso un processo controllato e suddiviso in quattro stadi principali. Questa scomposizione strategica consente di catturare l’energia liberata in modo graduale ed efficiente, massimizzando la produzione di ATP e minimizzando la dispersione di calore.
I Stadio: glicolisi
La glicolisi è una sequenza di 10 reazioni che si svolge nel citosol di tutte le cellule e non richiede la presenza di ossigeno (processo anaerobico). Il suo scopo è scindere una molecola di glucosio (a 6 atomi di carbonio) in due molecole di piruvato (a 3 atomi di carbonio). È suddivisa in due fasi.
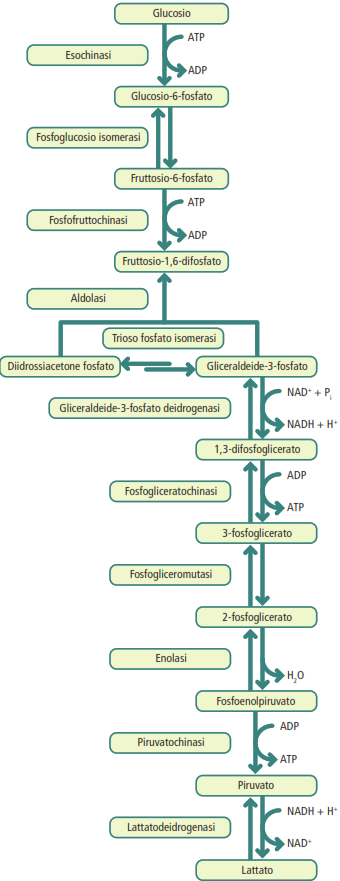
- fase preparatoria: in questa fase, la cellula “investe” energia. Due molecole di ATP vengono consumate per fosforilare il glucosio e i suoi intermedi. Un passaggio chiave è la fosforilazione del glucosio a glucosio-6-fosfato, catalizzata dall’enzima esochinasi. L’aggiunta di un gruppo fosfato carico negativamente rende la molecola polare e incapace di attraversare la membrana lipidica non polare, intrappolandola efficacemente all’interno della cellula per il successivo metabolismo. Un altro passaggio cruciale e irreversibile è la formazione del fruttosio-1,6-bifosfato, catalizzata dalla fosfofruttochinasi-1, un importante enzima di regolazione allosterica. Infine, questa molecola a 6 atomi di carbonio viene scissa in due molecole a 3 atomi di carbonio (gliceraldeide-3-fosfato e diidrossiacetone fosfato);
- fase produttiva: in questa fase, la cellula recupera l’investimento energetico con un guadagno. Vengono prodotte quattro molecole di ATP tramite un meccanismo chiamato fosforilazione a livello del substrato. Questo processo, a differenza della fosforilazione ossidativa che sfrutta un gradiente protonico, implica il trasferimento diretto di un gruppo fosfato da una molecola substrato ad alta energia all’ADP. Inoltre, due molecole di NAD⁺ vengono ridotte a due molecole di NADH. Il prodotto finale è costituito da due molecole di piruvato.
La reazione netta della glicolisi è:
glucosio + 2NAD+ + 2ADP + 2Pi → 2 piruvato + 2ATP + 2NADH + 2H+ + 2H2O
II stadio: formazione di Acetil-Coenzima A
Negli organismi eucarioti, il piruvato prodotto dalla glicolisi viene trasportato all’interno del mitocondrio. Qui subisce una reazione di decarbossilazione ossidativa catalizzata dal complesso multienzimatico della piruvato deidrogenasi. Per ogni molecola di piruvato, questa reazione produce:
- una molecola di anidride carbonica (CO₂);
- una molecola di NADH;
- una molecola di acetil-coenzima A (Acetil-CoA).
Poiché la glicolisi produce due molecole di piruvato per ogni glucosio, la reazione complessiva di questa fase è:
2 piruvato + 2NAD+ + 2CoA → 2 Acetil-CoA + 2NADH + 2CO2
III stadio: Ciclo dell’Acido Citrico (Ciclo di Krebs)
L’acetil-CoA entra nel ciclo dell’acido citrico, una serie ciclica di otto reazioni che si svolge nella matrice mitocondriale.
- ingresso nel ciclo: l’acetil-CoA cede il suo gruppo acetile a due atomi di carbonio all’ossalacetato (un composto a quattro atomi di carbonio), formando il citrato (a sei atomi di carbonio);
- reazioni cicliche: attraverso una serie di trasformazioni, il citrato viene progressivamente ossidato, perdendo due atomi di carbonio sotto forma di CO₂ e rigenerando l’ossalacetato di partenza, pronto per un nuovo ciclo.
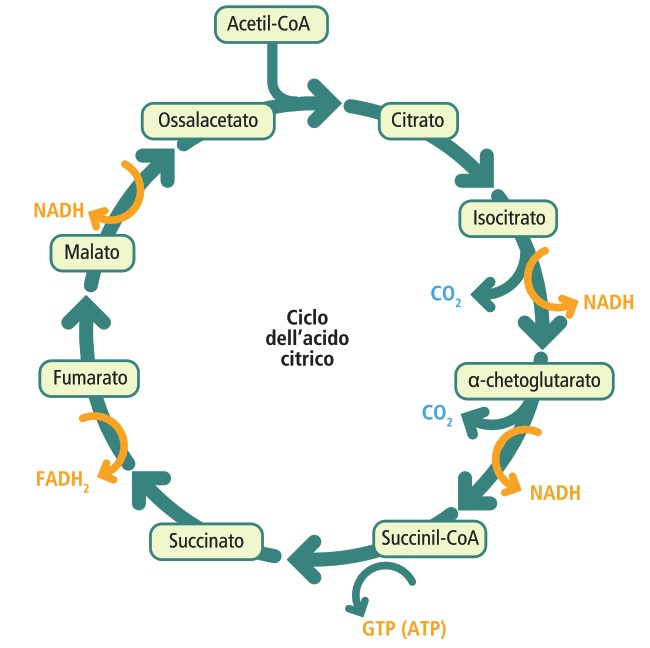
Per ogni molecola di acetil-CoA che entra nel ciclo, vengono prodotti:
- due molecole di CO₂;
- tre molecole di NADH;
- una molecola di FADH₂;
- una molecola di GTP (guanosina trifosfato), energeticamente equivalente a una molecola di ATP.
Il ciclo di Krebs è definito una via anfibolica, poiché partecipa sia a processi catabolici (degradazione dell’acetile) sia anabolici (i suoi intermedi sono precursori per la sintesi di altre molecole). Le reazioni anaplerotiche sono processi che reintegrano gli intermedi del ciclo quando questi vengono utilizzati per altre vie biosintetiche.
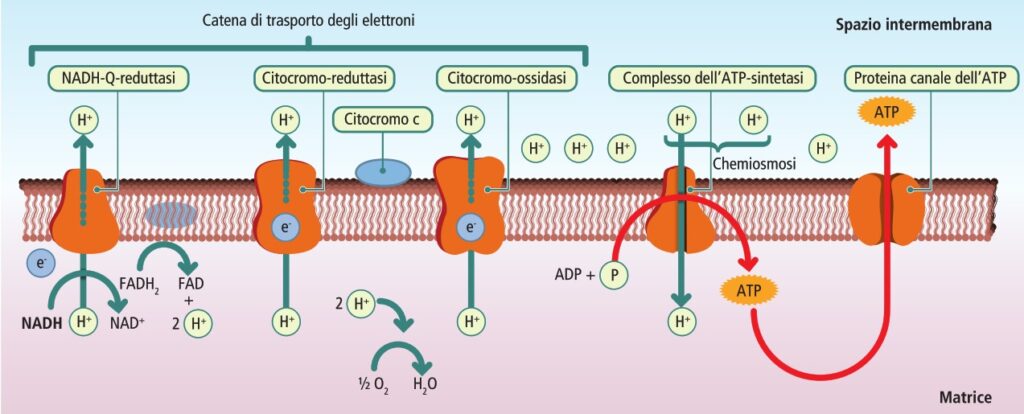
IV stadio: fosforilazione ossidativa
Questa è la fase finale e più redditizia della respirazione cellulare, in cui l’energia immagazzinata negli elettroni trasportati da NADH e FADH₂ viene convertita in ATP. Si compone di due processi accoppiati che avvengono sulla membrana mitocondriale interna.
Now loading…
- Catena di trasporto degli elettroni: è una serie di complessi proteici (numerati da I a IV) e molecole trasportatrici (FMN, ubichinone o coenzima Q, proteine ferro-zolfo e citocromi). Il flusso di elettroni lungo questa catena è guidato da un aumento progressivo dell’elettronegatività dei suoi componenti. Gli elettroni fluiscono “in discesa” da trasportatori a bassa affinità elettronica (come il NADH) a trasportatori con affinità via via maggiore, fino a raggiungere l’ossigeno, l’accettore finale più elettronegativo:
- il Complesso I (NADH deidrogenasi) accetta elettroni dal NADH;
- il Complesso II (succinato deidrogenasi) accetta elettroni dal FADH₂;
- entrambi cedono gli elettroni all’ubichinone, una molecola mobile;
- l’ubichinone li trasferisce al Complesso III, che a sua volta li passa al citocromo c;
- infine, il Complesso IV (citocromo ossidasi) trasferisce gli elettroni all’accettore finale, l’ossigeno molecolare (O₂), che si riduce formando acqua (H₂O).
- Chemiosmosi e sintesi di ATP: secondo la teoria chemiosmotica di Peter Mitchell, l’energia liberata durante il trasporto degli elettroni viene utilizzata dai Complessi I, III e IV per agire come pompe protoniche, trasferendo attivamente ioni idrogeno (H⁺) dalla matrice mitocondriale allo spazio intermembrana. Questo crea un gradiente elettrochimico. La membrana interna è impermeabile ai protoni, che possono rientrare nella matrice solo attraverso un canale specifico presente nel Complesso V, l’ATPsintasi. Il flusso di protoni attraverso il canale Fo dell’ATPsintasi alimenta la subunità catalitica F1, che sintetizza ATP a partire da ADP e Pi.
La resa energetica teorica è di 3 moli di ATP per ogni mole di NADH e 2 moli di ATP per ogni mole di FADH₂ riossidato. In alcuni tessuti, come il tessuto adiposo bruno, la proteina disaccoppiante termogenina (UCP1) crea un canale alternativo per i protoni, dissipando l’energia del gradiente come calore anziché utilizzarla per produrre ATP.
Bilancio energetico totale
L’ossidazione completa di una singola molecola di glucosio attraverso la respirazione cellulare aerobica produce una resa netta totale di circa 36-38 molecole di ATP.
L’intero processo descritto dipende criticamente dalla presenza di ossigeno come accettore finale di elettroni. Ma cosa accade quando l’ossigeno scarseggia o è assente? La cellula deve ricorrere a strategie metaboliche alternative, come la fermentazione.
La fermentazione
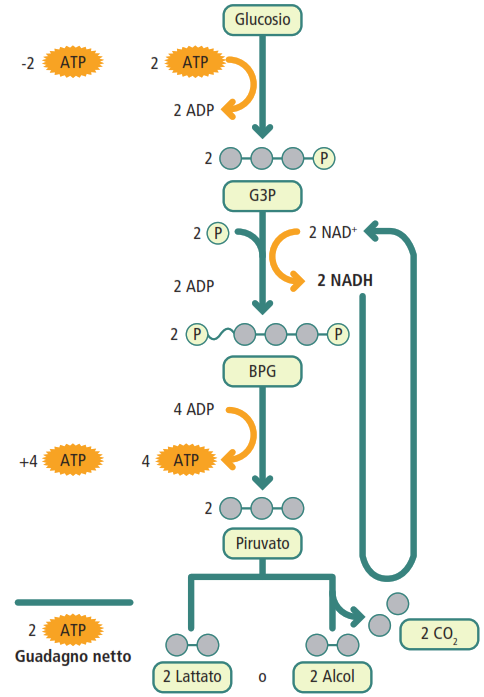
In assenza di ossigeno, la cellula deve affrontare una necessità biochimica critica: la rigenerazione del NAD⁺ per sostenere la glicolisi, che rimane l’unica via per la produzione di ATP. La fermentazione è la strategia metabolica che risolve questo problema. Il suo scopo primario non è produrre ulteriore energia, ma garantire che la glicolisi non si arresti a causa dell’esaurimento del NAD⁺ ossidato, un substrato essenziale per la reazione della gliceraldeide-3-fosfato deidrogenasi.
In condizioni anaerobiche, la catena di trasporto degli elettroni si blocca. Di conseguenza, il NADH prodotto durante la glicolisi non può essere riossidato a NAD⁺. Senza una scorta di NAD⁺, la glicolisi si arresterebbe, interrompendo anche la minima produzione di ATP. La fermentazione risolve questo problema utilizzando il piruvato (o un suo derivato) come accettore di elettroni per riossidare il NADH a NAD⁺.
Esistono diversi tipi di fermentazione, tra cui due principali:
- fermentazione alcolica: attuata da alcuni lieviti e batteri, questo processo converte il piruvato in alcol etilico e anidride carbonica. Durante questa trasformazione, il NADH cede i suoi elettroni, rigenerando il NAD⁺ necessario per la glicolisi;
- fermentazione lattica: in questo processo, l’enzima lattico deidrogenasi catalizza la riduzione diretta del piruvato a lattato, utilizzando gli elettroni del NADH e riossidandolo a NAD⁺. Questo tipo di fermentazione avviene nelle cellule muscolari umane durante uno sforzo fisico intenso e nei globuli rossi, che sono privi di mitocondri. Il lattato prodotto viene poi trasportato al fegato, dove può essere riconvertito in glucosio tramite il processo di gluconeogenesi.