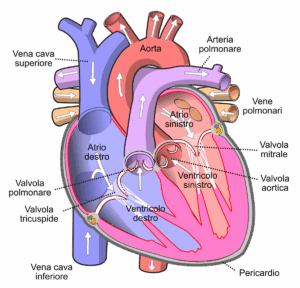
Lo shock ipovolemico è uno stato di ipoperfusione d’organo causato da una grave riduzione del volume ematico circolante con conseguente riduzione del precarico ventricolare e della gittata cardiaca. Può evolvere rapidamente fino a insufficienza multiorgano se non identificato e trattato tempestivamente.
Fisiopatologia essenziale
- Riduzione del volume intravascolare → diminuzione del ritorno venoso e del precarico → riduzione della gittata cardiaca.
- Risposte compensatorie neuro‑ormonali (attivazione simpatico, sistema renina‑angiotensina‑aldosterone, vasopressina) determinano tachicardia, vasocostrizione periferica e ritenzione idrosalina; queste misure temporaneamente mantengono la pressione ma riducono perfusione periferica.
- Se la perdita di volume persiste, si instaura ipoperfusione tessutale con metabolismo anaerobio e accumulo di lattato, disfunzione endoteliale e alterazioni coagulopatiche secondarie.
Cause cliniche rilevanti
- Emorragiche:
- trauma con lesioni arteriose;
- emorragie gastrointestinali;
- emorragie intratoraciche, intraperitoneali o retroperitoneali;
- emorragie dei tessuti molli;
- fratture di ossa lunghe con significativa perdita ematica.
- Non emorragiche:
- perdite esterne di liquidi (vomito, diarrea, sudorazione profusa, poliuria);
- ustioni;
- sequestro intravascolare (ascite massiva, pancreatite);
- edema generalizzato o focale che riduce il volume circolante effettivo.
Valutazione clinica e stadiazione
- Valutazione anamnestica:
- dinamica degli eventi per distinguere causa emorragica da non emorragica;
- meccanismo di trauma;
- comorbilità cardiopolmonari che modificano la presentazione.
- Esame obiettivo fondamentale: pressione arteriosa, frequenza cardiaca, perfusione periferica (colore, temperatura, tempo di riempimento capillare), stato di coscienza, frequenza respiratoria, produzione urinaria.
- Classificazione per gravità (I–IV) basata sulla percentuale di perdita volemica e segni clinici:
- stadio I (lieve): perdita <15% (circa 750 mL in un soggetto di 70 kg); segno principale tachicardia, pressione normale soprattutto se supino;
- stadio II (moderato): perdita 20–30% (circa 1500 mL); tachicardia, ipotensione ortostatica, ansia, oliguria iniziale (<1 mL/kg/h);
- stadio III (grave): perdita >30% (circa 2000 mL); ipotensione anche supina, peggioramento ipoperfusione con alterazione dello stato mentale (ipoperfusione cerebrale) e oliguria marcata (ipoperfusione renale).
- stadio IV (severo): perdita >40% (>2000 ml); ipotensione severa (con una pressione arteriosa media < 65mmHg), anuria, coma, estremità fredde per intensa vasocostrizione centrale.
Queste categorie riflettono la progressione clinica e guidano urgenza e intensità delle misure terapeutiche.
Caricamento….
Monitoraggio e indagini utili
- Parametri vitali e monitor continuo: PA invasiva quando indicata, ECG, saturimetria, diuresi oraria.
- Emogasanalisi arteriosa e trend della lattatemia come marker di ipoperfusione e risposta alla rianimazione.
- Emocromo, coagulazione, fibrinogeno, cross‑match per trasfusioni.
- Monitoraggio emodinamico invasivo (cateterismo di Swan‑Ganz) se necessario per misurare portata cardiaca e indici derivati in pazienti complessi o shock refrattario.
- Metriche dinamiche di risposta al volume: valutazione ecografica della vena cava inferiore in proiezione sottocostale e sua collassabilità con atti respiratori, variazione della pressione del polso (PPV) e della gittata sistolica (SVV) in pazienti ventilati, test di passive leg raising (PLR) con misurazione della risposta emodinamica; tutte utili per stimare la fluid responsiveness.
- Esami strumentali per identificare la causa: in urgenza il protocollo ECO‑FAST nel politraumatizzato è l’unico esame strumentale consentito prima della stabilizzazione; ulteriori indagini (angio‑TC, angiografia, laparotomia esplorativa, endoscopia digestiva nelle emorragie GI) dopo stabilizzazione dei parametri vitali.
Caricamento…
Principi del trattamento immediato e successive fasi
Caricamento…
- Controllo della causa
- stop emorragico prioritario: controllo emostatico chirurgico o radiologico (embolizzazione) secondo la fonte del sanguinamento; la correzione della causa è la misura primaria e imprescindibile.
- Rianimazione volemica calibrata con l’obiettivo di ripristinare precarico e gittata cardiaca adeguata alla perfusione tessutale senza provocare sovraccarico.
- fluidoterapia: cristalloidi come prima scelta; preferire cristalloidi bilanciati (ringer lattato, Ringer acetato, Plasmalyte) per profilo idroelettrolitico più simile al plasma rispetto alla soluzione salina 0,9% (che contiene solo Na e Cl) (raccomandazione pratica e fisiopatologica del trattamento iniziale);
- uso dei colloidi è generalmente sconsigliato per rischio di insufficienza renale, coagulopatie e reazioni anafilattoidi; possono essere considerati come terapia di salvataggio in emorragia massiva refrattaria non responsiva a grandi volumi di cristalloidi;
- attuare strategie guidate dalla fluid responsiveness (PPV, SVV, PLR, IVC dynamics) per evitare fluid overload e edema polmonare, specialmente in pazienti con scompenso cardiaco.
- Trasfusione di emocomponenti
- globuli rossi concentrati: soglia trasfusionale comunemente adottata a livello internazionale è intorno a 7 g/dL; alcune linee indicano cut‑off a 6 g/dL; decisione individuale in base a comorbidità, ischemia cardiaca e condizioni cliniche (soglia relativa 7-10 g/dL);
- in emorragia massiva o diatesi emorragiche, protocollo di trasfusione massiva con rapporto adeguato di RBC:FFP:platelets e uso di fibrinogeno quando indicato;
- utilizzo mirato di plasma fresco congelato, unità piastriniche o concentrate di fattori (incluso fibrinogeno) in caso di alterazioni dell’emostasi documentate; test viscoelastici (ROTEM/TEG) sono molto utili per individuare specifici deficit coagulativi e guidare la terapia sostitutiva.
- Supporto emodinamico e ventilatorio
- se nonostante il controllo della causa e adeguata rianimazione volemica la pressione rimane inadeguata, considerare vasopressori (es. noradrenalina) per mantenere perfusione centrale; uso guidato dallo stato emodinamico complessivo;
- ventilazione di supporto quando necessario; attenzione all’effetto della ventilazione meccanica sui parametri di responsività al volume.
Soglie trasfusionali per emoglobinemia
| Emoglobinemia (g/dL) | Raccomandazione trasfusionale | Indicazioni cliniche | Azione pratica |
|---|---|---|---|
| < 7 | Trasfusione sempre indicata | Anemia grave sintomatica instabilità emodinamica | Preparare e somministrare emazie concentrate monitorare segni vitali |
| 7-10 | Trasfusione indicata solo in specifici gruppi | Anziani > 70 anni patologia cardiaca ischemica o scompenso cardiaco | Valutare rischio/beneficio considerare trasfusione se sintomi o ischemia |
| > 10 | Trasfusione non indicata | Pazienti stabili senza sintomi ischemici | Evitare trasfusione monitorare e rivalutare emoglobina |
Possibili effetti collaterali alla trasfusione di globuli rossi concentrati
| Effetto | Tempistica | Segni principali | Azione immediata |
|---|---|---|---|
| Intossicazione da citrato | Immediata-precoce | Ipotensione parestesie | Somministrare calcio monitorare elettroliti |
| Iperkaliemia | Immediata-precoce | Aritmie debolezza | Controllare K+ trattare aritmie |
| Ipotermia | Immediata | Bradiaritmie tremore | Riscaldare paziente e prodotto |
| Emolisi immuno-mediate precoci | Precoce | Febbre dolore lombare emoglobinuria | Sospendere trasfusione supporto emodinamico |
| Emolisi immuno-mediate tardive | Tardiva | Anemia progressiva ittero | Monitorare Hb indagini immunoematologiche |
| Formazione di microaggregati | Immediata | Ipossia tissutale | Usare filtri appropriati |
| Problemi infettivi | Variabile | Febbre segni sistemici | Valutare colturale terapia mirata |
| TRALI | Entro 6 ore | Dispnea acuta ipossiemia | Sospendere trasfusione supporto respiratorio |
| Insufficienza respiratoria | Immediata-Tardiva | Dispnea severa ipossiemia | O2 ventilazione se necessaria |
| TACO (sovraccarico) | Immediata-precoce | Edema polmonare scompenso cardiaco | Diuretici rallentare/sospendere trasfusione |
Caricamento….
Note pratiche per il clinico
- In emergenza, eseguire ECO‑FAST e misure di rianimazione simultanee; non ritardare il controllo emorragico per esami non urgenti.
- Utilizzare parametri dinamici di fluid responsiveness piuttosto che valori statici (PVC isolata spesso fuorviante).
- Monitorare la lattatemia nel tempo per valutare risposta alla rianimazione e prognosi.
- Personalizzare la soglia trasfusionale: anziani e pazienti con malattia coronarica possono richiedere soglie più alte; bilanciare rischi/benefici della trasfusione.
- Considerare rapidamente la correzione dei deficit di coagulazione con guida di test viscoelastici nelle emorragie importanti.
Conclusione operativa
- Priorità: identificare e controllare la fonte di perdita volemica, ristabilire un precarico adeguato con fluidi guidati dalla responsività e integrare trasfusioni e prodotti ematici quando indicati.
- Usare monitoraggio dinamico e laboratoristico (lattato, ROTEM/TEG quando disponibili) per guidare la rianimazione e minimizzare danni da sovraccarico o coagulopatia.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.