La psittacosi, nota anche come ornitosi o febbre dei pappagalli, è una zoonosi di rilevanza globale causata dal batterio intracellulare obbligato Chlamydia psittaci.
Questo patogeno ha influenzato profondamente la medicina preventiva fin dalla sua drammatica comparsa su scala pandemica nel 1929-1930.1
Sebbene sia spesso classificata come una causa rara di polmonite acquisita in comunità (Community-Acquired Pneumonia, CAP), i dati recenti suggeriscono che la sua incidenza reale sia sistematicamente sottostimata a causa della aspecificità dei sintomi e delle difficoltà diagnostiche insite nella biologia del patogeno.2 3
L’emergenza di nuovi focolai in Europa nel biennio 2023-2024 ha riacceso l’interesse della comunità scientifica e delle autorità di sanità pubblica, sottolineando la necessità di un approccio coordinato basato sul principio One Health per il monitoraggio dei serbatoi selvatici e domestici, il miglioramento delle tecniche di screening molecolare e lo sviluppo di strategie vaccinali di nuova generazione.4 5
Caricamento….
- Eziologia e biologia molecolare di Chlamydia psittaci
- Caratteristiche morfologiche e ciclo vitale bifasico
- Classificazione genotipica e specificità dell’ospite
- Aspetti epidemiologici e dinamiche di trasmissione
- Modalità di contagio e fattori di rischio
- L’emergenza europea del 2023-2024
- Patofisiologia e meccanismi del danno tissutale
- Manifestazioni cliniche e quadro sintomatologico
- Presentazione respiratoria e sistemica
- Segni clinici patognomonici e complicanze
- Diagnostica clinica e di laboratorio
- Analisi di laboratorio generali e imaging
- Diagnostica microbiologica specialistica
- Protocolli di trattamento e gestione clinica
- Terapia antibiotica di prima scelta
- Alternative terapeutiche e popolazioni vulnerabili
- Prognosi e decorso post-infettivo
- Strategie di prevenzione e biosicurezza
- Gestione degli animali e biosecurity veterinaria
- Normativa italiana e sicurezza sul lavoro
- Ricerca vaccinale: prospettive 2025
Eziologia e biologia molecolare di Chlamydia psittaci
L’agente eziologico della psittacosi, Chlamydia psittaci, è un microrganismo appartenente all’ordine Chlamydiales, famiglia Chlamydiaceae.6 Si tratta di un batterio Gram-negativo caratterizzato da un ciclo vitale unico e da un parassitismo intracellulare obbligato che lo rende energeticamente dipendente dalla cellula ospite.7
La struttura di C. psittaci è definita da un genoma ridotto, frutto di un lungo processo di adattamento evolutivo alla vita intracellulare, che comprende circa 600-1000 geni necessari per la manipolazione del metabolismo dell’ospite e per l’elusione del sistema immunitario.
Caratteristiche morfologiche e ciclo vitale bifasico
Il batterio si presenta in due forme morfologiche e funzionali distinte che si alternano durante il suo ciclo di sviluppo, garantendo sia la persistenza ambientale che la replicazione massiva all’interno della cellula eucariotica.8 9
| Fase del ciclo | Nome | Dimensioni | Funzione principale | Caratteristiche Metaboliche |
|---|---|---|---|---|
| Extracellulare | Corpo Elementare (EB) | 0,25 – 0,3 μm | Infezione e sopravvivenza ambientale | Inattivo, resistente agli stress, rigido |
| Intracellulare | Corpo Reticolato (RB) | 0,5 – 1,0 μm | Replicazione e crescita | Attivo, fragile, divisione per scissione binaria |
| Persistente | Corpo Aberrante (AB) | Variabile | Sopravvivenza a lungo termine | Non replicativo, vitale ma non coltivabile |
Il processo infettivo inizia quando i corpi elementari (EB) vengono inalati e aderiscono alla membrana delle cellule bersaglio, tipicamente macrofagi o cellule epiteliali respiratorie, attraverso l’interazione con recettori specifici.
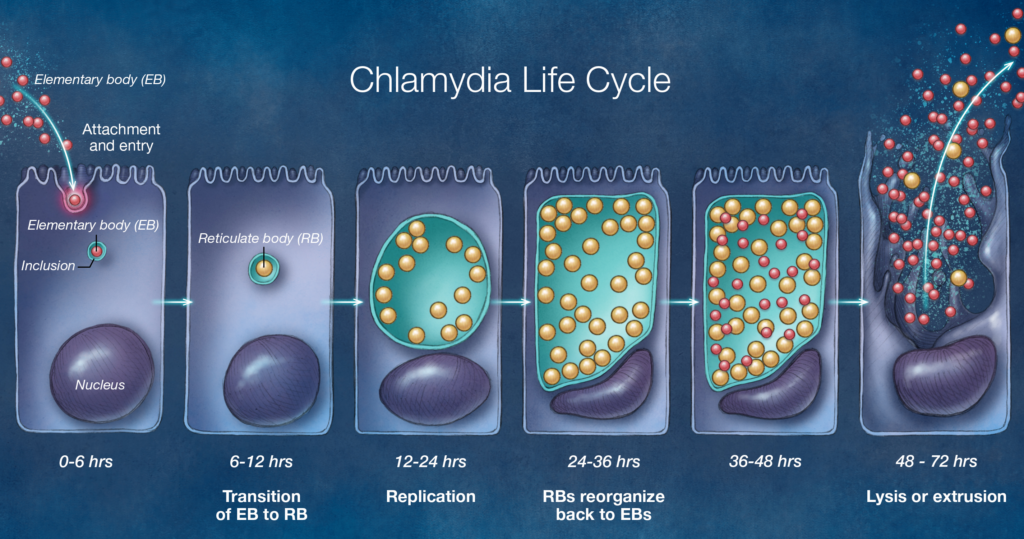
Una volta internalizzati per endocitosi, gli EB rimangono all'interno di un vacuolo protettivo chiamato inclusione. In questa fase, il batterio impedisce la fusione del vacuolo con i lisosomi dell'ospite, creando un microambiente favorevole alla differenziazione degli EB in corpi reticolati (RB).
Gli RB iniziano quindi a dividersi attivamente utilizzando l'ATP cellulare dell'ospite, riempiendo l'inclusione citoplasmatica.
Al termine del ciclo replicativo, gli RB si riconvertono in EB, che vengono rilasciati nell'ambiente extracellulare tramite lisi cellulare o meccanismi di estrusione, pronti a ricominciare il ciclo.
Un elemento di estremo interesse clinico è la formazione dei corpi aberranti (AB) in risposta a condizioni di stress ambientale o farmacologico.10 Fattori di stress quali la presenza di interferone-gamma, la carenza di nutrienti essenziali come il ferro e il triptofano, o l’esposizione a antibiotici β-lattamici possono indurre C. psittaci in uno stato di persistenza cellulare.
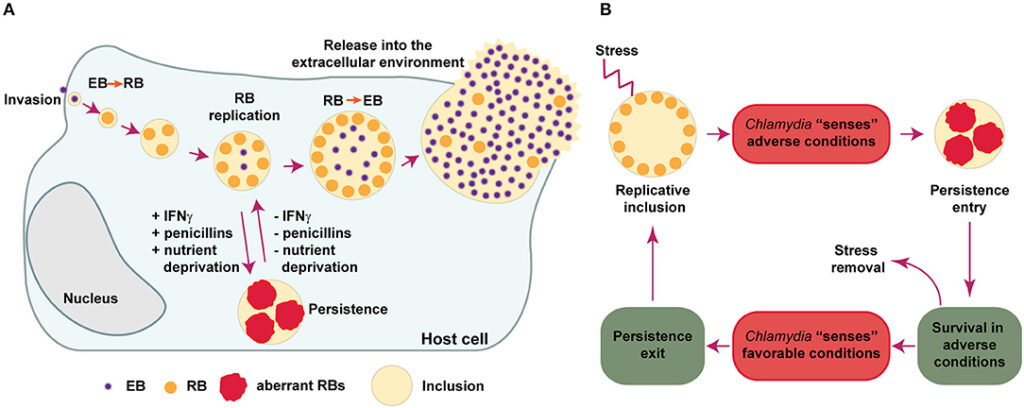
Questo stato permette al patogeno di sopravvivere in modo silente all’interno dell’ospite per periodi prolungati, spiegando la tendenza alla cronicità di alcune forme di psittacosi e l’insorgenza di recidive cliniche qualora il trattamento antibiotico non venga somministrato per un tempo sufficiente a eradicare le forme persistenti.11
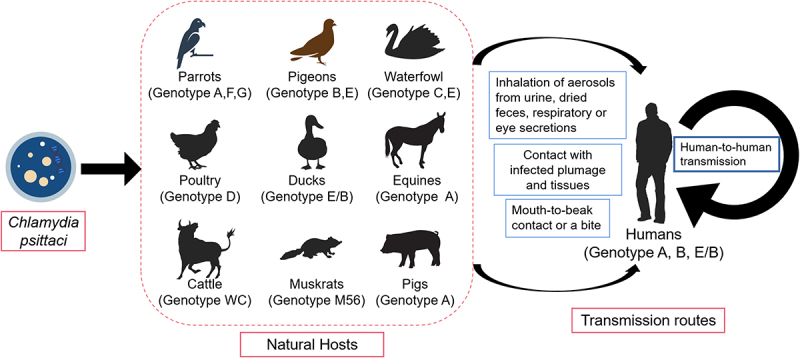
Classificazione genotipica e specificità dell’ospite
La variabilità genetica di C. psittaci è ampia e correla strettamente con la specificità dell’ospite animale e la virulenza del ceppo nell’essere umano. La classificazione moderna si basa sulla sequenza del gene ompA, che codifica per la proteina principale della membrana esterna (MOMP).
Ad oggi sono stati identificati almeno 17 genotipi, ciascuno con una nicchia ecologica preferenziale.
| Genotipo | Ospite naturale prevalente | Virulenza umana | Implicazioni epidemiologiche |
|---|---|---|---|
| A | Psittaciformi (pappagalli, are) | Molto alta | Causa principale di polmoniti severe zoonotiche |
| B | Colombiformi (piccioni, tortore) | Moderata | Spesso associata a esposizioni urbane e parchi |
| C | Uccelli acquatici (anatre, oche) | Alta | Rilevante per cacciatori e addetti alla lavorazione |
| D | Tacchini e pollame industriale | Alta | Rischio elevato nei macelli e impianti di trasformazione |
| E | Piccioni, anatre, ratti | Variabile | Coinvolto in cross-trasmissioni tra specie diverse |
| F | Parrocchetti | Moderata | Casi sporadici legati al commercio di animali |
| E/B | Anatre e oche (frequente in Asia) | Alta | Associato a focolai recenti in impianti industriali |
La comprensione della distribuzione genotipica è fondamentale per tracciare l’origine dei focolai e per implementare misure di biosicurezza mirate. Ad esempio, il genotipo A è endemico negli psittacidi e rappresenta la minaccia più seria per i proprietari di uccelli da compagnia, mentre i genotipi C e D sono critici per la sicurezza alimentare e dei lavoratori del settore avicolo.
Caricamento….
Aspetti epidemiologici e dinamiche di trasmissione
La psittacosi è una zoonosi cosmopolita con una dinamica di trasmissione complessa che coinvolge oltre 467 specie di uccelli appartenenti a 30 ordini diversi. Sebbene la percezione comune colleghi la malattia esclusivamente ai pappagalli, la realtà epidemiologica include piccioni, passeri, gabbiani, polli, tacchini e anatre come serbatoi significativi.12 13
Modalità di contagio e fattori di rischio
Il principale meccanismo di trasmissione all’uomo è l’inalazione di bioaerosol contaminati. Gli uccelli infetti eliminano il batterio attraverso le feci, le secrezioni nasali e oculari, e la polvere delle piume. Quando queste secrezioni si essiccano nell’ambiente, possono essere disperse nell’aria durante la pulizia delle gabbie, il battito delle ali o la manipolazione degli uccelli.14
Le categorie professionali a più alto rischio comprendono:
- veterinari e tecnici di laboratorio che manipolano campioni biologici;15
- lavoratori dell’industria avicola, in particolare quelli impiegati nelle fasi di macellazione, aggancio dei volatili vivi ed eviscerazione;
- allevatori, proprietari di negozi di animali e appassionati di ornitologia;
- operatori addetti alla pulizia di monumenti o alla manutenzione di aree urbane infestate da piccioni.
Un fattore epidemiologico critico è rappresentato dagli uccelli portatori asintomatici, che possono apparire sani ma eliminare il batterio in modo intermittente.
Condizioni di stress quali il trasporto, il sovraffollamento o cambiamenti climatici possono innescare una riattivazione dell’infezione latente nell’animale, portando a massicci spargimenti di C. psittaci nell’ambiente.
Sebbene il contagio diretto tra esseri umani sia stato storicamente considerato un evento eccezionale, focolai recenti hanno confermato la possibilità di trasmissione interumana attraverso goccioline respiratorie, sollevando nuove preoccupazioni per il controllo delle infezioni in ambito ospedaliero e familiare.
L’emergenza europea del 2023-2024
A partire dalla fine del 2023, diversi paesi europei hanno segnalato un incremento anomalo dei casi di psittacosi, portando l’Organizzazione Mondiale della Sanità a emettere un alert internazionale nel marzo 2024.16
Questo incremento è stato particolarmente evidente in Austria, Danimarca, Germania, Svezia e Paesi Bassi.
| Paese | Casi confermati (Nov 2023 – Feb 2024) | Tasso di ospedalizzazione | Decessi riportati | Osservazioni sulla fonte |
|---|---|---|---|---|
| Danimarca | 23 | ~74% | 4 | Esposizione a mangiatoie e uccelli selvatici |
| Austria | 18 | Alta | 0 | Casi non correlati a viaggi; diagnosi sierologica |
| Germania | 19 | ~84% | 0 | Cluster geografico rilevato ad Hannover |
| Paesi Bassi | 21 | 100% | 1 | Raddoppio dell’incidenza rispetto alla media |
| Svezia | 26 | N/A | 0 | Incremento legato a test molecolari più sensibili |
In Danimarca, la maggior parte dei pazienti ha indicato un contatto con uccelli selvatici, suggerendo che le mangiatoie da giardino possano fungere da siti di amplificazione per il patogeno durante l’inverno. In Germania e nei Paesi Bassi, l’elevato tasso di ospedalizzazione riflette una presentazione clinica severa, spesso caratterizzata da polmonite bilaterale. Le autorità sanitarie hanno ipotizzato che l’aumento delle diagnosi sia parzialmente dovuto all’implementazione di test molecolari (RT-PCR) nei pannelli respiratori standard, permettendo di identificare casi che in passato sarebbero stati classificati come polmoniti ad eziologia ignota.17
Patofisiologia e meccanismi del danno tissutale
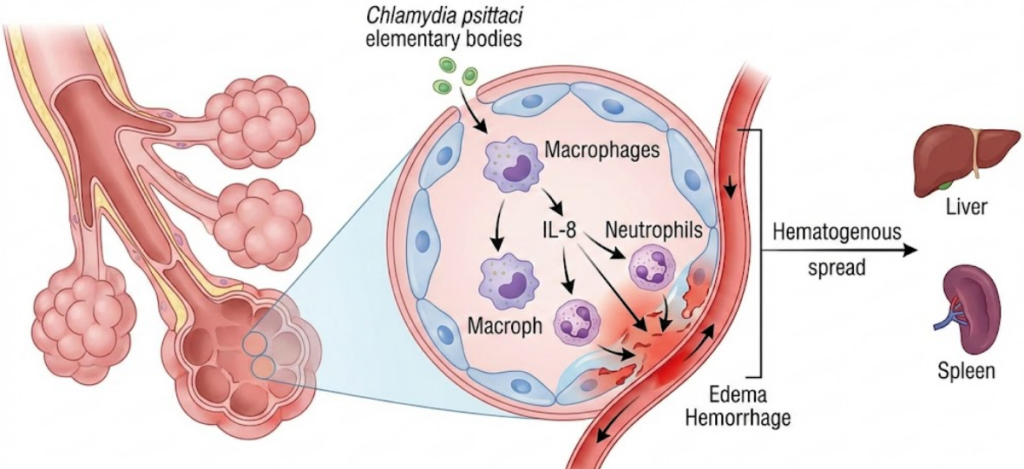
La patogenesi della psittacosi nell’essere umano inizia con la deposizione dei corpi elementari nelle vie aeree inferiori.
Il batterio possiede un trofismo specifico per le cellule dell’epitelio alveolare e i macrofagi interstiziali. Una volta penetrato nelle cellule, C. psittaci attiva una cascata infiammatoria mediata dal rilascio di citochine pro-infiammatorie, tra cui spicca l’interleuchina-8 (IL-8), responsabile di un massiccio reclutamento di neutrofili nel parenchima polmonare.
Il danno tissutale è il risultato di un duplice meccanismo:
- azione batterica diretta: la replicazione intracellulare porta alla distruzione delle cellule ospiti e al rilascio di endotossine che danneggiano la barriera alveolo-capillare;
- risposta immunitaria dell’ospite: l’infiammazione persistente e la risposta cellulo-mediata causano edema, emorragia intra-alveolare e formazione di essudati fibrinosi, riducendo drasticamente gli scambi gassosi e portando a ipossiemia.
Dall’area polmonare, il batterio può diffondere per via ematogena verso il sistema reticolo-endoteliale, localizzandosi in particolare nel fegato e nella milza. Questa disseminazione sistemica spiega le manifestazioni extra-polmonari della malattia, come l’epatomegalia, la splenomegalia e l’interessamento del sistema nervoso centrale. In rari casi, la psittacosi può evolvere in una sindrome da distress respiratorio acuto (ARDS) o in uno shock settico con coagulazione intravascolare disseminata (CID), mettendo in pericolo la vita del paziente.
Manifestazioni cliniche e quadro sintomatologico
Il quadro clinico della psittacosi nell’uomo è caratterizzato da un’estrema eterogeneità, che va da forme asintomatiche o paucisintomatiche a sindromi sistemiche fulminanti.
L’insorgenza dei sintomi avviene solitamente dopo un’incubazione di 5-14 giorni, sebbene siano stati riportati casi con periodi fino a 28 giorni.
Presentazione respiratoria e sistemica
La malattia esordisce tipicamente in modo brusco con una sindrome simil-influenzale caratterizzata da:
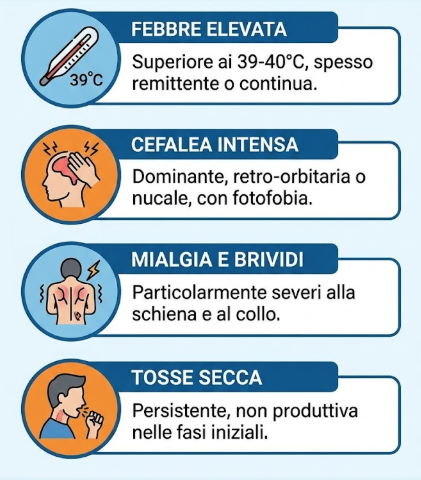
- febbre elevata: spesso superiore ai 39-40°C, a carattere remittente o continuo;
- cefalea intensa: frequentemente il sintomo dominante, localizzata in sede retro-orbitaria o nucale, talvolta associata a fotofobia;
- mialgia e brividi: particolarmente severi alla schiena e al collo;
- tosse secca: persistente e non produttiva nelle fasi iniziali; può diventare produttiva con espettorato mucopurulento tardivamente.
All’esame fisico, la discrepanza tra i reperti obiettivi polmonari (spesso minimi o assenti nelle fasi precoci) e la gravità dei sintomi sistemici è un indizio diagnostico fondamentale.
La comparsa di dispnea e tachipnea indica la progressione verso una polmonite atipica consolidata.
Segni clinici patognomonici e complicanze
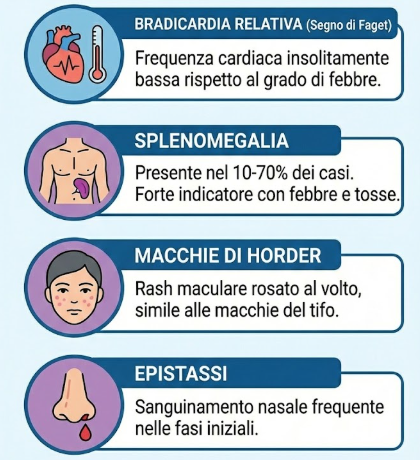
I medici devono ricercare segni specifici che orientino verso la diagnosi di psittacosi rispetto ad altre polmoniti atipiche:
- bradicardia relativa (segno di Faget): una frequenza cardiaca che rimane insolitamente bassa rispetto al grado di febbre;
- splenomegalia: presente nel 10-70% dei casi; la sua rilevazione in un paziente con febbre e tosse è un forte indicatore di psittacosi;
- macchie di Horder: rash maculare rosato localizzato al volto, morfologicamente simile alle macchie rosee della febbre tifoide;
- epistassi: frequente nelle fasi iniziali della malattia.
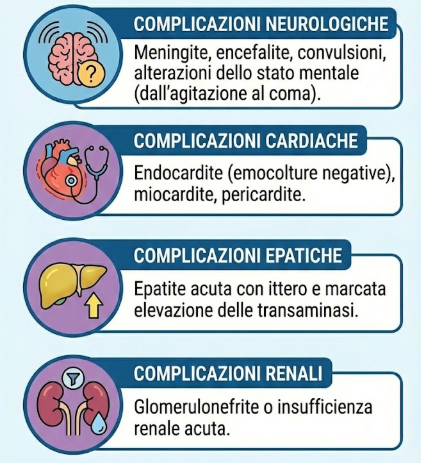
Le complicanze possono essere severe e coinvolgere molteplici organi:
- neurologiche: meningite, encefalite, convulsioni, o alterazioni dello stato mentale che variano dall’agitazione al coma;
- cardiache: endocardite con emocolture negative, miocardite e pericardite;
- epatiche: epatite acuta con ittero e marcata elevazione delle transaminasi;
- renali: glomerulonefrite o insufficienza renale acuta.
Caricamento....
Diagnostica clinica e di laboratorio
La diagnosi di psittacosi è notoriamente difficile e richiede una combinazione di sospetto clinico basato sull’anamnesi, indagini radiologiche e test microbiologici specialistici.18
Analisi di laboratorio generali e imaging
Gli esami ematochimici di routine spesso mostrano un quadro aspecifico:
- emocromo: spesso normale o con lieve leucopenia/neutropenia; la leucocitosi è rara;
- indici di flogosi: VES e proteina C-reattiva sono generalmente elevate;
- funzionalità epatica: alterazioni lievi o moderate delle transaminasi e della bilirubina;
- elettroliti: l’iponatriemia (sodio < 130 mEq/L) è un reperto comune associato alla gravità della polmonite.
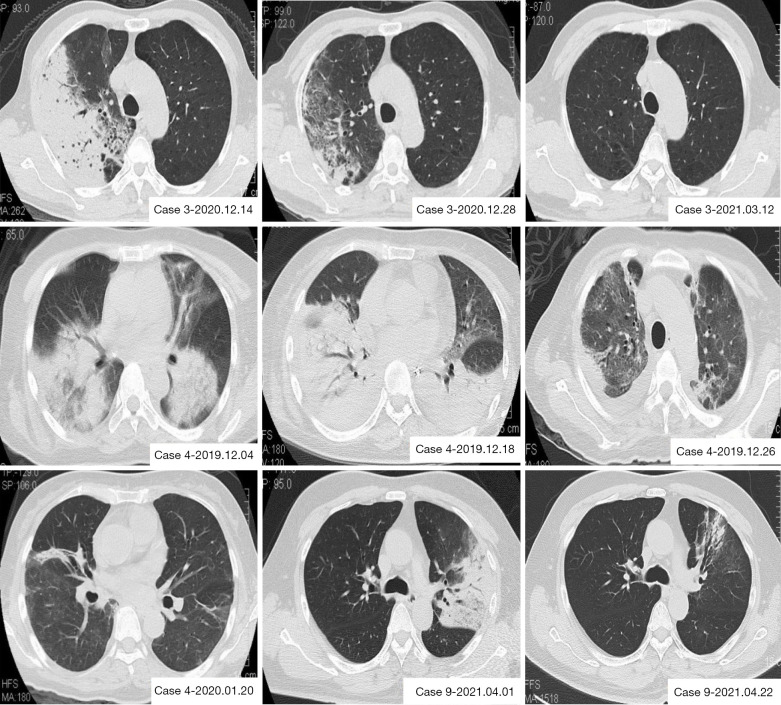
L’imaging radiologico è essenziale. La radiografia del torace mostra tipicamente infiltrati a focolaio o interstiziali, spesso monolaterali all’inizio, con una predilezione per i lobi inferiori.
La TC del torace è più sensibile e può evidenziare aree di consolidamento parenchimale circondate da un alone di vetro smerigliato (halo sign) o piccoli noduli centrolobulari.19
Diagnostica microbiologica specialistica
A causa della natura intracellulare obbligata e della pericolosità del batterio, le tecniche diagnostiche sono suddivise per affidabilità e disponibilità.
| Metodo | Descrizione | Vantaggi | Svantaggi |
|---|---|---|---|
| Sierologia (MIF) | Ricerca di anticorpi IgG/IgM specifici | Standard attuale, specifica | Richiede campioni binati (acuto/convalescente); ritardo diagnostico |
| PCR / NAAT | Amplificazione del DNA batterico | Rapida, alta sensibilità e specificità | Disponibile solo in laboratori specializzati; possibile negatività se precoce |
| mNGS | Sequenziamento genomico massivo | Identifica il patogeno senza sospetto clinico | Costosa; richiede bioinformatica complessa |
| Coltura | Crescita su linee cellulari o uova | Definitiva per studi di ricerca | Estremamente lenta; elevato rischio biohazard (BSL-3) |
La microimmunofluorescenza (MIF) è considerata il gold standard sierologico poiché consente di distinguere tra C. psittaci, C. pneumoniae e C. trachomatis.
Una diagnosi confermata richiede un aumento di quattro volte del titolo anticorpale in campioni prelevati a distanza di 2-4 settimane. Tuttavia, per le decisioni cliniche immediate, la PCR su espettorato, liquido di lavaggio broncoalveolare (BAL) o sangue è diventata lo strumento di scelta per la sua capacità di fornire risultati in poche ore.
Caricamento….
Protocolli di trattamento e gestione clinica
Il trattamento della psittacosi deve essere tempestivo per ridurre il rischio di mortalità e prevenire danni permanenti agli organi.
Terapia antibiotica di prima scelta
Le tetracicline rimangono la classe di farmaci più efficace contro C. psittaci.
Lo standard terapeutico è rappresentato dalla Doxiciclina. Il dosaggio raccomandato è di 100 mg per via orale ogni 12 ore.
Nei pazienti con polmonite severa o impossibilità all’assunzione orale, si utilizza la Doxiciclina hyclate per via endovenosa al dosaggio di 4,4 mg/kg/die (fino a un massimo di 100 mg per infusione, due volte al giorno).
La risposta clinica è solitamente drammatica, con una risoluzione della febbre e un miglioramento soggettivo entro 48-72 ore dall’inizio del trattamento.
Tuttavia, la durata della terapia è cruciale: per evitare recidive legate alla persistenza dei corpi aberranti, gli antibiotici devono essere proseguiti per almeno 10-14 giorni dopo che il paziente è diventato apiretico.
Alternative terapeutiche e popolazioni vulnerabili
In caso di controindicazioni alle tetracicline (allergie, gravidanza, età pediatrica), si ricorre ai macrolidi:
- eritromicina: storicamente l’alternativa principale, sebbene meno efficace delle tetracicline;
- azitromicina: utilizzata nei bambini sotto gli 8 anni e nelle donne incinte, sebbene siano stati riportati casi di fallimento terapeutico che richiedono un attento monitoraggio clinico;
- cloramfenicolo: può essere considerato in casi selezionati, ma il suo utilizzo è limitato dai potenziali effetti collaterali ematologici.
I pazienti con insufficienza respiratoria acuta necessitano di ospedalizzazione in terapia intensiva, supporto con ossigenoterapia o ventilazione meccanica e gestione del bilancio idroelettrolitico.
Now loading…
Prognosi e decorso post-infettivo
La prognosi della psittacosi dipende strettamente dalla tempestività della diagnosi e dell’inizio della terapia antibiotica.
Il tasso di mortalità è estremamente basso, stimato a meno dell’1% nei pazienti trattati. La maggior parte dei soggetti ottiene una guarigione completa, sebbene la convalescenza possa essere prolungata (settimane o mesi) nei casi gravi, caratterizzata da astenia cronica e tosse residua.
Prima della scoperta degli antibiotici, la mortalità variava dal 15% al 30%. In era moderna, la mortalità per psittacosi non diagnosticata rimane significativa a causa della progressione verso l’insufficienza multiorgano.
Le recidive sono possibili se il trattamento è troppo breve. Inoltre, l’infezione non conferisce un’immunità permanente, rendendo possibili reinfezioni in caso di nuova esposizione a uccelli infetti.
Strategie di prevenzione e biosicurezza
La prevenzione della psittacosi richiede un approccio integrato che coinvolga la sorveglianza veterinaria, la sicurezza sul lavoro e l’educazione pubblica.
Gestione degli animali e biosecurity veterinaria
Il controllo dell’infezione negli uccelli è il cardine della prevenzione umana:
- quarantena: gli uccelli appena acquistati dovrebbero essere isolati per un minimo di 30-45 giorni e testati per C. psittaci;
- igiene ambientale: le gabbie devono essere pulite quotidianamente inumidendo le superfici per evitare la dispersione di polvere. È vietato l’uso di aspirapolvere o idropulitrici che possono generare aerosol infettivi;
- trattamento aviario: gli uccelli infetti devono essere trattati con doxiciclina per 45 giorni sotto supervisione veterinaria.
Normativa italiana e sicurezza sul lavoro
In Italia, il rischio biologico da psittacosi è disciplinato dal D.Lgs. 81/2008 (Allegato XLVI).20 Chlamydia psittaci è classificata come agente biologico di Gruppo 2 per i ceppi aviari e Gruppo 3 per i ceppi non aviari, richiedendo specifiche misure di contenimento nei laboratori e negli ambienti di lavoro.
Le misure obbligatorie per i lavoratori esposti (macelli, cliniche veterinarie, laboratori) includono:
- uso di DPI: guanti, occhiali protettivi, camici monouso e respiratori FFP2 o FFP3;
- informazione e formazione sui rischi zoonotici;
- sorveglianza sanitaria periodica e tenuta dei registri degli esposti.
Ricerca vaccinale: prospettive 2025
Nonostante decenni di ricerca, non è ancora disponibile un vaccino per uso umano. Tuttavia, le innovazioni tecnologiche nel campo dei vaccini a mRNA hanno aperto nuove strade. Studi pubblicati nel 2025 hanno dimostrato che vaccini a mRNA incapsulati in nanoparticelle lipidiche (LNP), codificanti per la proteina MOMP di C. psittaci, sono in grado di indurre una robusta risposta immunitaria umorale e cellulo-mediata in modelli animali, riducendo significativamente la carica batterica polmonare e il danno infiammatorio.21 22 Questi risultati pongono le basi per futuri studi clinici, essenziali per proteggere le popolazioni ad alto rischio professionale.
Fonti:
- Chlamydia psittaci – Wikipedia ↩︎
- Psittacosis – StatPearls – NCBI Bookshelf ↩︎
- Psittacosis Pneumonia: Diagnosis, Treatment and Interhuman Transmission – PMC – NIH ↩︎
- Psittacosis – European region – World Health Organization (WHO) ↩︎
- Lipid nanoparticle-delivered mRNA vaccine encoding the MOMP of Chlamydia psittaci elicits protective immune responses in BALB/c mice – PubMed Central ↩︎
- Chlamydia – Medical Microbiology – NCBI Bookshelf – NIH ↩︎
- Chlamydiae – Malattie infettive – Manuali MSD Edizione Professionisti ↩︎
- Avian Chlamydiosis – Poultry – MSD Veterinary Manual ↩︎
- Chlamydia psittaci: A zoonotic pathogen causing avian chlamydiosis ↩︎
- Persistence Alters the Interaction between Chlamydia trachomatis and Its Host Cell ↩︎
- Chlamydia Persistence: A Survival Strategy to Evade Antimicrobial Effects in-vitro and in-vivo – Frontiers ↩︎
- Psittacosis – Wikipedia ↩︎
- Psittacosis – UF Health ↩︎
- Psittacosis control guideline – NSW Health ↩︎
- Psittacosi: sintomi e cura – My-personaltrainer.it ↩︎
- Psittacosi, 5 morti in Ue: l’alert dell’Oms sulla malattia che arriva dagli uccelli – Sky TG24 ↩︎
- Psittacosis Outbreak in Europe: A Concern for Public Health – PMC – NIH ↩︎
- Laboratory Testing for Psittacosis – CDC ↩︎
- Chlamydia psittaci pneumonia: a clinical analysis of 12 patients ↩︎
- ALLEGATO XLVI ↩︎
- Lipid nanoparticle-delivered mRNA vaccine encoding the MOMP of Chlamydia psittaci elicits protective immune responses in BALB/c mice | Microbiology Spectrum ↩︎
- Lipid nanoparticle-delivered mRNA vaccine encoding the MOMP of Chlamydia psittaci elicits protective immune responses in BALB/c mice – PubMed ↩︎