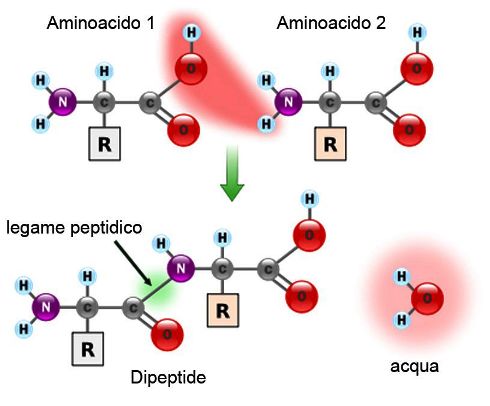
Il legame alla base della costituzione di una proteina è il legame peptidico, un particolare tipo di legame ammidico.
È la reazione che avviene tra il gruppo carbossilico di un aminoacido e il gruppo amminico di un altro amminoacido. Quando queste reazioni si ripetono un numero n di volte otteniamo lo scheletro polipeptidico o la sequenza amminoacidica primaria di una proteina, da cui deriva poi la conformazione nativa della proteina stessa. È una reazione di tipo reversibile e si può tornare allo stato di amminoacidi separati tra di loro. È una condensazione perché la reazione procede tramite la perdita di una molecola di acqua. Il contrario della condensazione è la reazione di idrolisi. Il legame peptidico che si forma può essere rotto tramite l’intervento di una molecola di acqua.
L’equilibrio chimico, in realtà, nelle condizioni termodinamiche standard, ma anche nelle condizioni intracellulari, è sempre spostato verso sinistra, cioè verso la condizione di amminoacidi separati, perciò dal punto di vista termodinamico è una reazione di tipo endoergonico, quindi c’è bisogno di un certo quantitativo di energia perché sia il gruppo carbossilico di un amminoacido che il gruppo amminico dell’altro amminoacido, rappresentano un livello di stabilità chimica abbastanza elevato e non vanno incontro alla reazione di condensazione (di legame) se non in seguito a opportuni cambiamenti chimici, che rappresentano la cosiddetta reazione di attivazione dei substrati, che poi porterà al prodotto.
Lunghezza del legame
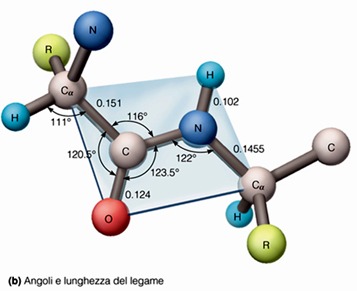
Il legame C-N che si è formato, ha una lunghezza pari a 0.1325 nm. La distanza di legame è una misura della forza del legame e dà un’idea del tipo di interazione che si stabilisce tra i due atomi. All’inizio si presumeva che fosse un semplice legame carbonio-azoto; però andando a registrare la distanza di legame e misurando anche la distanza di un legame semplice carbonio-azoto e di un legame doppio carbonio-azoto, ci si trovava di fronte ad una misura intermedia tra quello semplice che è 0.145 nm e il doppio che è 0.125 nm. Da questa semplice misurazione della distanza di legame, gli scienziati dedussero facilmente che l’interazione interatomica tra il carbonio e l’azoto nella formazione del legame peptidico, in realtà rappresenta una condizione intermedia tra un legame semplice e un legame doppio carbonio-azoto. Il fatto che venga rappresentato in questo modo il legame peptidico, in realtà è sbagliato, perché la giusta rappresentazione del legame è più che altro quella in cui il legame peptidico va incontro ad una serie di forme di delocalizzazione o forme di risonanza, cioè gli elettroni che si trovano confinati tra il carbonio e l’ossigeno, in realtà non sono confinati nello spazio interatomico carbonio-ossigeno, ma possono avere a disposizione anche altri orbitali e quindi quello che fanno per stabilizzare il legame, ovvero abbassare l’energia della molecola, è di distribuirsi anche tra il carbonio e l’azoto. Perciò possiamo avere queste forme di risonanza in cui si sviluppa una parziale carica positiva sull’azoto e una parziale carica negativa sull’ossigeno.
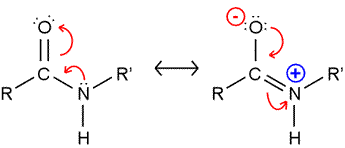
È chiaro che la distribuzione di questi elettroni tra l’ossigeno carbossilico e l’azoto amminico non è perfettamente simmetrica, quindi non è uguale tra l’ossigeno e l’azoto, perché i valori dei due elementi sono diversi: il valore dell’elettronegatività dell’ossigeno è maggiore rispetto a quello dell’azoto e ciò giustifica la presenza di una maggiore densità di carica negativa sull’ossigeno rispetto all’azoto. Si dice quindi che il legame peptidico assume o presenta un parziale carattere di doppio legame. Il fatto che il legame peptidico presenti questo carattere ibrido tra un legame semplice e un legame doppio è fondamentale ai fini della forma che assume la proteina: ha delle importantissime conseguenze sulla struttura complessiva dello scheletro polipeptidico e questo ha un’importante riflesso sulla funzionalità della proteina stessa.
Questo parziale doppio legame implica un elemento di rigidità nello scheletro polipeptidico, perché il doppio legame si forma grazie alla presenza dei cosiddetti orbitali di tipo π (pi greco) in cui si ha una sovrapposizione laterale degli orbitali atomici, al di sopra e al di sotto del piano individuato dai due atomi che si congiungono. Questo comporta una notevole perdita di capacità di movimenti, cioè di rotazione intorno al legame doppio o triplo, dove è ancora più bassa la capacità rotazionale.
Anche il parziale carattere di doppio legame del legame peptidico o ammidico ha queste caratteristiche: c’è una certa difficoltà di rotazione, infatti i legami peptidici sono rigidi e planari. Dalla rigidità scaturisce la planarità: i vari atomi legati insieme, il carbonio e l’azoto, l’ossigeno e l’idrogeno legati rispettivamente al carbonio carbossilico e all’azoto amminico, più i due carboni legati lateralmente, sono tutti planari, quindi giacciono sullo stesso piano. Questa è una diretta conseguenza del parziale carattere del doppio legame del legame peptidico. Lo scheletro di una catena polipeptidica può essere rappresentato come una serie di piani rigidi, separati da gruppi CHR, dove C è il carbonio alfa, H è l’idrogeno legato a questo e R è la catena laterale.
Dobbiamo immaginare la proteina come una sequenza formata dallo stesso alternarsi di piani peptidici con un numero x di amminoacidi, dove il numero di amminoacidi può essere più o meno elevato a seconda della proteina: non ci sono delle misure particolari per le proteine, ma ci sono delle proteine molto piccole che svolgono la propria funzione e hanno una dimensione molecolare molto piccola e delle proteine che hanno una dimensione molecolare enorme. L’unica convenzione che è stata adottata dagli scienziati è quella che riguarda la distinzione tra polipeptide e proteine: ad esempio una catena polipeptidica formata da un numero compreso tra 10 e 50 corrisponde al polipeptide (da 1 a 10 parliamo di oligopeptidi) e da 50 in su si parla di proteine. Però anche genericamente possiamo parlare di peptidi o di oligopeptidi, per quelli più piccoli.
Una convenzione importante che è stata adottata dagli scienziati è quella che stabilisce la direzionalità o polarità di una proteina. Quando si forma il primo legame peptidico tra due amminoacidi, questo si forma tra il gruppo carbossilico del primo amminoacido e il gruppo amminico del secondo amminoacido. La conseguenza della formazione di questo legame peptidico è che il primo amminoacido presenterà il gruppo carbossilico impegnato nel legame e il gruppo amminico libero; il secondo amminoacido invece avrà il gruppo amminico impegnato nel legame e il gruppo carbossilico libero (caso di un dipeptide). Per stabilire in maniera univoca la natura della proteina e assegnare il nome, è stata adottata una convenzione secondo la quale gli amminoacidi vengono numerati (dal numero 1 al numero x) a partire dall’amminoacido N-terminale. Il primo amminoacido della catena polipeptidica corrisponde sempre con l’amminoacido che presenta il gruppo amminico libero, quindi non impegnato in legame e di conseguenza l’ultimo amminoacido sarà l’amminoacido che presenta il gruppo carbossilico libero. Infatti si parla sempre di residuo ammino-terminale e residuo carbossi-terminale, che sono rispettivamente il primo e l’ultimo amminoacido della catena polipeptidica o proteina.
Now loading…
Energia del legame peptidico
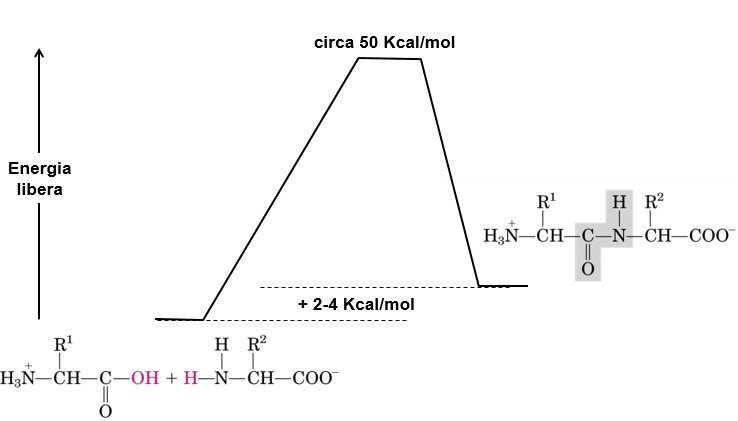
Per quanto riguarda l’aspetto energetico della formazione del legame peptidico, è una reazione endoergonica, quindi ha bisogno di un certo quantitativo di energia. Qui è riportato il profilo energetico della formazione del legame, partendo dai reagenti (due amminoacidi), che si devono legare, e arrivando alla formazione del prodotto (il dipeptide). Abbiamo una barriera energetica rappresentata da 50 kcal/mol, cioè una differenza di energia abbastanza elevata.
Deve necessariamente intervenire il carburante metabolico per eccellenza che è la molecola di ATP. In realtà serve più di una molecola di ATP, perché una singola molecola libera una quantità di energia pari a 30,5 kJ/mol corrispondenti a 7,5 kcal/mol. La differenza di contenuto di energia libera è 2-4 kcal/mol, che è la differenza tra la condizione di amminoacidi separati e del dipeptide.
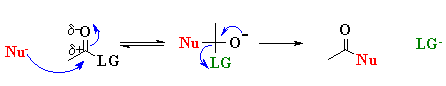
C’è bisogno di energia perché dobbiamo immaginare questa reazione ad una di sostituzione nucleofila acilica. L’energetica di questa reazione è tanto minore quanto migliore è la qualità del gruppo uscente (“LG” sta per Leaving Group). La qualità del gruppo uscente è molto bassa per il gruppo carbossilico, lo ione carbossilato, ecco perché ha bisogno di questo input di energia.
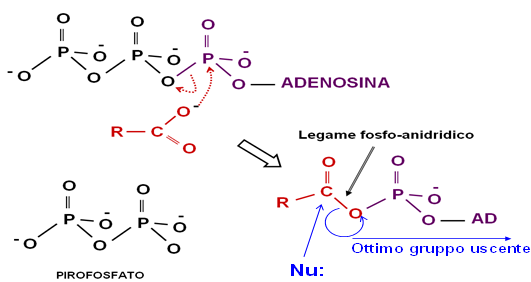
L’amminoacido allora, prima di poter formare il legame peptidico, va incontro a questa reazione di attivazione con una molecola di ATP e si forma un intermedio, l’amminoaciladenilato. Viene attivato tramite l’attacco nucleofilico da parte dell’ossigeno sul fosfato alfa di una molecola di ATP con scissione pirofosforica dell’ATP, per formare un intermedio ad elevato contenuto energetico, l’amminoaciladenilato.
Questo tipo di intervento dell’ATP, che si frammenta in AMP e gruppo pirofosforico, si chiama scissione pirofosforica dell’ATP ed è un tipo di reazione che interviene non molto spesso nelle reazioni biologiche, soprattutto in quelle che hanno bisogno di un notevole input energetico. Un altro esempio di scissione pirofosforica dell’ATP è quello che avviene nella degradazione degli acidi grassi nella cellula: la tappa enzimatica che viene prima della β-ossidazione è una tappa del tutto simile a questa, cioè l’attacco nucleofilico da parte dell’ossigeno del gruppo carbossilico dell’acido grasso sul fosforo di tipo alfa con formazione di un intermedio ad alto contenuto energetico che è l’aciladenilato.
Avviene tutto ciò perché dobbiamo attaccare al gruppo carbossilico dell’amminoacido un gruppo, l’AMP, che è un ottimo gruppo uscente, in maniera tale che la reazione di rottura di questo gruppo, con formazione conseguente del legame peptidico, sia una reazione molto spostata verso destra.
Isomeria Cis e Trans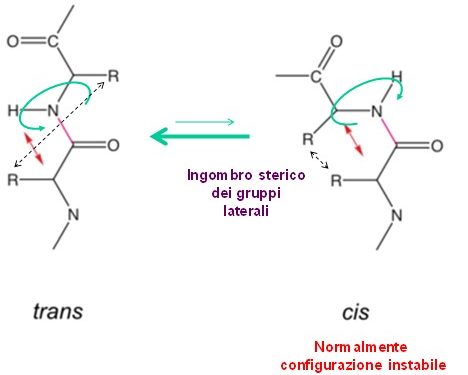
Per quanto riguarda l’isomeria cis e trans del legame polipeptidico, è favorita dal punto di vista termodinamico la forma trans del legame peptidico; trans significa che l’ossigeno del carbonio carbossilico e l’idrogeno legato all’azoto amminico si trovano in posizioni differenti cioè da una parte e dall’altra rispetto al piano individuato dal parziale doppio legame, e questo è chiaramente dettato dal fatto che nella posizione cis c’è un enorme ingombro sterico che destabilizza la struttura e quindi non è termodinamicamente favorita se non in percentuali molto basse. Quindi abbiamo una Keq tra la forma cis e quella trans pari a 0.001 il che vuol dire che l’equilibrio forma trans forma cis è completamente spostato verso la forma trans.
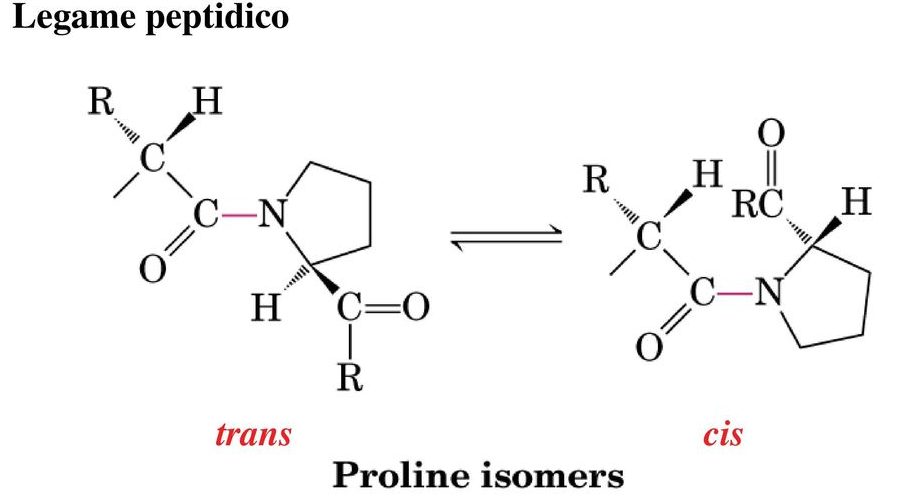
Un caso particolare è rappresentato dalla prolina, che si comporta in maniera diversa rispetto agli altri amminoacidi perché è caratterizzata da una catena laterale che si lega sia al carbonio α che all’azoto amminico, quindi una struttura ciclica che introduce nello scheletro polipeptidico un elemento di rigidità e che si ripercuote anche sull’equilibrio forma cis/trans. In questo caso la Keq ha un valore molto più alto il che vuol dire che la forma cis è molto più stabile perché nella forma trans c’è un ingombro sterico dovuto alla particolare struttura dell’amminoacido.