Fonte: Fisica biomedica.
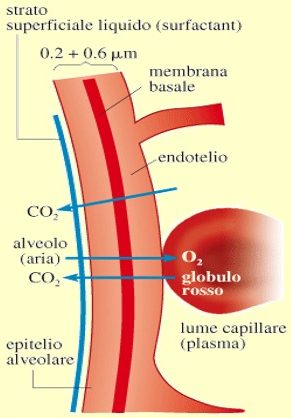
La diffusione di gas attraverso membrane biologiche, è il processo fisico alla base della respirazione. In questo processo si ha il rifornimento di O2 che viene utilizzato nei processi metabolici cellulari e l’eliminazione della CO2 da essi prodotta nelle cellule. L’aria che entra nei polmoni è distribuita negli alveoli tramite condotti molto ramificati collegati con l’esterno.
I polmoni umani contengono circa 0.6 miliardi di alveoli, piccoli involucri sferoidali del diametro di circa 150-250 μm. L’aria nell’alveoli è una miscela di N2, O2, CO2 e vapor d’H2O oltre a tracce trascurabili di altri gas contenuti nell’aria che si respira.
L’O2 diffonde dall’interno dell’alveolo, attraverso la membrana alveolare fino a penetrare nei capillari del sangue che circondano l’alveolo.
Attraversata la parete capillare, le molecole di O2 diffondono nel plasma e poi, attraverso la membrana cellulare dei globuli rossi, sono catturate dall’emoglobina a cui si legano chimicamente. In seguito, l’O2 viene trasportato dai globuli rossi attraverso il sistema circolatorio fino alla rete di capillari che pervade i tessuti, dove l’emoglobina rilascia O2 che diffonde attraverso le pareti dei capillari nel liquido interstiziale.
Infine, l’O2 arriva alle cellule attraverso la membrana cellulare, dove è utilizzato nei processi metabolici che producono CO2. La CO2 ripercorre il percorso dell’O2 in senso inverso. La diffusione di queste 2 molecole, O2 e CO2 è schematizzata nella figura in basso.
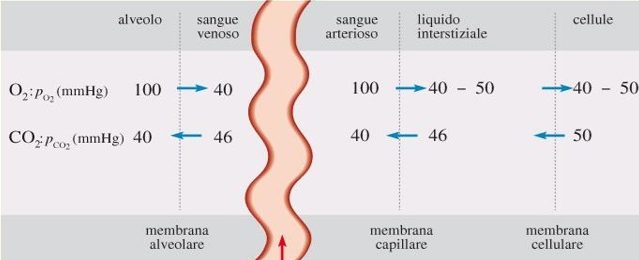
Trasporto nel sangue di O2 e CO2 attraverso membrane
Fonte: Fisica biomedica.
Le pressioni parziali sono calcolate avendo prima sottratto la tensione di vapore dell’acqua e poi ripartendola percentualmente tra i restanti gas, dato che questi possono essere trattati come gas perfetti.
Questa catena di processi diffusivi raggiunge, a regime, un equilibrio dinamico in ognuna delle fasi.
Negli alveoli, la composizione dell’aria è quasi costante e le pressioni parziali di O2 e CO2 sono tali da favorire la rimozione della CO2 ed il rifornimento di O2.
La diffusione dei gas attraverso la membrana alveolare è dovuta alla differenza di pressione parziale che esiste fra i gas nell’alveolo e quelli nel sangue. Lo stesso meccanismo agisce tra sangue nei capillari e liquido interstiziale attraverso la membrana capillare.
Diffusione dell’ossigeno
Per valutare l’efficacia della sola diffusione dell’ossigeno nel sangue venoso (ossigenazione), si applica la legge di Henry, per cui il volume di O2 (VO2) che si scioglie in 100 ml di sangue venoso, essendo la pressione parziale dell’O2 pO2 = 99,8 mmHg e supponendo il sangue costituito essenzialmente da H2O, è:

Dove s = 2,3 (cm3/atm) è il coefficiente di solubilità di O2 in H2O alla p = 1 atm. Quindi, per la legge di Henry in 1 litro di sangue si scioglie un volume di 3 cm3 di O2.
Se adesso confrontiamo questo valore con le necessità di O2 dell’organismo sapendo che la minima quantità di energia necessaria a mantenere le sole funzioni vitali dell’organismo (metabolismo basale) è per un soggetto adulto di circa 50 kcal/h m2 e che la superficie corporea media in tale soggetto è circa 2 m2, mentre il calore Q di combustione sviluppato da 1 litro di O2 in condizioni NTP (0 °C e 1 atm) è nei processi metabolici di circa 4,825 kcal, per ottenere 50 kcal/h m2 una persona deve utilizzare un volume di O2:
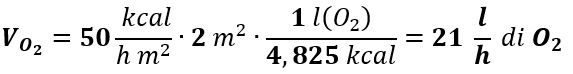
Passando da NTP a 37 °C, essendo la pressione costante, possiamo applicare la legge di Gay–Lussac:
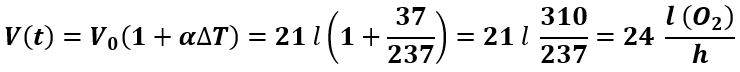
Questa è la minima quantità di O2 che deve pervenire ai tessuti.
Poiché la quantità di sangue arterioso immessa in circolo dal ventricolo sinistro, in ogni contrazione è circa 60 cm3 e la frequenza cardiaca è quasi 1 Hz, il sangue ossigenato in circolo in 1 h è:
6⋅10−2 m3 ⋅ 1 −1 ⋅ 3600 s/h = 216 l/h
Il contenuto di O2 in 216 l/h di sangue è:
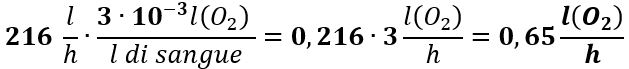
Questa quantità di O2 è di gran lunga inferiore a 24 l/h richiesti dal metabolismo basale. Quindi, il semplice processo fisico della diffusione non è sufficiente a fornire O2 per le minime necessità vitali dell’organismo umano.
La soluzione a questo problema è di tipo biochimico, infatti, la maggior parte delle molecole di O2 si legano alle molecole di emoglobina contenuta nei globuli rossi, che ne consentono il trasporto ed il rilascio ai tessuti biologici in grandi quantità. Quindi l’O2 che si lega all’emoglobina è maggiore dei 3 cm3 sciolti in 1 litro di sangue forniti dal processo di diffusione.
Ossigeno trasportato dall’emoglobina
Il volume di O2 trasportato dall’emoglobina in 1 h, considerando che 1 gr di emoglobina trattiene un massimo di 1,34 ml di O2 quando è satura e che normalmente il sangue contiene circa 15 gr di emoglobina ogni 100 ml di sangue, è: 1,34 ml/gr ⋅ 15 gr = ml di O2 in 100 ml di sangue (cioè 200 ml di O2 in 1 l di sangue). Ai tessuti giungono in 1 h circa 216 l di sangue ossigenato. Il contenuto di O2 legato alle molecole di emoglobina (che contiene un massimo di 4 molecole di O2) risulta:
216 l/h · 200 ml(O2)/l = 43200 ml/h = 43.2 l/h
Il metabolismo basale richiede un minimo di 24 l/h di O2, quindi l’approvvigionamento di O2 ai tessuti è più che sufficiente.
Diffusione dell’Azoto
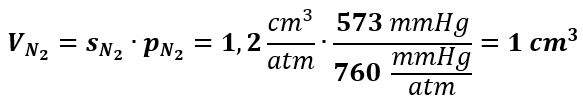
L’N2 non partecipa ai processi biologici importanti e diffonde nel corpo umano così come previsto dalla legge di Henry. A 37 °C nell’alveolo, pN2 = 573 mmHg e il coefficiente di solubilità s dell’N2 in acqua è: sN2 = 1,2 cm3/atm (per 100 ml di H2O) e la quantità di N2 disciolto nei tessuti per ogni 100 ml di H2O risulta:
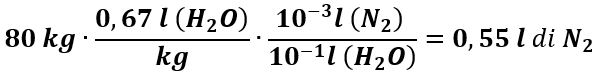
Se un adulto ha una massa m = 80 kg e contiene circa 67% di H2O, il VN2 disciolto diventa:
Questo risultato vale per la pressione esterna dell’aria di 1 atm. Se la pressione dell’aria inspirata cresce, come nel caso di immersioni subacquee, a causa della pressione idrostatica, il volume di N2 disciolto nel sangue e nei tessuti aumenta secondo la legge di Henry: VN2 = sN2 · pN2
Se la pressione esterna torna rapidamente ad 1 atm (emersione rapida), la quantità in eccesso di N2 in soluzione si libera e poiché il processo di eliminazione attraverso la diffusione alveolare è lento, si formano bolle gassose di N2 nel sangue e nei tessuti, con il rischio di embolia gassosa.
Infine, nelle immersioni, se la pressione parziale di N2 supera 4 atm (40 m di profondità), la grande quantità di N2 disciolta nell’organismo (circa 2 l) provoca effetti anestetici (narcosi da N2) dovuta all’azione esercitata sulle cellule nervose.
Fonte: Fisica biomedica.