Il carcinoma ovarico è un tumore in forte incremento. La sua incidenza si colloca al settimo posto tra i tumori del sesso femminile ed è gravata dall’elevata mortalità per via della diagnosi in stadio avanzato. Ogni anno circa 16.000 donne muoiono per cancro ovarico.
PREDISPOSIZIONE GENETICA E SINDROMI EREDITARIE
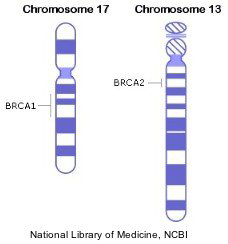
Donne con mutazioni localizzate nel gene BRCA1 o BRCA2 sul cromosoma 17 e 13 hanno un incremento di rischio di 5 volte di sviluppare cancro mammario e un incremento da 10 a 30 volte di sviluppare un cancro ovarico rispetto alla popolazione normale.
Il rischio di cancro mammario ed ovarico è maggiore per le mutazioni del gene BRCA1 rispetto a quelle del BRCA2.
Le mutazioni vengono ereditate con modalità autosomica-dominante, pertanto si trasmettono al 50% dei figli.
Diverse sindromi possono portare alla predisposizone del carcinoma ovarico. Tra di queste abbiamo:
- HBOCS (Hereditary Breast Ovarian Cancer Syndrome). È l’acronimo che indica la correlazione ereditaria tra cancro alla mammella e cancro ovarico. Per poter diagnosticare tale sindrome è necessario, prima di ricorrere ai test genetici, avere una delle seguenti condizioni: cancro mammario prima dei 50 anni, cancro ovarico in qualsiasi età, cancro della mammella maschile, parentela Ashkenazi Jewish e storia personale e familiare di cancro della mammella o dell’ovaio, due cancri mammari nella stessa persona o nello stesso lato familiare ed infine mutazioni di BRCA1 o BRCA2 precedentemente identificate in famiglia.
Tutte queste condizioni possono far ipotizzare ad una sindrome ereditaria. - Sindrome di Lynch. È una sindrome dovuta a mutazioni dei geni del mismatch repair (MLH1, MSH2, MSH6, PMS2, o EPCAM). Solitamente nei soggetti con sindrome di Lynch si palesa un incremento di rischio del cancro del colon ed anche la sindrome del carcinoma colon-rettale non poliposo (HNPCC). Tuttavia essi hanno un incremento di rischio anche per il cancro dell’utero, ovaio, rene, stomaco, vescica.
Le donne con sindrome di Lynch hanno un rischio del 60% di sviluppare cancro dell’endometrio e un rischio superiore al 24% di sviluppare cancro ovarico nel corso della vita. L’ovaio è coinvolto nella sindrome di Lynch-2: carcinoma colon non poliposici, carcinoma dell’endometrio, carcinoma mammario, carcinoma ovarico. - Sindrome di Cowden. Sindrome caratterizzata dalla mutazione di PTEN, un oncosoppressore, per cui si palesano tumori ovarici e tumori cerebrali.
- Sindrome di Gorlin Goltz. Sindrome causata dalla mutazione di PTCH per cui si osservano tumori odontogeni cheratocistici, epiteliomi basocellulari multipli, malformazioni scheletriche, tumori cerebellari, tumori ovarici (fibroma).
DISTRIBUZIONE PER ETÀ E POSSIBILITÀ DI SCREENING
La maggior parte dei tumori ovarici sono benigni (80%) e si riscontrano al di sotto dei 45 anni di età, invece i tumori borderline e maligni si riscontrano in genere al di sopra dei 45 anni.
La sintomatologia è silente o tardiva e la diagnosi avviene in stadi avanzati ed è sempre necessario un riscontro diagnostico ecografico.
Anche in casi apparentemente precoci (clinica) vi è già carcinosi peritoneale microscopica, quindi si ricorre ad alcuni test di screening per ricercare eventuali tumori. Si hanno tre possibilità:
- Screening Genetico;
- Screening Ecografico + Ca-125;
- Screening OVALife Test.
Il CA-125 è una glicoproteina ad alto peso molecolare presente nel siero di più dell’80% delle donne con carcinoma sieroso o endometrioide dell’ovaio. Viene utilizzata come marker tumorale per la diagnosi e la prognosi di alcuni tipi di cancro. L’intervallo di riferimento per il CA-125 va da 0 a 35 unità/ml. L’esame del CA-125 non è in grado, da solo, di consentire una diagnosi; nei casi di tumore solo la biopsia del tessuto colpito può confermare l’eventuale diagnosi. Tuttavia questo marker è molto utile nel follow-up oncologico.
L’OVALife test consiste invece nel dosaggio di sei biomarcatori: leptina, prolattina, osteopontina, insulin-like growth factor II (IGF-II), macrophage inhibitory factor (MIF) e CA-125. Questo tipo di test ha una sensibilità del 95,3% ed una specificità del 99,4% per il carcinoma ovarico che è molto superiore rispetto a quella del CA-125 da solo.
CLINICA
Negli stadi iniziali, in gran parte dei casi, risulta asintomatico, quasi tutti i sintomi sono correlati agli stadi III e IV del tumore.
I sintomi sono: senso di tensione pelvica, dolore basso addome, ingrandimento dell’addome, ascite. A questi si aggiungono i sintomi generali: poliuria, astenia, perdita di peso e cachessia.
Come tumore, tende a diffondere al peritoneo e ai linfonodi regionali.
Le metastasi gastrointestinali e pelviche sono dovute a diffusione peritoneale ab estrinseco in specie all’intestino tenue, fistole digestive ileo-ileali, ileo-vaginali; le metastasi epatiche sono invece dovute ad adsorbimento di fluido peritoneale (non ematiche) per via della diffusione intracelomatica (peritoneale).
CLASSIFICAZIONE CLINICA
Per la classificazione clinica vengono utilizzate principalmente indagini strumentali, tra queste è previsto l’utilizzo della TC per la stadiazione del carcinoma ovarico. La PET può identificare metastasi polmonari, ossee o cerebrali che devono essere considerate per la diagnosi. La MR è eccellente per studiare la presenza di metastasi annessiali. La PET/CT è utile per la valutazione di metastasi a distanza, ma non per la diagnosi.
È necessaria la conferma istologica di ovaio, tuba di Falloppio, e malattia peritoneale (laparotomia o laparoscopia). Le biopsie comprendono siti come l’omento, il mesentere, il diaframma, il peritoneo, i linfonodi pelvici e para-aortici.
In base ai risultati sia di indagini bioptiche che indagini strumentali possiamo stabilire la stadiazione del tumore primitivo (T) localizzato ad una o entrambe le ovaie.
- T1: Il tumore è limitato alle ovaie -> Risonanza magnetica (MR) e Ultrasuoni;
- T2: il tumore è confinato alla pelvi -> CT con mezzo di contrasto;
- T3a/b: coinvolgimento dei linfonodi retroperitoneali -> PET/CT;
- T3c: coinvolgimento della superficie splenica e epatica senza metastasi parenchimali -> CT con mezzo di contrasto.
Il criterio utilizzato per identificare metastasi linfonodali (N) è l’analisi delle dimensioni (>1 cm) tramite CT e/o MR. La PET/CT evidenziando l’attività metabolica nei linfonodi ha una specificità maggiore rispetto alla CT/MR nell’identificazione di metastasi.
Le metastasi a distanza (M) per via ematica si osservano come disseminazione tumorale in sedi extraperitoneali: parenchima epatico, parenchima splenico, parenchima polmonare, linfonodi ascellari, inguinali e sopraclavicolari in quanto le disseminazioni peritoneali avvengono per via intracelomatica.
Il sistema di stadiazione FIGO riflette la modalità di diffusione dei tumori ovarici maligni agli organi pelvici adiacenti ed al peritoneo e la modalità di metastatizzazione ai linfonodi pelvici attraverso i linfatici del ligamento largo, ed ai linfonodi paraaorto-cavali attraverso i linfatici del ligamento sospensorio dell’ovaio. Nei tumori ovarici maligni, soprattutto in quelli epiteliali, deve essere definito il grado di differenziazione (ben differenziati, mediamente differenziati, poco differenziati), poiché questo parametro si correla con la prognosi e, talora, con la terapia. Lo stroma delle neoplasie ovariche primitive o metastatiche deve essere valutato con attenzione in quanto può luteinizzarsi e causare manifestazioni cliniche di iperandrogenismo o iperestrogenismo.
- il tumore è limitato all’ovaio (1 o 2)
- IA: 1 ovaio, capsula intatta, assenza tumore sulla superficie ovarica e di cellule maligne nel lavaggio peritoneale;
- IB: 2 ovaie, capsula integra, assenza tumore sulla superficie ovarica e di cellule maligne nel lavaggio peritoneale;
- IC: 1 o 2 ovaie con una delle seguenti condizioni: rottura capsula, presenza di tumore sulla superficie ovarica, presenza di cellule maligne nell’ascite o nel lavaggio peritoneale.
- il tumore colpisce 1 o 2 ovaie con estensione pelvica
- IIA: estensione e/o metastasi all’utero e/o tube, assenza di cellule maligne nell’ascite o nel lavaggio peritoneale;
- IIB: estensione ad altri organi e tessuti pelvici, assenza di cellule maligne nell’ascite o nel lavaggio peritoneale;
- IIC: IIA o IIB + cellule maligne nell’ascite o nel lavaggio peritoneale.
- il tumore colpisce 1 o 2 ovaie, si hanno metastasi peritoneali, extraperitoneali pelviche e/o con metastasi ai linfonodi regionali
- IIIA: micrometastasi peritoneo extrapelvico;
- IIIB: metastasi < 2 cm nel peritoneo extrapelvico;
- IIIC: metastasi > 2 cm nel peritoneo extrapelvico e/o metastasi nei linfonodi regionali;
- si hanno metastasi a distanza (es. epatiche), con citologia positiva per lo stadio IV.
STADIAZIONE PATOLOGICA
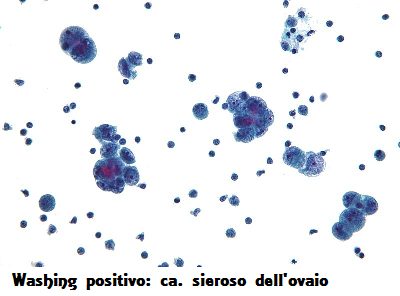
Per la stadiazione patologica si usano i seguenti metodi citologici: citologia del lavaggio peritoneale, citologia del liquido ascitico mentre i metodi istologici si usano in seguito a interventi aggressivi laparoscopici o in seguito ad interventi di chirurgia citoriduttiva.
La citologia peritoneale nella stadiazione patologica del carcinoma ovarico è importante. La presenza di cellule maligne positive nel liquido ascitico o nel lavaggio peritoneale segna il passaggio allo stadio IC per i tumori T1 ed allo stadio IIC per i tumori T2 secondo la stadiazione FIGO. Tale metodo viene applicato durante la stadiazione chirurgica intensiva ed aumenta notevolmente l’accuratezza della stadiazione.
La stadiazione chirurgica aggressiva laparoscopica si applica quando si è dinanzi a stadi apparentemente iniziali.
Si effettua ovarosalpigectomia e omentectomia infracolica. In caso di noduli non evidenti si effettuano biopsie multiple nelle sedi frequenti (docce paracoliche, peritoneo prevescicale, Douglas, emidiaframma destro, radice del mesentere). Altri interventi sono appendicectomia e biopsie dei linfonodi pelvici.
Studi recenti dimostrano peggioramento della prognosi quando applicato questo metodo.
La chirurgia citoriduttiva (debulking) si applica quando si è dinanzi a stadi avanzati e si effettua un’isterectomia totale con annessiectomia bilaterale, omentectomia totale, appendicectomia, asportazione dei linfonodi pelvici ed aortici solo se aumentati di volume, asportazione di tutta la malattia macroscopicamente visibile.
La citoriduzione ottimale costituisce il fattore che influenza maggiormente la prognosi.
L’introduzione di procedure chirurgiche aggiuntive alla chirurgia standard ha aumentato in maniera significativa non solo il tempo libero da recidiva nelle pazienti ottimamente citoridotte, ma anche la sopravvivenza globale.
Il significato prognostico della chirurgia primaria di debulking può essere spiegato sulla base delle seguenti argomentazioni:
- è possibile che tramite la chirurgia vengano rimossi i cloni delle cellule fenotipicamente resistenti ai farmaci, diminuendo così la comparsa precoce della chemio resistenza;
- i santuari farmacologici vengono eliminati con la rimozione di grosse masse tumorali scarsamente perfuse, aumentando verosimilmente la perfusione dei chemioterapici alle cellule residue;
- la più elevata frazione di crescita che caratterizza le piccole masse tumorali residue, meglio perfuse, favorisce un’aumentata distruzione cellulare da parte dei chemioterapici;
- masse più piccole richiedono verosimilmente un minor numero di cicli di chemioterapia cosicché minori sono le probabilità di indurre farmacoresistenza;
- l’asportazione della malattia bulky migliora le capacità immunologiche attraverso la riduzione dell’immunosoppressione neoplastica;
- migliora la sintomatologia clinica spesso imponente.
La riduzione dell’ascite e la rimozione di voluminose masse neoplastiche determinanti fenomeni compressivi a carico del distretto enterocolico, comporta inoltre un immediato beneficio (anche psicologico) per la paziente.
FATTORI PROGNOSTICI
I fattori presi in considerazione sono la stadiazione FIGO, grado e tipo istologico, malattia residua, marker tumorale Ca-125, residuo tumorale macroscopico dopo intervento di citoriduzione, volume del residuo tumorale dopo intervento di citoriduzione:
- Grado istologico: I pazienti con tumori ovarici invasivi di basso grado (ben differenziati) hanno una prognosi migliore rispetto a pazienti con tumore ovarico invasivo di alto grado (poco o non differenziato) allo stesso stadio.
- Tipo istologico: Alcuni tumori stromali (tumore a cellule della granulosa e a cellule di sertoli-leydig) hanno una prognosi eccellente, mentre i tumori epiteliali maligni hanno in genere una prognosi meno favorevole.
In alcuni casi è possibile la presenza di un carcinoma ovarico sieroso di alto grado (HGSC) in associazione con un carcinoma sieroso intraepiteliale di alto grado nelle tube di Falloppio (STIC), tale associazione può essere spiegata a causa di un’estensione di STIC alle ovaie, oppure di un carcinoma ovarico HGSC che si estende alle tube di falloppio. Altre volte si può avere coinvolgimento sincrono o metacrono di ovaie e tube. - Malattia residua: Negli stadi avanzati di malattia, un buon fattore prognostico è la presenza o meno di malattia residua in seguito ad un intervento chirurgico di rimozione. Ai fini prognostici risultano importanti anche: le dimensioni del residuo tumorale e il numero di siti di residui tumorali.
- Marker tumorali: Il marker tumorale CA125 (cancer antigen 125) viene utilizzato per valutare la risposta alla terapia in pazienti con carcinoma epiteliale maligno. Il tasso di riduzione di questo marker durante la chemioterapia assume un significato prognostico importante. In caso di tumori a cellule germinali assumono un ruolo importante anche altri marker tumorali come: α-fetoproteina e gonadotropina corionica umana (hCG).
- Residuo tumorale macroscopico dopo intervento di citoriduzione: La prognosi migliore si ha in caso di assenza di residui tumorali al termine dell’intervento. In caso di residui tumorali il medico dovrà riportarne le dimensioni, e il numero in quanto questi aspetti influiscono in maniera significativa sulla prognosi.
- Volume del residuo tumorale: Il parametro per definire positivo l’esito di un intervento di citoriduzione, è il rilevamento di un volume di residuo tumorale < 1 cm.
Classificazione delle neoplasie ovariche
Per vedere la classificazione delle neoplasie ovariche vai qui.
Fonte: Anatomia patologica e correlazioni anatomo-cliniche (Mariuzzi).







