Clostridioides difficile (precedentemente noto come Clostridium difficile) è un batterio gram-positivo, anaerobio obbligato e sporigeno. Rappresenta la causa più comune di diarrea associata all’uso di antibiotici, in particolare in ambito ospedaliero e nelle strutture di lungodegenza.
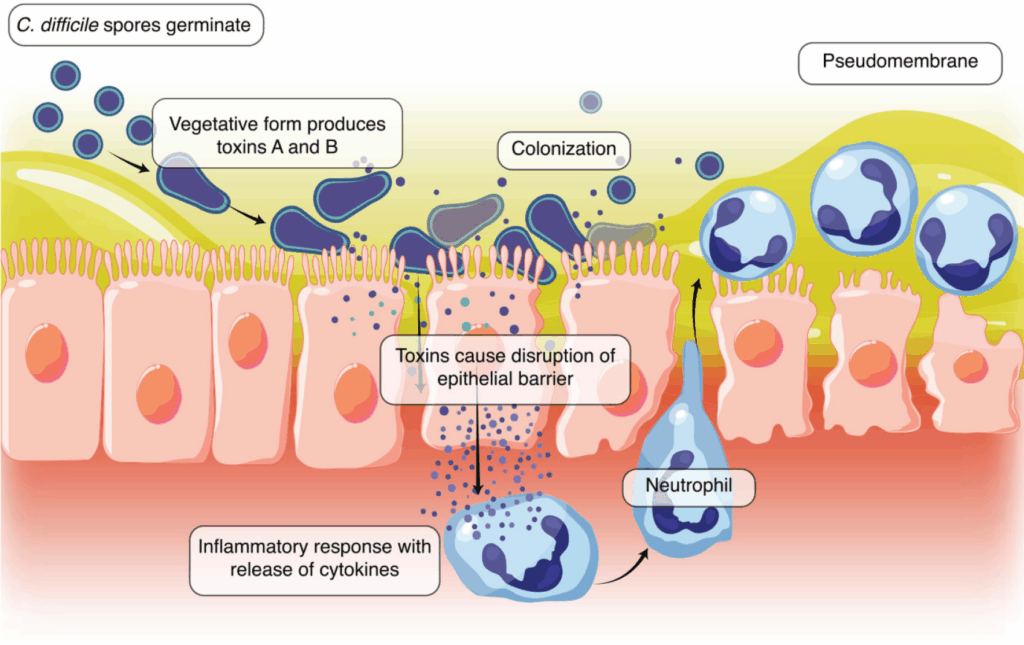
Al di fuori del corpo umano, il microrganismo sopravvive sotto forma di spora. Le spore sono altamente resistenti e possono persistere per settimane o mesi su superfici ambientali, strumenti medici e indumenti. Una volta ingerite, raggiungono il colon, dove, in condizioni favorevoli (come la riduzione del microbiota intestinale protettivo) si trasformano in forme vegetative attive. Queste forme sono in grado di moltiplicarsi e produrre tossine che causano la malattia.
Le due principali tossine prodotte sono la tossina A (enterotossina) e la tossina B (citotossina). Queste esotossine esercitano la loro azione patogena attraverso l’inattivazione delle proteine Rho, una famiglia di GTPasi fondamentali per la struttura del citoscheletro cellulare. Il risultato è la perdita dell’integrità epiteliale, l’apoptosi delle cellule intestinali, alterazioni nella secrezione e una marcata infiltrazione di polimorfonucleati nella mucosa.
La tossina A è particolarmente attiva nell’indurre infiammazione locale, stimolando direttamente i neutrofili e provocando essudazione e lesioni mucosali. La tossina B ha un effetto citotossico diretto più marcato e, in sinergia con la tossina A, potenzia la chemiotassi dei neutrofili e il danno tissutale.
Va sottolineato che non tutti i ceppi di C. difficile sono patogeni: si stima che circa il 10-30% siano non tossigeni e possano colonizzare l’intestino umano in modo asintomatico.
Epidemiologia e fattori di rischio
L’infezione da C. difficile si trasmette principalmente per via oro-fecale. Le spore possono essere ingerite accidentalmente tramite il contatto con superfici contaminate, mani non adeguatamente igienizzate o strumenti medici non correttamente disinfettati. Gli ambienti ospedalieri e le strutture sanitarie rappresentano i luoghi a maggior rischio di diffusione, a causa dell’elevata circolazione di pazienti fragili e della presenza continua di antibiotici che alterano il microbiota intestinale.
Una volta ingerite, le spore trovano un terreno fertile per la colonizzazione intestinale quando l’ecosistema batterico locale è stato compromesso, tipicamente a seguito di una recente terapia antibiotica. La distruzione della flora commensale consente a C. difficile di moltiplicarsi e produrre tossine.
Come già detto, il principale fattore di rischio per lo sviluppo dell’infezione è rappresentato dall’uso recente di antibiotici. Alcuni antibiotici sono particolarmente coinvolti, tra cui i fluorochinoloni, la clindamicina, le penicilline ad ampio spettro (come piperacillina/tazobactam) e le cefalosporine di seconda, terza e quarta generazione. Questi farmaci tendono ad alterare profondamente il microbiota intestinale, favorendo la colonizzazione da parte di ceppi patogeni di C. difficile.
Oltre all’antibioticoterapia, altri fattori contribuiscono ad aumentare il rischio di infezione:
- l’età avanzata, soprattutto oltre i 65 anni, rappresenta una condizione predisponente importante;
- l’ospedalizzazione recente e il ricovero prolungato;
- la presenza di comorbidità gravi (come insufficienza renale cronica, neoplasie o immunosoppressione);
- l’uso di dispositivi invasivi;
- l’utilizzo di farmaci che riducono l’acidità gastrica, come gli inibitori di pompa protonica (IPP) e gli antagonisti dei recettori H₂. La diminuzione della barriera acida dello stomaco può favorire il passaggio e l’attivazione delle spore nel tratto gastrointestinale.
Caricamento...
Manifestazioni cliniche
L’infezione da C. difficile presenta un ampio spettro di gravità, che va dalla diarrea lieve fino alla colite fulminante. Nelle forme non gravi, i pazienti manifestano diarrea acquosa (almeno 3 scariche in 24 ore), dolore addominale crampiforme, localizzato di solito ai quadranti inferiori, febbre lieve e leucocitosi neutrofila. Secondo il parere degli esperti, la forma non grave è caratterizzata da una conta leucocitaria <15.000/µL e da livelli di creatinina <1,5 mg/dL.
La malattia grave si manifesta con sintomi più severi: oltre alla diarrea e al dolore addominale, si possono osservare febbre elevata, segni di disidratazione (ipovolemia), acidosi lattica, ipoalbuminemia e leucocitosi marcata. In questi casi, la conta leucocitaria supera i 15.000/µL e/o i livelli di creatinina sierica sono ≥1,5 mg/dL. Tali parametri riflettono un coinvolgimento sistemico e un rischio aumentato di complicanze.
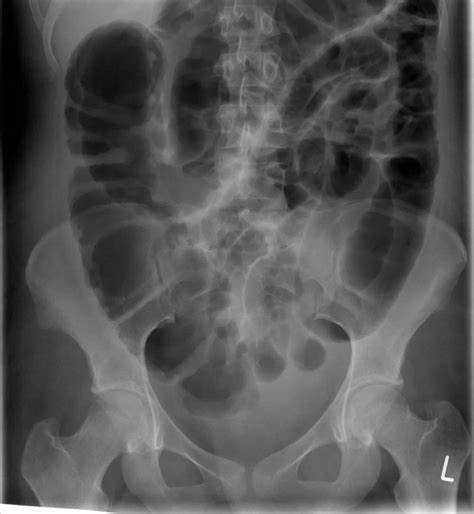
La forma più severa, la colite fulminante, si presenta con ipotensione o shock settico, ileo paralitico e megacolon tossico. Il sospetto di megacolon deve sorgere in presenza di segni sistemici gravi e di evidenza radiologica, come la dilatazione del colon (diametro >7 cm) o del cieco (>12 cm) alla TC. Questa complicanza richiede una rapida valutazione chirurgica, poiché può evolvere verso la perforazione intestinale e mettere a rischio la vita del paziente.
Un’ulteriore complicazione è la recidiva dell’infezione, definita come la ricomparsa dei sintomi entro 2-8 settimane dalla fine del trattamento. Le recidive possono avere una presentazione simile o più grave rispetto all’episodio iniziale, e rappresentano una sfida clinica significativa per la gestione a lungo termine dei pazienti.
Diagnosi
La diagnosi di infezione da C. difficile si basa sull’identificazione della tossina o del materiale genetico del batterio nelle feci, in presenza di un quadro clinico compatibile (tipicamente diarrea).
Il test più utilizzato è il dosaggio delle tossine A e B mediante immunoenzimatico (EIA). Questo esame è rapido, poco costoso e dotato di buona specificità, ma ha una sensibilità limitata, con un certo rischio di falsi negativi.
Per aumentare l’accuratezza diagnostica, si ricorre spesso a test molecolari, come il NAAT (nucleic acid amplification test), che identifica direttamente i geni delle tossine (in particolare tcdB per la tossina B). Tuttavia, questi test rilevano anche i portatori asintomatici, in quanto non distinguono tra presenza del gene e produzione attiva di tossina.
Per questo motivo, molti laboratori adottano un approccio a più stadi. Il primo passo consiste nello screening con un EIA per la glutammato deidrogenasi (GDH), un enzima prodotto da tutti i ceppi di C. difficile (tossigeni e non). Un risultato positivo richiede un test di conferma, che può essere il dosaggio della tossina o il NAAT.
La colonscopia non è indicata di routine in presenza di sintomi suggestivi e test di laboratorio positivi, né se il paziente risponde bene al trattamento empirico. Tuttavia, può essere utile in caso di sospetta diagnosi alternativa o se è necessario effettuare biopsie per escludere altre patologie (come IBD o ischemia intestinale). La presenza di pseudomembrane, visibili come placche bianco-giallastre fino a 2 cm, è altamente suggestiva per C. difficile, ma non sempre presente, soprattutto nelle forme lievi o già in trattamento.
Terapia
La terapia antibiotica rappresenta il cardine del trattamento dell’infezione da C. difficile. I due farmaci di riferimento sono vancomicina e fidaxomicina, entrambi somministrati per via orale. Il metronidazolo, in passato usato come prima linea, è oggi riservato a casi selezionati, in cui le altre opzioni non siano disponibili.
Nei pazienti con forme lievi o moderate, il trattamento di prima scelta è rappresentato dalla vancomicina orale, alla dose di 125 mg ogni 6 ore per 10 giorni. In alternativa, può essere somministrata fidaxomicina orale, 200 mg ogni 12 ore. Solo in assenza di entrambe queste opzioni, può essere utilizzato il metronidazolo orale, 500 mg ogni 8 ore. Anche in questo caso, la durata standard del trattamento è di 10 giorni.
Secondo le più recenti linee guida dell’IDSA (Infectious Diseases Society of America) del 2021, la prima scelta nelle forme gravi è rappresentata dalla fidaxomicina orale (200 mg ogni 12 ore per 10 giorni), eventualmente prolungabile in base alla risposta clinica. La vancomicina orale rappresenta la seconda opzione terapeutica.
La colite fulminante richiede un approccio più aggressivo. È raccomandata la vancomicina ad alto dosaggio (500 mg ogni 6 ore) somministrata per via enterale (per os o tramite sondino nasogastrico), associata a metronidazolo endovenoso (500 mg ogni 8 ore). In questi casi, è spesso necessaria una valutazione chirurgica urgente per eventuale colectomia, soprattutto in presenza di megacolon tossico o perforazione intestinale.
Infezione ricorrente o recidivante
In caso di prima o seconda recidiva dopo un trattamento iniziale con vancomicina, si raccomanda la somministrazione di fidaxomicina, con due possibili schemi: a dosaggio fisso per 10 giorni oppure a dosaggio decrescente per 20 giorni. Nei pazienti che sviluppano una recidiva entro 6 mesi dalla precedente, può essere utile la somministrazione di bezlotoxumab, un anticorpo monoclonale umanizzato diretto contro la tossina B del C. difficile, in aggiunta al trattamento antibiotico.
L’uso della vancomicina a scalare, per una durata complessiva di circa 1-5-3 settimane (cioè, riducendo progressivamente la frequenza delle dosi), è oggi considerato un’opzione di seconda linea nelle recidive.
Nei pazienti con almeno tre recidive, il trapianto di microbiota fecale rappresenta la strategia più efficace, qualora disponibile. Questo trattamento si basa sulla somministrazione di materiale fecale da donatore sano per ripristinare la flora intestinale e prevenire nuove recidive.
Misure di prevenzione
In tutti i casi, è fondamentale adottare misure di isolamento da contatto per limitare la trasmissione nosocomiale. Gli operatori sanitari devono attenersi a rigorose norme igieniche, in particolare al lavaggio delle mani con acqua e sapone, poiché le spore di C. difficile sono resistenti agli igienizzanti alcolici.