La tubercolosi è una malattia infettiva, contagiosa, provocata dal batterio Mycobacterium tuberculosis, anche chiamato bacillo di Koch, dal nome del suo scopritore Robert Koch, premio Nobel per la Medicina nel 1905.
Le manifestazioni cliniche interessano abitualmente i polmoni. L’infezione, però, può essere generalizzata o coinvolgere in modo selettivo altri distretti corporei: soprattutto le meningi, i linfonodi, le ossa, le stazioni del sistema monocito-macrofagico, gli organi addominali e l’apparato urogenitale, anche da parte del Mycobacterium Bovis, principale agente eziologico della tuberolosi bovina.
La sintomatologia risulta molto variabile, non solo per la diversità degli organi colpiti nel singolo caso clinico, ma anche per la notevole importanza che in questa infezione riveste lo stato immunitario dell’ospite nei confronti dell’agente eziologico. Si distinguono, pertanto, una tubercolosi primaria, in cui il micobatterio invade un organismo privo di immunità specifica, più spesso a guarigione spontanea, ma che può anche progredire a quadri di malattia conclamata di gravità diversa, e una tubercolosi postprimaria sintomatica. Quest’ultima è espressione di una riattivazione endogena (più raramente di una reinfezione esogena) verificatasi anni dopo l’infezione primaria.
Epidemiologia
La tubercolosi è un’infezione assai “antica”. Per il sommarsi di vari fattori favorevoli (miglioramento delle condizioni igieniche, sanitarie ed economiche delle popolazioni; disponibilità terapeutiche efficaci; estendersi delle norme profilattiche), negli ultimi cinquant’anni l’incidenza della malattia è progressivamente diminuita. Da alcuni anni, però, il numero dei casi sta aumentando in alcuni Paesi (soprattutto negli Stati Uniti, ma anche in Europa) in concomitanza con il diffondersi dell’infezione da HIV, a causa dell’immunodepressione che ne consegue.
Sempre in associazione al fenomeno dell’infezione da HIV, dalla fine degli anni Ottanta, negli Stati Uniti, sono state segnalate diverse epidemie di tubercolosi multifarmacoresistenti, provocate dai ceppi MDR (Multi Drug-Resistant).
Più recentemente, inoltre, sono comparsi ceppi di micobatteri tubercolari resistenti a pressoché tutti i farmaci: questa forma di malattia è definita dall’Organizzazione Mondiale della Sanità (OMS) come XDRTB (Extensively Drug Resistant-Tuberculosis).
In Italia l’indice di mortalità dell’intera popolazione si è ridotto di circa il 99%. La tubercolosi colpisce, soprattutto le aree a basso tenore di vita e le classi sociali più disagiate e il sesso maschile, venendo quindi a costituire un fedele “indicatore” del benessere sociale di una comunità.
Eziologia
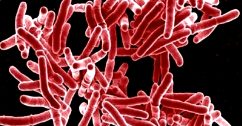
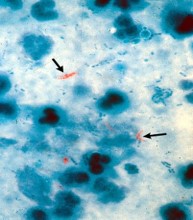
Mycobacterium tuberculosis appare al microscopio come un bastoncello immobile, privo di ciglia e di capsula e gram positivo. È costituito da proteine, lipidi e glicidi. Caratteristico l’elevato contenuto in lipidi (fosfati, grassi neutri, cere), cui si deve l’alcol-acido-resistenza evidenziabile con la classica colorazione di Ziehl-Neelsen, specifica per i micobatteri. Notevole importanza spetta, comunque, anche alle proteine, poiché alcune di esse rappresentano l’antigene (tubercolina) responsabile dell’ipersensibilità di tipo ritardato dimostrabile nei soggetti infettati.
Il bacillo di Koch non cresce sui terreni comuni, ma solo su quelli arricchiti con sostanze complesse, quali il tuorlo d’uovo o l’albumina. Attualmente sono da preferirsi i terreni liquidi (Bactec, Migit), che permettono una crescita più rapida (15-30 giorni) e risultano più adeguati a effettuare dei test di sensibilità ai farmaci.
È aerobio stretto, con optimum di temperatura a 37 °C. La crescita viene stimolata da una PO2 di 100 mmHg o superiore, e da una PCO2 di circa 40 mmHg. In effetti, gli organi più spesso colpiti nelle disseminazioni metastatiche appaiono quelli in cui la PO2 è più elevata, quali gli apici polmonari e i reni.
Il bacillo della tubercolosi si dimostra sensibile al calore, soprattutto umido (in autoclave a 120 °C viene ucciso in pochi minuti), ma non al freddo (si mantiene vitale per diversi giorni a +4 °C e per alcuni mesi a −75 °C); notevole la resistenza all’essiccamento, specie se al riparo della luce solare (ultravioletti). La sensibilità ai comuni disinfettanti (alcol, formolo, tintura di iodio, ammonio quaternario) risulta discreta, soprattutto se non è inglobato in materiali organici. La resistenza agli acidi e agli alcali appare superiore a quella degli altri batteri.
Modalità di infezione

Per quanto riguarda le vie di infezione, la più frequente è la via aerogena, per inalazione di goccioline bacillifere (droplets in seguito a colpi di tosse o starnuti) e/o di pulviscolo in cui sono pervenuti bacilli tubercolari. Dei soggetti entrati in contatto con persone infette, solo il 30% si infetta con incubazione per 4-12 settimane, e di questi solo il 5% mostra tubercolosi primaria, i restanti non sviluppano malattia.
L’infezione attraverso la via gastrointestinale, per ingestione di materiali contaminati, viene per lo più provocata dal bacillo bovino, Mycobacterium bovis, presente nel latte di animali infetti. Essa oggi risulta assai rara, dato il controllo esercitato sugli allevamenti, nonché per l’abitudine di consumare solo latte pastorizzato. La via digestiva sta alla base della tubercolosi intestinale; i micobatteri così penetrati, tuttavia, possono raggiungere anche il polmone o altri organi per via linfatica o linfo-ematogena.
L’infezione per via cutanea, da impianto diretto attraverso la cute per contatto con materiali infetti, è eccezionale e responsabile di forme cliniche particolari.
Immunità e patogenesi
Lo sviluppo e l’evoluzione dell’infezione tubercolare appaiono condizionati da diversi fattori, alcuni dei quali legati al microrganismo (carica microbica), altri all’ospite.
I meccanismi dell’ipersensibilità di tipo ritardato e quelli dell’immunità cellulare hanno un ruolo patogenetico essenziale nel determinare la storia naturale dell’infezione nel singolo paziente.
Da un punto di vista patogenetico si hanno due periodi diversi di infezione.
Il periodo primario corrisponde alla prima infezione. In questa fase la diffusione del micobatterio nell’organismo avviene per contiguità e per via linfatica; si forma il cosiddetto complesso primario e l’ospite si sensibilizza. Se l’infezione non si arresta, si passa al periodo secondario, con disseminazione ai diversi organi per via linfoematogena.
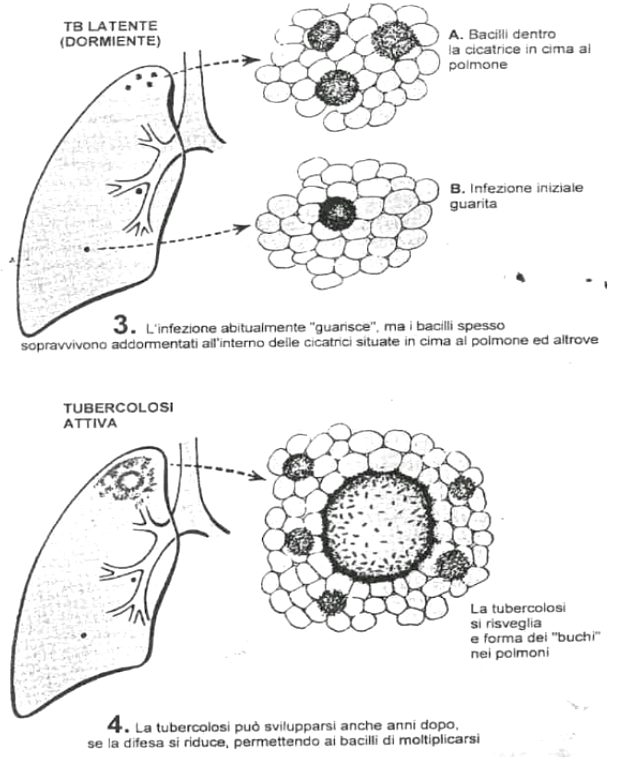
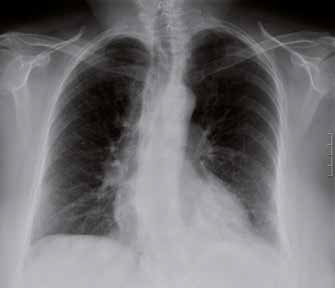
Il primo impianto del micobatterio in un organismo vergine, tubercolosi primaria, può aver sede in qualsiasi organo, ma nella stragrande maggioranza dei casi è localizzato al polmone. I micobatteri raggiungono gli alveoli polmonari, dove vengono fagocitati dai macrofagi e trasportati ai linfonodi regionali. I macrofagi si trasformano in cellule istiocitarie epitelioidi che determinano la formazione di granulomi caseosi. I micobatteri possono restare confinati all’interno dei macrofagi per anni; in genere si verifica la guarigione, che determina la calcificazione dei granulomi. Alla radiografia del torace questo processo si manifesta sotto forma di una lesione calcificata (complesso primario di Ghon).
All’interno del focolaio parenchimale, e soprattutto nei linfonodi satelliti, persistono micobatteri ancora viventi che instaurano la malattia tubercolare latente. Anni dopo, questi micobatteri, in rapporto a condizioni che provocano uno stato di immunodepressione, possono dare luogo ad una tardiva ripresa della malattia tubercolare (tubercolosi postprimaria da riattivazione endogena), oppure si può avere una reinfezione esogena, in cui i micobatteri infettanti derivano dall’ambiente esterno. A differenza di quanto si verifica nell’infezione primaria, i quadri anatomo-clinici che ne conseguono appaiono quanto mai complessi e proteiformi.
Nell’ospite sensibilizzato, già entrato in contatto in precedenza con il micobatterio, gli antigeni tubercolino-simili sono elaborati dai macrofagi, e successivamente presentati e riconosciuti da parte dei linfociti TH1, che vanno incontro a espansione clonale. I linfociti attivati secernono mediatori che, a loro volta, attivano i macrofagi, i quali rappresentano i principali effettori della risposta a M. tuberculosis.
L’ipersensibilità di tipo ritardato che si sviluppa nella tubercolosi è un processo che porta alla distruzione dei macrofagi non attivati in cui i micobatteri si moltiplicano. Questo tipo di risposta si innesca in modo rapido e spesso produce danni all’organismo stesso, infatti, può causare colliquazione o necrosi caseosa, fenomeni caratteristici del danno polmonare della tubercolosi clinicamente manifesta.
Tale meccanismo, in apparenza svantaggioso, costituisce una pronta e potente modalità di controllo della proliferazione dei bacilli tubercolari (che nel citoplasma dei macrofagi immaturi non attivati hanno una crescita logaritmica), creando un ambiente extracellulare sfavorevole ai bacilli, nel quale molti di essi non riescono a sopravvivere.
La risposta cellulo-mediata, invece, determina l’attivazione dei macrofagi e li rende capaci di distruggere e digerire i bacilli da essi fagocitati. La risposta è antigene-specifica, mediata dai linfociti T attraverso la produzione di linfochine che richiamano e attivano localmente sia i macrofagi, sia altri linfociti.
Il modo in cui si sviluppa ed evolve la malattia tubercolare dipende quindi, in definitiva, dalle interazioni che si stabiliscono tra i meccanismi dell’immunità cellulo-mediata e quelli dell’ipersensibilità ritardata.
Nello sviluppo della necrosi caseosa, inoltre, possono avere un ruolo tanto i linfociti T-citotossici e le cellule natural killer (NK), quanto le interazioni anticorpo-dipendenti tra i linfociti citotossici. Alla distruzione dei tessuti partecipano probabilmente i processi coagulativi (determinando lo sviluppo di anossia), i composti intermedi del metabolismo azotato e ossidativo (prodotti dai macrofagi) e alcune citochine come il fattore di necrosi tumorale α (TNF-α) e il TNF-β.
Quadri clinici
L’infezione, ossia l’avvenuto contatto dell’organismo ospite con M. tuberculosis, non significa necessariamente malattia tubercolare. La maggior parte degli individui, infatti, viene infettata in modo del tutto asintomatico.
D’altra parte, se il soggetto guarito dall’infezione primaria dopo un certo periodo di tempo va incontro a una malattia tubercolare (riattivazione endogena o reinfezione esogena), il decorso clinico, analogamente al quadro anatomopatologico, sarà profondamente diverso da ciò che è accaduto in occasione del primo contatto. Il paziente, inevitabilmente, svilupperà i segni e i sintomi clinici tipici della tubercolosi. Si distinguono, pertanto, da un lato l’infezione primaria asintomatica, dall’altro la tubercolosi (o malattia) primaria e postprimaria.
Infezione primaria (complesso primario)
In passato il primo contatto con il bacillo di Koch avveniva di solito nel primo decennio di vita. Attualmente esso tende, invece, a verificarsi nella tarda adolescenza o nell’età adulta. Nella maggioranza dei casi la sede del complesso primario è il polmone; altre possibili localizzazioni sono l’intestino, il cavo orale, la cute.
Il complesso primario è formato dal focolaio parenchimale e dalla adenite satellite connessi tra loro dalla linfangite intermedia. Il focolaio parenchimale, situato abitualmente nel lobo inferiore e più spesso a destra, ha le dimensioni di un chicco di riso o di un pisello. La linfangite dei collettori peribronchiali e perivasali esprime la reazione al convogliamento batterico dal focolaio parenchimale alle ghiandole linfatiche. L’adenite satellite interessa i linfonodi interbronchiali e poi le successive stazioni parailari e tracheobronchiali.
Le lesioni, come pure l’esito abituale (fibrosi e calcificazione), appaiono simili a quelle parenchimali. La sintomatologia clinica manca completamente, per cui gli unici segni dell’avvenuta infezione primaria sono di carattere radiologico (opacità parenchimali e linfoghiandolari, apprezzabili solo quando raggiungono dimensioni di una certa entità) e biologico (viraggio alla positività delle prove tubercoliniche tra la 4a e la 6a settimana dal contagio).
Tubercolosi primaria
Quando l’infezione primaria non è controllata, si sviluppa una malattia tubercolare primaria, sintomatica, in cui possono comparire quadri clinici diversi:
- morbigena semplice. Si definiscono in questo modo le manifestazioni cliniche da ricondurre essenzialmente a fenomeni immunomediati, sia locali (polmone), sia extrapolmonari. Le immagini parenchimali, indicate con la denominazione di epitubercolosi (tenui addensamenti a carattere lobare o sublobare) sono attribuibili non tanto all’evoluzione di un processo caseoso, quanto a un difetto di canalizzazione bronchiale da compressione adenopatica.
La sintomatologia clinica, a esordio brusco, è essenzialmente di carattere tossiemico, con febbre subcontinua, tosse modesta, scarsa o assente espettorazione e sudorazioni profuse, con aumento della VES e risposta tubercolinica assai vivace.
Il decorso si dimostra in genere favorevole, con risoluzione clinica spontanea in una decina di giorni e regressione del quadro radiologico in 4-5 settimane.
Alle manifestazioni polmonari talora si associano reazioni pleuriche fibrinose e sierofibrinose, con sintomatologia variabile. Tra le principali manifestazioni extratoraciche di questa fase, vengono descritte la cheratocongiuntivite flittenulare (piccole flittene sulla congiuntiva bulbare, causa di fotofobia e lacrimazione) e, soprattutto, l’eritema nodoso. Gli elementi caratteristici di quest’ultimo quadro clinico sono i noduli sottocutanei infiltrati e dolorosi, di colorito rossastro e poi violaceo, che compaiono a gettate successive sulla faccia estensoria degli arti inferiori. Le manifestazioni cutanee si sviluppano dopo alcuni giorni di febbre, artralgie e disturbi digestivi, e regrediscono quasi sempre in 10-15 giorni. - Tubercolosi primaria a evoluzione tisiogena (da ulcerazioni del focolaio polmonare primario). Costituisce abitualmente l’espressione del mancato controllo dell’infezione, a causa di una caduta dei meccanismi di difesa. La caverna primaria che ne consegue è di solito riconoscibile per la concomitante presenza di un’adenopatia. La colliquazione del caseum, oltre alla formazione della caverna, può poi rendersi responsabile di tutti quei quadri clinici da diffusione broncogena (polmonite caseosa, e così via) o ematogena (miliare acuta del periodo primario) che si rilevano più tipicamente nel corso della tubercolosi postprimaria.
Now loading…
Tubercolosi postprimaria
Tubercolosi data dalla riattivazione endogena di una tubercolosi latente oppure da una nuova infezione esterna. Generalmente è caratterizzata dalla presenza di caverne per distruzione del parenchima polmonare, tra l’altro se le caverne comunicano con le terminazioni dei bronchi, esse sono in grado di liberare bacilli all’esterno e quindi il paziente è contagioso. Se l’erosione interessa i vasi c’è anche la presenza di sangue nell’espettorato.
I sintomi principali sono: tosse, emottisi, dolore toracico (indice di coinvolgimento pleurico), febbre/sudorazione e perdita di peso.
La tubercolosi postprimaria può essere di diverso tipo.
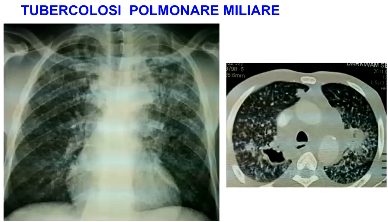
Tubercolosi miliare
Pur potendo verificarsi anche nel periodo primario, la tubercolosi miliare rappresenta una tipica manifestazione postprimaria. Essa consiste in una vera e propria sepsi tubercolare a partenza da un focolaio colliquato che si rompe in un vaso sanguigno o linfatico.
Il focolaio può avere sede ovunque, ma più tipicamente in un linfonodo. L’organismo in cui ha luogo la disseminazione è ormai sensibilizzato e tende, pertanto, a limitare le lesioni: la forma anatomica che ne deriva si identifica nel tubercolo miliare.
La disseminazione di micobatteri è talora diffusa all’intero parenchima polmonare e a molti organi extratoracici (miliare diffusa), talora limitata ad alcune zone del polmone o dei più svariati organi (miliari circoscritte).
Sul piano clinico, infine, le miliari polmonari assumono i caratteri delle infezioni acute (miliari acute) o anche, nelle forme localizzate, un andamento subdolo, lento e discontinuo (miliari subacute e croniche o miliari fredde). La forma acuta diffusa è la più grave, interessando non soltanto l’intero parenchima polmonare, ma molto spesso anche le meningi.
L’esordio appare per lo più graduale, con sintomi vaghi quali cefalea, malessere, astenia, febbricola e sudorazione. La febbre si fa poi elevata, continua o remittente, e compaiono cianosi, frequente obnubilamento del sensorio, accentuata dispnea e spiccata tachicardia. La tosse non è mai particolarmente pronunciata, l’espettorato è scarso o assente, l’emottisi rara.
L’obiettività toracica si dimostra modesta, mentre l’esame radiologico del torace (fondamentale per l’accertamento diagnostico, ma che può divenire anormale, però, solo qualche settimana dopo l’esordio dei sintomi), evidenzia la caratteristica disseminazione bilaterale più o meno fitta di piccoli elementi puntiformi (miliarici).
Per quanto riguarda i comuni esami di laboratorio, in genere i leucociti risultano nella norma o aumentati di poco; in qualche caso, invece, si osserva una leucopenia spiccata. La reazione tubercolinica è di solito positiva; può negativizzarsi in corso di malattia (anergia).
In assenza del tipico reperto radiologico del torace, la diagnosi è difficile: l’esame microscopico per la ricerca del bacillo di Koch nell’espettorato, infatti, riesce di regola negativa.
La miliare deve venire differenziata da numerose malattie infettive febbrili e in particolare dalla febbre tifoide. Sintomi guida, comunque, sono la cianosi, la dispnea e, soprattutto, l’intensa tachicardia.
In epoca preantibiotica la prognosi era infausta (morte per meningite tubercolare o per asfissia); oggi è invece radicalmente mutata e, anzi, la miliare costituisce una delle forme di tubercolosi più sensibili al trattamento.
Infiltrato precoce di Assmann
Tra i quadri clinici di tubercolosi postprimaria, rappresenta certo quello di più frequente osservazione. È un processo tubercolare circoscritto, di solito a sede retroclaveare o sottoclaveare, che esordisce come manifestazione nodulare, ma che mostra una spiccata tendenza a una rapida colliquazione e quindi all’escavazione (caverna); le dimensioni sono quelle di una noce o di un mandarino. In qualche caso coesiste una reazione essudativo-nodulare a carico di tutto il lobo (più spesso il superiore destro): si parla, allora, di infiltrato precoce a tipo di lobite.
I sintomi di esordio sono molto variabili. In alcuni soggetti compaiono disturbi soltanto dopo la formazione della caverna, e il primo segno di rilievo consiste in un’emottisi. Più spesso, tuttavia, il paziente presenta una sintomatologia di tipo simil-influenzale (astenia, febbre, sudorazione, anoressia) e i reperti obiettivi e radiologici della cavernizzazione si manifestano soltanto dopo un certo periodo di tempo. L’evoluzione delle forme non curate, comunque, è la cronicizzazione a tubercolosi cavitaria.
La prognosi, invece, diviene abitualmente favorevole se il trattamento chemioantibiotico è adeguato. Nella lobite, oltre ai sintomi generali, appare tipico il dolore toracico sordo e a localizzazione profonda, espressione del quasi costante interessamento della pleura scissurale.
La diagnosi si fonda sui reperti obiettivi e radiologici (addensamento prima, escavazione poi) e sul riscontro all’esame microscopico e colturale del bacillo di Koch nell’espettorato, pressoché costante dopo la formazione della caverna. Di regola le prove tubercoliniche risultano positive.
Polmonite caseosa
Forma clinica divenuta estremamente rara, si caratterizza per la presenza di lesioni caseose a carico di un intero lobo polmonare. L’andamento è di tipo francamente pneumonitico, l’evoluzione spontanea rapidamente fatale. Ha inizio brusco, con febbre elevata e stato tossiemico; i segni obiettivi e radiologici dei primi giorni possono far sospettare un’eziologia aspecifica, ma in seguito la positività degli esami per la ricerca del bacillo di Koch nell’espettorato, e di una o più cavità all’esame radiologico, permette la diagnosi corretta.
Broncopolmonite tubercolare a focolai disseminati
Anche questa forma un tempo era considerata a prognosi sempre infausta. È una broncoalveolite caseosa a focolai multipli che tendono in breve tempo a confluire e a escavarsi (“tisi galoppante”); esordisce in modo iperacuto, con febbre elevatissima, compromissione dello stato generale, tosse, dispnea, frequente emottisi ed espettorato positivo per il micobatterio.
Il quadro radiologico (addensamenti nodulari irregolarmente distribuiti, a contorni sfumati e spesso con immagini iperchiare nel loro contesto), deve essere discriminato da quello delle broncopolmoniti batteriche aspecifiche, nonché dalle metastasi polmonari.
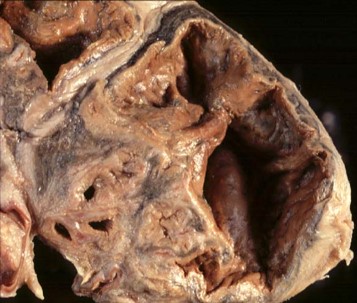
Tubercolosi cavitaria cronica (tisi)
Rappresenta l’evoluzione dei processi colliquativi polmonari: l’elemento patognomonico, quindi, è la caverna. Gli aspetti clinici di questa forma morbosa, assai diversi tra loro, come pure i reperti obiettivi e radiologici risultano di stretta competenza pneumologica. Occorre ricordare, comunque, che nei pazienti immunocompetenti l’espettorato è pressoché sempre positivo per la ricerca del bacillo di Koch e che il decorso non si dimostra necessariamente di tipo consuntivo come spesso si osservava in passato.
Pleurite fibrinosa e sierofibrinosa
La tubercolosi è la più frequente causa di pleurite. Il micobatterio raggiunge la pleura da focolai polmonari preesistenti, anche se sovente le lesioni parenchimali non sono agevolmente dimostrabili. La sintomatologia della pleurite, che può rappresentare una complicanza della tubercolosi primaria, come pure comparire nel periodo postprimario, è variabile. La forma secca o fibrinosa a volte si presenta in maniera del tutto asintomatica, a volte, invece, provoca febbre e modesto dolore; la forma essudativa (o sierofibrinosa) si manifesta con disturbi più importanti, insorgendo sia bruscamente, sia, al contrario, in modo subdolo. Febbre elevata, sudorazioni profuse, astenia, tosse non produttiva, dolore puntorio, costituiscono i sintomi principali. I reperti obiettivi della pleurite essudativa appaiono quelli classici del versamento pleurico su base flogistica (ipomobilità dell’emitorace colpito, riduzione o scomparsa del fremito vocale tattile, ipofonesi od ottusità – disposta secondo la linea di Damoiseau-Ellis – riduzione del respiro e soffio bronchiale). La puntura esplorativa dà luogo a un liquido citrino a tipo di essudato, in cui nel 50% dei casi è possibile dimostrare il bacillo di Koch (coltura). L’esame radiologico mette in evidenza un’opacità più o meno densa a seconda dell’entità del versamento. Il decorso spontaneo si dimostra di solito prolungato ma favorevole.
Tubercolosi extrapolmonare
Oggi la tubercolosi extrapolmonare è di più frequente riscontro a causa della disseminazione ematogena nei soggetti infetti da HIV. Le sedi più spesso interessate sono: linfonodi, pleura, tratto genitourinario, ossa, articolazioni, meningi e peritoneo.
Diagnosi
Date le numerosissime forme cliniche eziologicamente correlabili con il micobatterio tubercolare, gli elementi di sospetto saranno di volta in volta diversi, a seconda dell’organo colpito e del quadro patologico in atto. In linea generale, la diagnosi di tubercolosi è essenzialmente formulabile in base ai tre seguenti criteri: radiologico (Rx torace, TC, RM), batteriologico (PCR ed esame colturale) e immunologico (reazioni tubercoliniche, Mantoux e test IGRA). Tuttavia sono molto utili anche i criteri clinici (segni e sintomi) e quelli istopatologici.
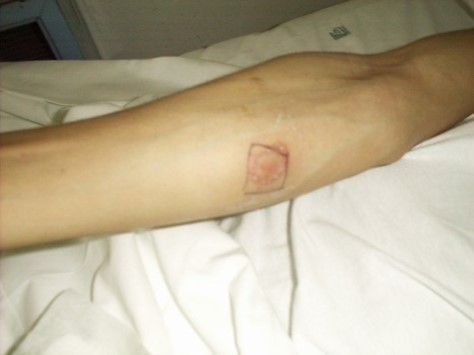
Da un punto di vista immunologico in passato è stato usato come antigene la tubercolina, estratto di brodocoltura di micobatteri filtrata per candela e ridotta a 1/10 del suo volume. La potenza di questa “vecchia tubercolina”, però, varia sensibilmente da preparazione a preparazione, e pertanto oggi si preferisce impiegare in vivo prodotti purificati, di cui il più utilizzato è il cosiddetto Mantoux (20 volte più potente della tubercolina) o PPD (purified protein derivative). La potenza del PPD, in rapporto a una “vecchia” tubercolina standard, viene espressa in Unità: l’Unità internazionale corrisponde a 0,01 mg di vecchia tubercolina. Il test viene utilizzato inoculando per via intradermica 5-10 Ul.
L’inoculazione di tubercolina nell’animale o nell’uomo non provoca alcun fenomeno quando l’organismo è microbiologicamente vergine, mentre nei soggetti in precedenza infettati dal micobatterio induce la comparsa di tre reazioni distinte: una reazione locale, caratterizzata da intensa congestione dei vasi e formazione di una papula, nel punto di iniezione; una reazione di focolaio attorno alle pregresse lesioni tubercolari; nonché, se la dose è adeguata, disturbi di carattere generale (febbre).
La prima reazione, che indica l’avvenuto contatto con M. tuberculosis, viene definita positiva quando si osserva un infiltrato cutaneo di diametro superiore a 5 mm dopo 48-72 ore dall’esecuzione del test. Normalmente, dopo il contatto con il micobatterio, la reazione si positivizza a distanza di 30-60 giorni. Per questo, nelle indagini epidemiologiche il test viene ripetuto sui contatti 1 e 3 mesi più tardi.
Questo test ci dice soltanto che il soggetto è stato esposto al bacillo, anche se il paziente è stato vaccinato oppure esposto a micobatteri non tubercolari. Falsi negativi ci possono essere in caso di errori di inoculo, di lettura (misurazione), soggetti immunodepressi o con tubercolosi avanzata.
Il significato diagnostico dei vari test tubercolinici appare modesto. Essi documentano semplicemente l’avvenuto contatto dell’organismo con il bacillo di Koch, ma non è certo possibile attribuire al micobatterio un determinato quadro morboso sulla semplice scorta della positività di queste prove. Più utile, caso mai, il criterio di esclusione, dato che quasi tutti i soggetti affetti da tubercolosi in forma attiva presentano reazioni positive.
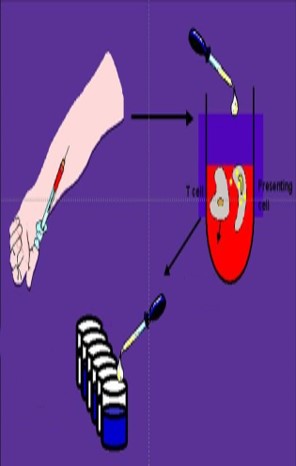
L’IGRA test (Interferon-Gamma Release-Assay) è un test basato sulla ricerca dell’interferone gamma nel sangue. I linfociti del soggetto in esame vengono posti in contatto con l’antigene, con un controllo negativo privo di antigene e con un controllo positivo contenente fitoemoagglutinina.
Dopo incubazione si fa la ricerca dell’INF-γ che se è assente vuol dire che non c’è infezione, se presente vi è infezione.
In caso di presenza nel controllo negativo il test non è valido; in caso di assenza nel controllo positivo vuol dire che si ha un deficit immunitario.
Questo test, a differenza della Mantoux ha una specificità più elevata, non è influenzato dalla vaccinazione, è più pratico (c’è bisogno solo del prelievo di sangue, senza dover far aspettare la reazione al paziente), ha un’interpretazione oggettiva.
Tuttavia è un test di secondo livello perché è molto costoso, quindi viene fatto dopo il Mantoux.
Nei materiali patologici (espettorato, urine, broncoaspirato, liquor, succo gastrico e così via), M. tuberculosis può essere dimostrato con varie tecniche. L’esame batterioscopico diretto (colorazione di Ziehl-Neelsen o immunofluorescenza con auramina-rodamina) risulta positivo soltanto in una percentuale del 60% di casi. È sempre necessario, pertanto, completare gli accertamenti con i metodi colturali: la coltura sui terreni convenzionali (Löwenstein-Jensen, Petragnani) e l’identificazione biochimica richiedono un’attesa di 4-12 settimane, mentre la prova radiometrica su terreni liquidi consente di ottenere i risultati in 1-2 settimane.
Oltre a confermare la diagnosi, l’isolamento in coltura dà la possibilità di effettuare l’antibiogramma, aiuto prezioso nella scelta dei farmaci più attivi per ciascun paziente.
Dopo la crescita, la differenziazione delle singole specie di micobatteri viene raggiunta con l’uso di sonde di DNA, oppure mediante cromatografia in fase liquida ad alta risoluzione o ibridazione del DNA.
Ove disponibile, la reazione a catena della polimerasi (PCR), tramite l’amplificazione dell’RNA ribosomiale o del DNA di M. tuberculosis, permette di evidenziare direttamente e rapidamente (entro 24 ore, di solito 2-3 ore) la presenza nei campioni biologici anche di pochissimi micobatteri. In campioni di espettorato positivi all’esame colturale, la sensibilità e la specificità della PCR sono superiori al 95%; in campioni negativi, la specificità è analoga, ma la sensibilità è del 40-77%.
Infine, ai soli scopi di ricerca epidemiologica (per identificare i diversi ceppi di M. tuberculosis), si utilizzano altre metodiche particolari, quale l’analisi del polimorfismo dei frammenti di restrizione del DNA, nota come RFLP (Restriction Fragment Length Polymorphisms) Fingerprinting.
Terapia
Una volta fatta la diagnosi, la prima cosa da fare è la notifica per avvisare tutti i contatti, isolare il soggetto con tubercolosi polmonare bacillifera, raccomandare tutte le precauzioni standard della diffusione aerea (igiene delle mani, DPI), iniziare la terapia. La tubercolosi è oggi prevenibile grazie ad una efficace profilassi e curabile nel 98% dei casi. Nella prescrizione terapeutica, però, occorre tenere sempre presente la spiccata tendenza alla cronicizzazione, peculiare di questa malattia.
La scelta della terapia, ove possibile, deve essere guidata dall’antibiogramma. È importante, durante il trattamento, controllare frequentemente la funzionalità epatica e renale, vista l’elevata tossicità di alcuni farmaci antitubercolari per questi organi.
I principi che guidano la scelta della terapia antitubercolare devono tener conto della necessità di un trattamento protratto, a causa della lenta moltiplicazione dei micobatteri, nonché dell’esistenza di tre compartimenti di microrganismi: un compartimento extracellulare metabolicamente attivo, uno intracellulare relativamente inattivo e uno localizzato all’interno della sostanza caseosa. Soltanto la rifampicina (o la rifabutina) ha azione battericida per tutti i tre compartimenti.
L’isoniazide e la streptomicina sono attive nei confronti del compartimento extracellulare, l’isoniazide e la pirazinamide sono attive nei confronti dei micobatteri in posizione intracellulare. L’etambutolo è soltanto batteriostatico.
La terapia di scelta della tubercolosi polmonare consiste nella somministrazione di isoniazide, rifampicina (o rifabutina), pirazinamide ed etambutolo (oppure streptomicina) ogni giorno per 2 mesi. Successivamente, si somministrano isoniazide e rifampicina (o rifabutina) ogni giorno per 4 mesi.
In alternativa, nelle forme complicate si possono utilizzare le associazioni di isoniazide, rifampicina (o rifabutina), pirazinamide ed etambutolo (oppure streptomicina) ogni giorno per 6 settimane; successivamente, si prosegue con isoniazide e rifampicina per 4 mesi. Il regime terapeutico sopraindicato viene consigliato anche per i pazienti con infezione da HIV o altre situazioni di immunocompromissione e per la tubercolosi extrapolmonare (eccettuate le forme disseminate, meningee e osteoarticolari, in cui il trattamento va proseguito per almeno 12 mesi). Nelle forme multiresistenti il trattamento si prolunga per 2 anni, con una terapia iniettiva.
Il successo della terapia antitubercolare dipende in larga parte dall’adesione del paziente: a questo proposito, è opportuno che i farmaci, quando possibile, vengano assunti sotto la diretta supervisione del personale sanitario, la cosiddetta DOT (Direct Observed Therapy).
Con gli attuali schemi di terapia, le recidive sono inferiori all’1%; i pazienti, comunque, devono essere seguiti per 1-2 anni dopo la fine della terapia.
Nei soggetti con escreato positivo prima del trattamento, gli esami batteriologici vanno effettuati almeno ogni 30 giorni; dopo 2 mesi di trattamento, più dell’85% va incontro a negativizzazione. Nei pazienti con persistente positività dell’espettorato va sospettata la resistenza del micobatterio o la mancata adesione alla terapia.
Nei pazienti affetti da tubercolosi polmonare con escreato negativo prima del trattamento o da tubercolosi extrapolmonare, i controlli si basano sugli accertamenti radiografici e clinici abituali. Tra i diversi trattamenti adiuvanti della malattia tubercolare (farmaci vari, climatoterapia) occorre ricordare la terapia corticosteroidea, che per i suoi effetti antinfiammatori e anti-essudativi trova posto nei quadri a componente essudativa molto pronunciata: pleurite, infezione primaria con notevole compromissione linfonodale e bronchiale, polmonite, broncopolmonite, meningite. In questi casi i corticosteroidi, a dosi relativamente “basse” (per esempio 10-20 mg/die di prednisone) sono prescritti per 4-12 settimane.
Prevenzione
Per la prevenzione bisogna fare gli screening nei soggetti a rischio, vaccinazione routinaria soprattutto alla nascita nei paesi ad alta prevalenza di tubercolosi. La vaccinazione permette di proteggere i bambini dalle forme severe (meningiti e miliari). Tuttavia il vaccino ha una bassa efficacia (0-80%).
Oggi la vaccinazione è indicata per gli operatori sanitari ad alto rischio di esposizione a tubercolosi multiresistenze, nei neonati e bambini di età inferiore ai 5 anni, con test tubercolinico negativo, contatti stretti di persone affette da tubercolosi in fase contagiosa, qualora persista il rischio di contagio, figli di immigrati che rientrano al paese di origine per frequentare la scuola, con obbligo di vaccinazione.
Molto spesso viene fatta chemioprofilassi nei soggetti positivi al Mantoux o al test IGRA che sono HIV positivi, che sono contatti stretti di una persona con recente diagnosi di tubercolosi, con recente conversione PPD, con condizioni mediche favorenti (tossicodipendenti, diabete, leucemia, IRC, terapia steroidea) o soggetti immigrati da paesi ad alta endemia.
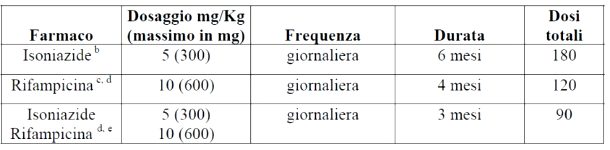
La chemioprofilassi si fa con isoniazide, con rifampicina o una combinazione dei due secondo il seguente schema:
Fonte: Manuale di malattie infettive.