ESERCITAZIONE: Analisi Volumetrica
OGGETTO: Determinazione dell’acidità totale di un aceto
FORMULE:
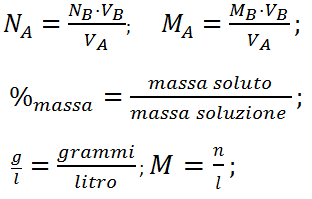
Legenda:
NA= Normalità dell’acido;
NB= Normalità della base;
VA= Volume dell’acido;
VB= Volume della base;
MA= Molarità dell’acido;
MB= Molarità della base;
%massa= Percentuale Massa;
n= moli;
g= grammi;
l= litro.
STRUMENTI E APPARECCHI UTILIZZATI:
 Buretta;
Buretta;- Pipetta Tarata con Propipetta;
- Becherino;
- Beuta;
- Matraccio;
- Indicatore Fenolftaleina;
- Spruzzetta con acqua distillata;
- Aceto di vino;
- Titolante Idrossido di Sodio (NaOH);
RELAZIONE:
CONOSCENZE TEORICHE:
La titolazione o Analisi Volumetrica è una tecnica analitica che consiste nel far reagire una soluzione a titolo noto di un reagente (titolante) con un volume noto di una soluzione contenente l’analita (titolando). Conoscendo il volume di titolante utilizzato e la stechiometria di reazione si può risalire alla concentrazione dell’analita con semplici calcoli.
La Titolazione Acido-Base è utile a verificare la concentrazione ignota di un acido o di una base, mediante la reazione di neutralizzazione che porta alla formazione di un sale più acqua. La soluzione da titolare può essere un acido o una base, sia debole che forte. Per monitorare l’andamento della titolazione si può utilizzare un indicatore il cui pH di viraggio sia nella regione del punto di equivalenza. Il punto di equivalenza è il punto in cui la base e l’acido sono presenti nelle stesse quantità nelle reazioni in cui hanno lo stesso coefficiente stechiometrico e che è il punto in cui il pH è neutro nelle titolazioni fra un acido forte e una base forte, ovvero nelle reazioni dove i prodotti non influenzano il pH.
Il titolante è un reagente utilizzato nella titolazione di cui si conosce già la concentrazione. Grazie ad esso, è possibile determinare la concentrazione dell’altro reagente. Il titolante viene generalmente dosato tramite una buretta, strumento che consente di leggere con precisione (generalmente fino a 0,05 ml) il volume di titolante aggiunto.
Un acido debole è un acido che non perde tutti gli atomi d’idrogeno quando disciolto in acqua, ovvero si dissocia solo in parte. Questi acidi hanno un pH più alto (a parità di concentrazione) rispetto agli acidi forti, i quali al contrario rilasciano tutti i loro atomi di idrogeno se disciolti in acqua.
Gli acidi deboli comprendono una grande varietà di sostanze, fra cui l’acido acetico (da noi utilizzato).
La base forte è una base che portata in soluzione acquosa, si dissocia totalmente e quindi da luogo ad una ionizzazione totale. Le principali basi forti sono: idrossido di sodio (NaOH) da noi utilizzato, idrossido di potassio (KOH), idrossido di calcio: (Ca(OH)2) idrossido di bario (Ba(OH)2) e idrossido di magnesio (Mg(OH)2).
DESCRIZIONE DELLA PROVA:
Lo scopo di questa prova è la determinazione dell’acidità di un aceto utilizzando il metodo reale di analisi previsto dalla gazzetta ufficiale. Per farlo abbiamo bisogno di 3 reattivi: di un aceto, nel nostro caso di vino, di un titolante, nel nostro caso Idrossido di Sodio (NaOH), di un indicatore opportuno e specifico, nel nostro caso Fenolftaleina, e degli strumenti e vetrerie di laboratorio: buretta, matraccio, beuta, pipetta tarata con relativa pro pipetta, becherino e spruzzetta.
Una volta individuati i materiali, si procede con l’avvinamento degli strumenti da utilizzare con le relative soluzioni per eliminare eventuali impurezze: la buretta con l’NaOH, la pipetta con l’aceto.
Dopo aver avvinato, si procede nel prelevare 25 ml di aceto con la pipetta (aiutandosi con la propipetta) e li si versano nel matraccio, dove verrà diluito con l’acqua distillata nella spruzzetta, fino a raggiungere il segnetto del matraccio, adesso si agita il matraccio coprendolo con una pellicola parafilm in modo da omogeneizzare la soluzione senza influire sulla sua concentrazione.
Ora si procede nel disporre il titolante dal becherino alla buretta azzerandola, dopo di che si procede nell’avvinare la pipetta con l’aceto diluito, si prelevano 25 ml di aceto diluito e li si versano nella beuta inserendo anche due o tre gocce di Fenolftaleina in modo da individuare il punto di equivalenza.
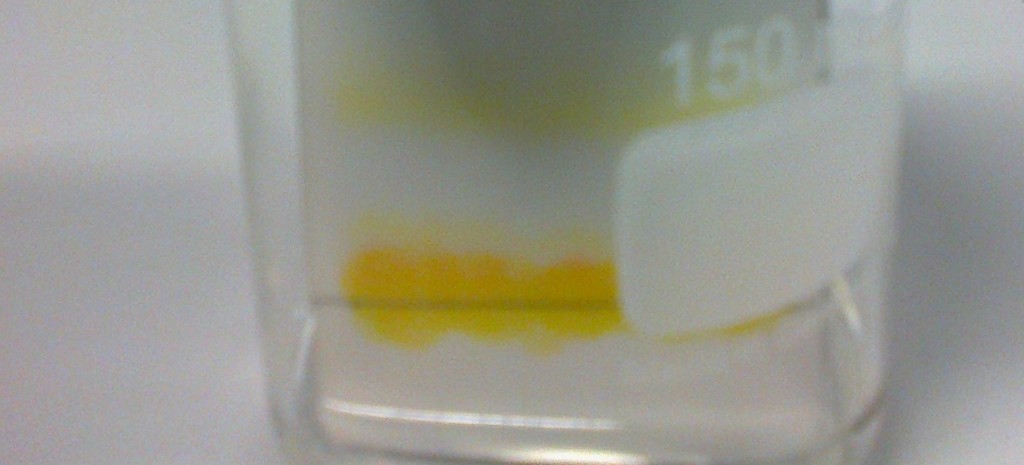
Ora si inizia a fare la titolazione, prendendo la beuta e inserendola sotto il beccuccio della buretta, si apre il rubinetto di quest’ultima in modo da far uscire il titolante goccia a goccia per avere una maggiore precisione. Mentre le gocce cadono, si agita la beuta facendo dei movimenti rotatori (sempre per omogeneizzare la soluzione) fino a quando la soluzione non cambia colore e diventa porpora, ora si chiude il rubinetto, si agita per bene la soluzione e si annota la quantità di titolante consumato. Se entro 15 o 20 secondi la soluzione diventa di un colore roseo, allora la prova è da considerare buona. Tutto l’acido acetico presente nell’aceto di vino è stato, a quel punto, neutralizzato dall’idrossido di sodio secondo la reazione:
CH3COOH + NaOH –> CH3COONa + H2O
Se il colore rimane porpora, allora si ha aggiunto qualche goccia di titolante di troppo. Questo procedimento è lo stesso per tutte le prove che si vogliono effettuare.
Conoscendo la Molarità e la quantità del titolante utilizzato e la quantità di acido utilizzato, ci possiamo ricavare la Molarità dell’aceto e la percentuale di acido in esso presente calcolando per mezzo delle formule. Nel nostro caso, la percentuale di acido risulta essere del 6,6% Anche se in teoria dovrebbe raggiungere valori intorno al 6%.
Come in tutti gli esperimenti, si possono commettere alcuni errori, in questa prova sbagliare può risultare facile perché si possono ottenere diversi tipi di errori: mancare di accuratezza nel prelevare o rilasciare soluzioni, commettere errori di parallasse o leggere male le misure degli strumenti anche a causa dei menischi che si vengono a formare con l’adesione e la coesione delle particelle, avvinamento eseguito in modo errato, poca attenzione nel far cadere le gocce di titolante ecc..
Tuttavia penso che dal mio gruppo non siano stati effettuati particolari errori anche perché la prova era interessante e breve da effettuare e quindi avevamo più opportunità di ripetere la prova nel caso avessimo sbagliato i passaggi. Le determinazioni sono state effettuate con successo.
Now loading…