L’azione degli ormoni si esplica attraverso il legame degli ormoni a specifici recettori, i quali possono essere localizzati sulla superficie cellulare o all’interno della cellula (la posizione del recettore dipende dalla natura chimica dell’ormone, poiché, ad esempio, ormoni idrosolubili che non sono in grado di attraversare il doppio strato fosfolipidico ed entrare nella cellula, non possono mai avere specifici recettori localizzati all’interno della cellula). I recettori degli ormoni proteici sono posti sulla superficie cellulare, quelli per gli ormoni steroidei sono posti a livello citoplasmatico, mentre quelli per gli ormoni tiroidei sono endonucleari.
I legami ormone-recettore sono regolati dalla legge dell’azione di massa, poiché dipendono direttamente dalla concentrazione dell’ormone e dei recettori specifici, ma dipendono anche da specifiche costanti di associazione e dissociazione, che definiscono l’attività di interazione ormone-recettore.
Il legame dell’ormone al recettore specifico non si traduce sempre in un’azione; infatti, possono legarsi al recettore sia sostanze ad azione agonista che sostanze ad azione antagonista, in ragione del loro effetto sulla cellula bersaglio. Gli antagonisti non attivano i meccanismi effettori all’interno della cellula bersaglio, pertanto il loro effetto sarà nullo.
Esistono, inoltre, diversi meccanismi recettoriali per la trasduzione del segnale: infatti, nel momento in cui l’ormone si lega al suo specifico recettore, l’azione biologica si esplica attraverso una trasduzione del segnale legata all’interazione ormone-recettore.
Ci sono recettori che, dopo il legame con lo specifico ormone, si associano ad un gruppo eterogeneo di proteine eterotrimeriche note come proteine G, formate da 1 subunità alfa e altre 2 subunità, beta e gamma (unite insieme). In base al tipo di subunità alfa presente in una proteina G, viene delineato il preciso sottotipo di quella proteina G. Le sottoclassi di proteine G di seguito elencate svolgono le loro funzioni solo in seguito al legame ormone-recettore:
- le proteine Gs sono capaci di attivare l’adenilato ciclasi (aumentando di conseguenza la sintesi e la concentrazione intracellulare di AMPc). L’AMPc attiverà di seguito la Protein Chinasi A (PKA) che ha come target diversi substrati: il risultato finale sarà sintesi proteica cellulare modificata;
- le proteine Gi inibiscono invece l’adenilato ciclasi, con effetto diametralmente opposto alle proteine Gs (diminuzione della responsività cellulare agli stimoli);
- le proteine Gq sono capaci di attivare le fosfolipasi C, la quale agisce idrolizzando alcuni fosfolipidi di membrana, come ad esempio il fosfatidil-inositolo (PIP2). L’idrolisi di questo fosfolipide genera inositolo-3-fosfato (IP3) e diacilglicerolo (DAG), incrementando quindi le concentrazioni intracellulari di questi elementi. IP3 interagirà con il rispettivo recettore del reticolo endoplasmatico causando la liberazione degli ioni calcio e, quindi, un aumento della concentrazione intracellulare di calcio. Tale ione è capace di attivare molteplici enzimi e avviare un’ampia serie di risposte cellulari (contrazione, secrezione…). DAG, invece, attiva e richiama la Protein Chinasi C (PKC), capace di fosforilare bersagli e avviare nuove risposte cellulari.
- le proteine Gt sono capaci di attivare le fosfodiesterasi.
Alcune malattie endogene hanno come evento patogenetico l’attivazione incontrollata di questi meccanismi: ad esempio, nella sindrome di Carney, una patologia caratterizzata da iperattività endocrina e mixomi atriali, vi è proprio un’attivazione patologica della PKA.
Un’altra classe recettoriale per gli ormoni proteici è quella costituita da recettori dotati di un’attività tirosin-chinasica intrinseca: questo tipo di recettori, a seguito del legame con il proprio specifico ormone, vanno incontro a un processo di dimerizzazione e ad una successiva autofosforilazione dei residui di tirosina. Una volta attivati, questi siti si legano ad altre proteine come la fosfolipasi C con attivazione del segnale (per esempio si attiva la cascata delle MAP chinasi).
Ancora, altri recettori posseggono un dominio intracellulare con attività guanilato-ciclasica. Questi possiedono un altro dominio legante, chiamato ATP simil-chinasico, il quale se non è legato ad ATP avrà una funzione inibitoria sull’attività guanilato-ciclasica mentre se sarà legato ad ATP avrà un’azione attivatoria sulla suddetta attività guanilato-ciclasica.
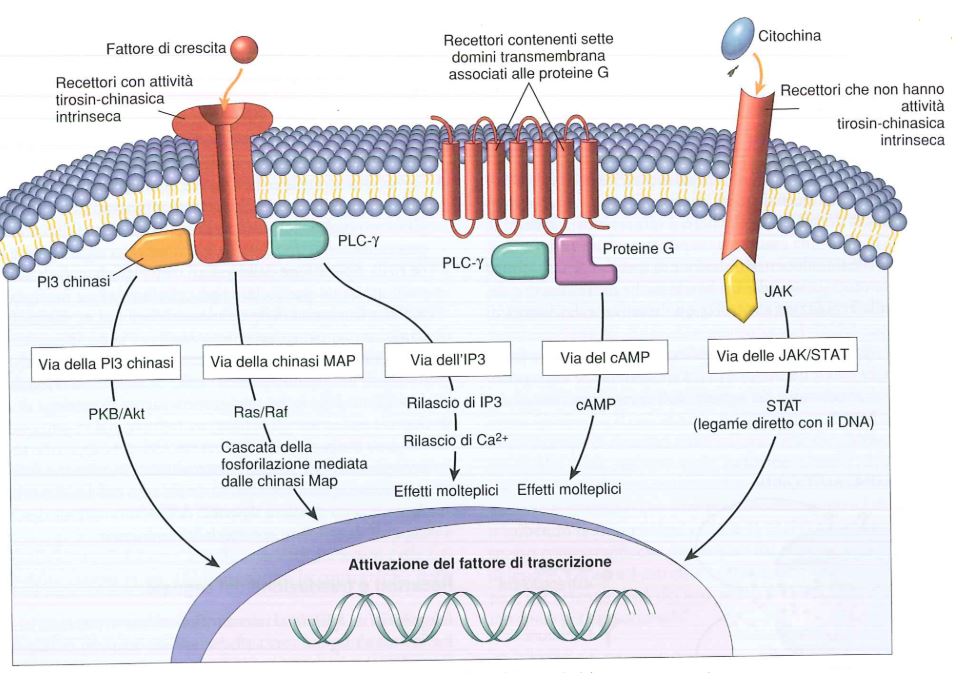
Fonte: Le basi patologiche delle malattie.
Poi vi sono i recettori steroidei, come quelli per i glucocorticoidi, mineralcorticoidi, androgeni, estrogeni, vitamina D e ormoni tiroidei. Questi recettori agiscono da fattori di trascrizione nel momento in cui vanno a legare un ormone dei precedenti citati, migrando in sede nucleare e modificando l’espressione di uno o più geni.
Questi sono a loro volta divisi in:
- recettori steroidei citoplasmatici (recettori per i glucocorticoidi, mineralcorticoidi, progesterone, androgeni); questi recettori, quando non legano il proprio ormone, sono complessati con una heat-shock protein (ad esempio HSP-56, HSP-70, HSP-90) che ne inattiva la funzione e non ne permette la migrazione in sede nucleare. Quando l’ormone si lega al recettore, la HSP si dissocia e il complesso ormone-recettore migra nel nucleo, agendo da fattore di trascrizione sul promotore specifico del gene bersaglio con seguente attivazione della trascrizione.
- recettori steroidei nucleari (recettori per ormoni tiroidei, estrogeni, acido retinoico e vitamina D). A differenza dei precedenti recettori, questi si localizzano in sede nucleare e non citoplasmatica. Quando questi recettori non legano il proprio ormone, sono associati ad una heat-shock protein nucleare che ne impedisce la funzione biologica. Quando l’ormone si lega, la HSP si dissocia e il complesso ormone-recettore agisce attivando la trascrizione di precise sequenze geniche. Prima che però il legame ormone-recettore si traduca in un’azione, sono necessari tempi lunghi, anche di alcune ore. Non si spiega dunque l’immediatezza di risposta di alcuni tessuti a seguito di stimolazione ormonale: si pensa che siano coinvolti nella risposta altri fattori, non genomici, forse di natura epigenetica, a controllare le attivazioni.
Fonte: Manuale di endocrinologia.