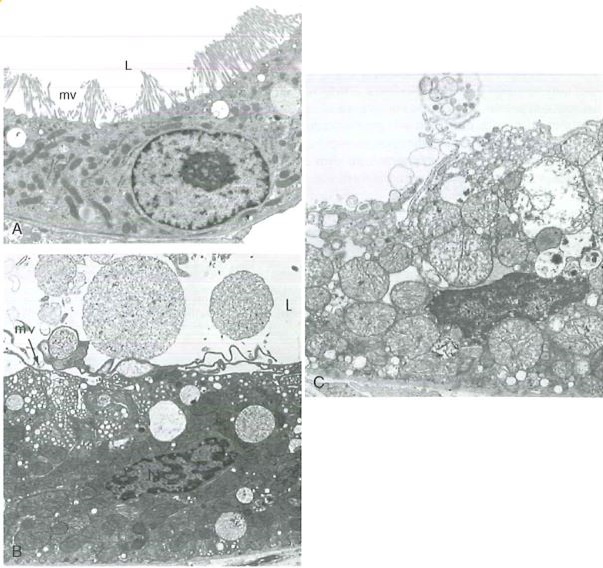
La morte cellulare può avvenire per necrosi o per apoptosi. Queste sono molto diverse fra loro. La morte per necrosi viene definita “morte sporca”, mentre quella per apoptosi è una “morte pulita”. Questo perché nella necrosi si ha completa distruzione cellulare e rottura della membrana cellulare e delle membrane biologiche degli organelli citoplasmatici, con rilascio di contenuto all’esterno (proteine denaturate e coagulate ed enzimi degradativi dei lisosomi), inoltre l’area circostante il tessuto necrotico mostra sempre segni di infiammazione. L’apoptosi è un suicidio cellulare programmato, è pulita perché non si ha lesione della membrana cellulare e rilascio di contenuto all’esterno, ma si producono frammenti cellulari (corpi apoptotici) captati da macrofagi “spazzini”, non si ha infiammazione. La cromatina viene condensata e frammentata mentre le dimensioni della cellula si riducono.
La necrosi è sempre ascrivibile a condizioni patologiche, mentre l’apoptosi si verifica anche fisiologicamente (ad esempio durante lo sviluppo embrionale per la regressione di alcune strutture anatomiche), inoltre l’apoptosi è importante nel processo infiammatorio: i neutrofili che hanno svolto il loro compito vanno in apoptosi e il tessuto viene ripulito da macrofagi tramite efferocitosi.
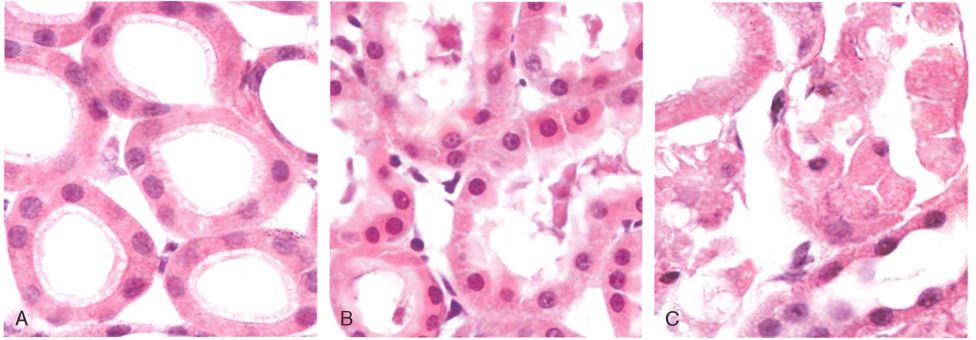
Fonte: Le basi patologiche delle malattie.
Fonte: Le basi patologiche delle malattie.
La necrosi rappresenta il corrispettivo morfologico della morte cellulare irreversibile. La sua manifestazione più comune è la necrosi coagulativa con denaturazione delle proteine, rottura di organelli e membrana plasmatica e rigonfiamento cellulare massivo. Viene operata una digestione del tessuto per:
- autolisi: la rottura dei lisosomi provoca il rilascio delle idrolasi in essi contenute;
- eterolisi: provocata dall’azione dei leucociti richiamati dall’esito infiammatorio della necrosi, i quali possono liberare enzimi litici che demoliscono le proteine e le altre componenti del tessuto.
La necrosi si caratterizza:
- per aumento dell’eosinofilia (aumento dell’affinità del tessuto per l’eosina). Normalmente in una cellula a livello citosolico vi è molto RNA (rRNA dei ribosomi e mRNA) e proteine che hanno elevata affinità per l’ematossilina (che conferisce ai tessuti una colorazione blu-violacea), poiché si ha degradazione di proteine citosoliche e di RNA (ad opera di proteasi e RNAasi) si ha eosinofilia (colorazione rosa pallido). Ciò è indice di avvenuta necrosi tissutale.
- al microscopio elettronico si notano aggregati di materiale proteico denaturato e resti osmiofili, i mitocondri appaiono rigonfi di materiale lipidico derivanti dalla degenerazione delle membrane mitocondriali, la membrana plasmatica e le membrane degli organelli presentano numerose discontinuità.
- a cellula ha un aspetto più trasparente per la perdita di glicogeno e il citoplasma presenta vacuoli.
A livello nucleare invece si ha:
- inizialmente picnosi (addensamento del DNA nucleare e riduzione delle dimensioni del nucleo con aumento della basofilia);
- successivamente si ha cariolessi (frammentazione del nucleo);
- infine cariolisi (completa scomparsa del nucleo e riduzione della basofilia).
Tipi di necrosi
Dal punto di vista istopatologico si possono distinguere vari tipi di necrosi:
Fonte: Le basi patologiche delle malattie.
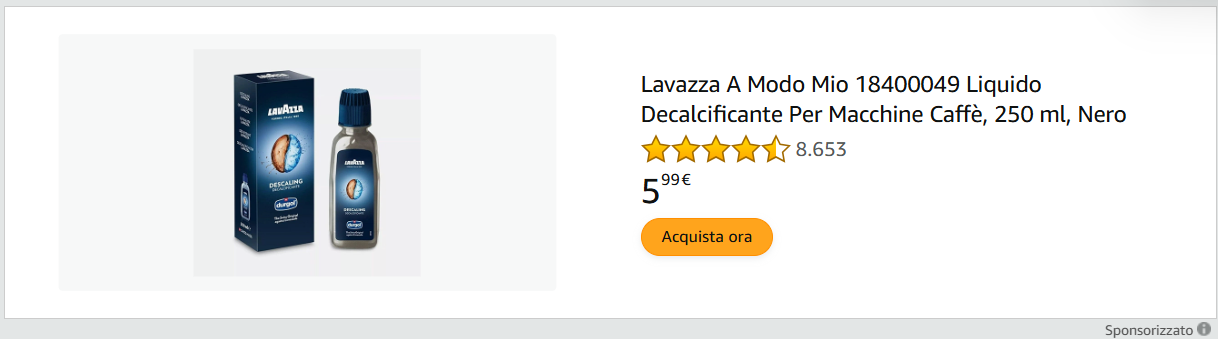
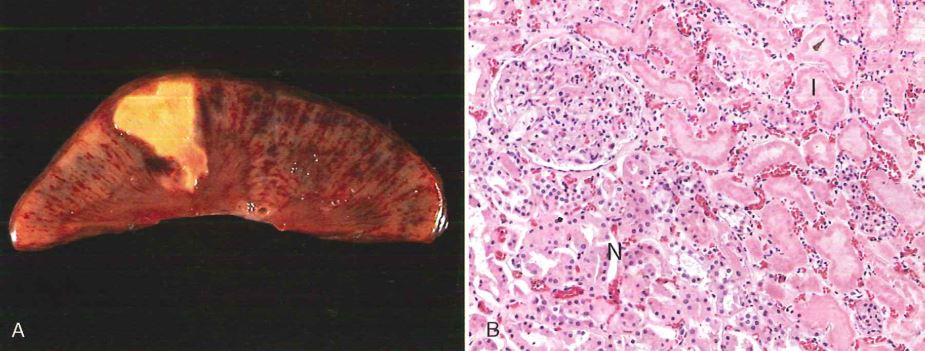
Necrosi coagulativa: è associata ad un processo di denaturazione delle componenti proteiche intracellulari. Si osserva in quadri ipossici bruschi (ovvero che comportano una brusca riduzione di ossigeno nel tessuto in un piccolo intervallo di tempo) in queste condizioni pertanto la cellula non fa in tempo ad adattarsi tramite glicolisi anaerobia e pertanto va in necrosi. L’area necrotica è ben definita e delimitata, il tessuto è asciutto, compatto e opaco. È un po’ come se il tessuto diventasse “imbalsamato”, nel senso che rimane compatto e con un’architettura ben consolidata, a causa della denaturazione anche degli stessi enzimi digestivi, con conseguente blocco della proteolisi cellulare, di conseguenza è possibile osservare il persistere di cellule anucleate eosinofile per giorni o settimane.
La denaturazione comporta rottura delle strutture terziarie ed esposizione delle catene laterali delle proteine e provoca: eosinofilia, flocculazione (si formano flocculi proteici, ovvero precipitati di proteine intracellulari dovuti al compattamento delle proteine denaturate) e autofluorescenza (i flocculi sono visibili all’ultravioletto, ovvero emettono luce nello spettro del visibile quando irradiati con l’ultravioletto).
Questa “imbalsamatura” perdura per alcune settimane, dopodiché arrivano i leucociti scavenger (spazzini) che sono in grado di rimuovere tessuto necrotico. In questa zona si verifica anche il processo infiammatorio che porta leucociti ed enzimi proteolitici che sono in grado di rimuovere cellule morte. Non si spiega ancora perché a livello cerebrale non si ha necrosi coagulativa in seguito ad ipossia.
Nell’immagine si può osservare una necrosi coagulativa (infarto renale). In A) l’aspetto macroscopico, in B), al microscopio, si ha nell’area sinistra tessuto normale (N), nell’area destra tessuto necrotico infartuato (I) caratterizzato da aumento dell’eosinofilia, infarcimento di polimorfonucleati e scomparsa dei nuclei.
Fonte: Le basi patologiche delle malattie.
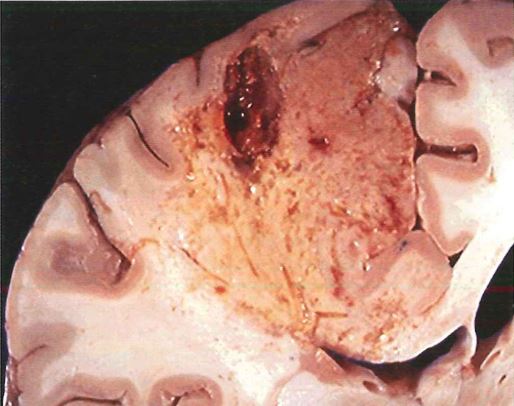
Necrosi colliquativa: è caratterizzata dalla completa digestione enzimatica del tessuto. Il materiale necrotico diventa quasi liquido, viscoso e si ha distruzione della struttura. La si osserva in caso di processi infettivi micotici e batterici: questo perché gli agenti microbici possono richiamare cellule della difesa nel tessuto, le quali riversano i propri enzimi litici e digeriscono il tessuto.
In questi casi il processo infettivo e la riduzione della quota di ossigeno è lenta e si ha una diminuzione del pH delle cellule che vanno in necrosi con conseguente attivazione di idrolasi lisosomiali (evento che non si verificava nella necrosi coagulativa).
Se il processo infiammatorio acuto è stato intenso si ha un aspetto giallo cremoso per la presenza di leucociti morti (pus).
Esempio: gomma luetica della sifilide (formazioni dure al tatto in cui c’è un residuo viscoso circondato da materiale fibroso) questo perché Treponema pallidum è in grado di infiltrare il tessuto e indurre una risposta infiammatoria notevole che porta a necrosi colliquativa. Le spirochete hanno alta affinità per i vasi con conseguente vasculite ed ischemia progressiva.
Altro esempio: ischemia trombotica a livello encefalico può dare necrosi colliquativa.
Fonte: Le basi patologiche delle malattie.
Un aspetto particolare è la necrosi gangrenosa che si osserva soprattutto a livello degli arti inferiori (soggetti con diabete avanzato, ma anche in quadri di grave sepsi). In questo caso alla necrosi coagulativa si sovrappone un evento infettivo che porta a necrosi colliquativa per azione dei batteri e leucociti, gangrena umida. Non è un quadro specifico di morte cellulare, ma viene adoperato in caso di arti che hanno perso l’apporto ematico e hanno sviluppato una necrosi, generalmente coagulativa.
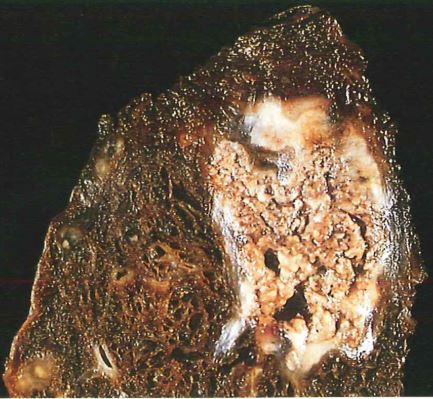
Necrosi caseosa: tipica della tubercolosi avanzata. Nella zona in cui si accumulano i micobatteri fagocitati dai macrofagi, per processi di attivazione macrofagica, si ha una massiccia secrezione di enzimi proteolitici di derivazione macrofagica in grado di distruggere completamente il tessuto da avere l’aspetto macroscopico di “formaggio fuso” ovvero la necrosi assume aspetto caseoso. Al microscopio, l’area necrotica si presenta come un complesso di cellule lisate o frammentate ed è quello che poi radiologicamente si chiamano caverne.

Fonte: Le basi patologiche delle malattie.
Steatonecrosi (necrosi grassa): molto seria, si osserva quando il paziente ha gravi infiammazioni come la pancreatite acuta fulminante. Il tessuto pancreatico (componente esocrina) viene completamente distrutto e le lipasi pancreatiche rilasciate in cavità addominale, dove provocano la degradazione dei lipidi del mesentere, con deposizione di placche di sapone. Si ha una alterazione dei lipidi, si formano degli esteri saponificati con il calcio e non è raro individuare nella cavità addominale pezzi simili a gesso che sono esteri lipidici che si sono complessati con il calcio.
Necrosi fibrinoide: si verifica a livello di grosse arterie in quadri patologici come le vasculiti autoimmunitarie (es: malattia da siero). Si ha la deposizione di immunocomplessi (complessi antigene-anticorpo) nel sottoendotelio e si ha il passaggio della fibrina che torna quindi al vaso infiammato. In questo caso il danno tissutale provoca la rottura della membrana basale su cui poggiano gli endoteliociti e quindi il fibrinogeno presente nel sangue passa nel tessuto presente intorno alla arteria generando un coagulo fibrinoide che dà un aspetto rosa pallido alla lesione.

Fonte: Le basi patologiche delle malattie.