In inglese blot, o blotting, significa trasferimento. Il western blotting consiste nel trasferimento di proteine da un supporto ad un altro, in genere dal gel a un altro supporto come la membrana di nitrocellulosa, oppure un polimero fatto di PVDF (PoliViniliDenFluoruro), un polimero sintetico su cui si possono legare le proteine.
Il termine “western” ha un’origine curiosa perché alcuni scienziati avevano scoperto la possibilità di trasferimento di queste macromolecole da un supporto ad un altro a partire dagli acidi nucleici mettendo in pratica il cosiddetto “Southern blotting“. Proprio uno scienziato che si chiamava Southern aveva dato il proprio cognome alla tecnica. Il southern blotting è lo stesso tipo di tecnica del western blotting con la sola differenza che ad essere trasferite non sono le proteine ma il DNA. Per analogia è stato applicato questo tipo di tecnica di trasferimento anche all’RNA e in questo caso è stato chiamato northern blotting. Quando è stato utilizzato per le proteine gli è stato dato il nome di western blotting.
Questo tipo di tecnica presuppone l’avvenuta migrazione su gel delle proteine quindi è una tecnica analitica che presuppone una corsa elettroforetica. Quindi al termine della corsa elettroforetica del nostro campione iniziale, le proteine separate sul gel, possono essere ulteriormente identificate con questa tecnica.
Dopo la corsa elettroforetica il primo passaggio del western blotting è il trasferimento delle proteine dal gel a un supporto solido che è la membrana polimerica.
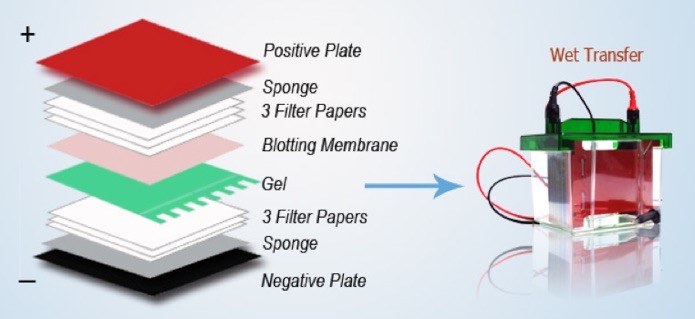
Il secondo passaggio è l’allestimento del sandwich come illustrato in figura. Il trasferimento delle proteine dal gel alla membrana avviene tramite applicazione di un campo elettrico perché le proteine intrappolate nel gel mantengono la loro carica e quindi, in opportune condizioni, viene sottoposto ad un campo elettrico che permette la migrazione verso il polo positivo. È una normale prosecuzione della tecnica del SDS-PAGE dove le proteine sono tutte cariche negativamente e quindi la migrazione si ha sempre verso il polo positivo.
Per poter traferire queste proteine si allestisce il sandwich formato da vari strati di carta assorbente perché ci deve essere un po’ di isolamento tra il campo elettrico e l’accoppiamento gel-membrana. Durante le operazioni di trasferimento bisogna stare attenti a capire il verso giusto. Per poter ottenere il trasferimento delle proteine che sono cariche negativamente verso il polo positivo dobbiamo montare tutto l’apparato sul polo negativo quindi dobbiamo avere il gel, poi la membrana che va verso il polo positivo e alla fine abbiamo il coperchio del nostro strumento che è il trasferitore che corrisponde al polo positivo. Bisogna seguire quest’ordine perché se si monta al contrario, cioè se si mette prima la membrana e poi il gel, poiché il trasferimento si ha sempre verso il polo positivo le proteine invece di andare verso la membrana verranno trasferite sullo strato di carta con cui ricopriamo il gel.
Ci sono altri modelli di trasferitore delle proteine dove si monta tutto al contrario quindi si comincia con il polo positivo, poi si mette la membrana e sulla membrana si mette il gel. Importante è conoscere il verso: se c’è prima il polo positivo si mette prima la membrana nel caso contrario in cui c’è prima il polo negativo si mette prima il gel.
Accorgimenti tecnici a cui bisogna prestare attenzione sono la formazione delle bolle. Quando si crea il sandwich per ottimizzare il trasferimento delle proteine dal gel alla membrana non ci deve essere nessuna bolla d’aria perché in caso contrario, le proteine corrispondenti alla bolla d’aria non verrebbero e quando alla fine dell’esperimento si va a colorare la membrana ci si trova una bolla bianca dove non si sono trasferite le proteine. Difatti, un’operazione che si fa quando si allestisce il sandwich, è di passare una specie di rullo sul sandwich dove c’è la membrana più gel in maniera tale da far uscire tutta l’aria.
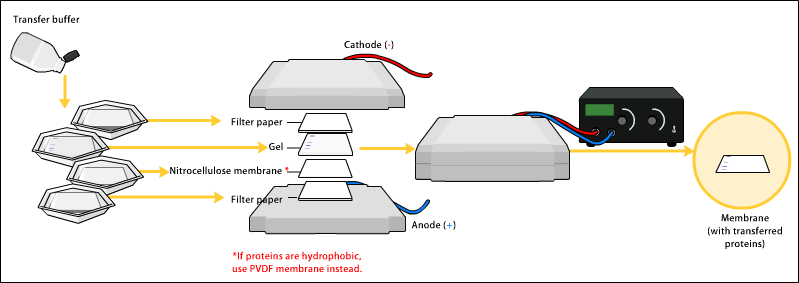
Il passaggio successivo è il trasferimento delle proteine sulla membrana. La direzione di trasferimento va dal catodo all’anodo. Si collega il generatore di corrente elettrica e otteniamo la nostra membrana. Alla fine dell’operazione di trasferimento si ottiene la membrana, su cui abbiamo trasferito le nostre proteine, che generalmente è bianca. L’operazione di trasferimento è necessaria perché successivamente bisogna identificare la nostra proteina di interesse attraverso la reazione con un anticorpo specifico per quella proteina: questa è la finalità dell’esperimento di western blotting. La reazione tra un anticorpo specifico di una proteina e quella proteina avviene molto meglio quando la proteina non si trova sul gel perché è molto più difficile che una proteina che si trova all’interno delle maglie della poliacrilammide reagisca con un anticorpo specifico. Può avvenire ma con una sensibilità molto minore.

Il trasferitore di ultima generazione si chiama trans-blot turbo transfer system. Nella storia delle tecniche biochimiche si sono succeduti vari tipi di strumenti che vengono utilizzati per il trasferimento. In particolare ce ne sono tre che si chiamano rispettivamente sistema di trasferimento ad immersione, sistema semi-drive e sistema trans-blot turbo. Turbo sta ad indicare la velocità di trasferimento.
Fino a pochi anni fa una delle tappe limitanti in un esperimento di western blotting era il tempo richiesto per il trasferimento perché richiedeva almeno 3 giorni. Invece con la messa a punto di questo strumento il trasferimento da over-night è stato ridotto a 15 minuti ed è per questo motivo che si chiama turbo. Il principio è sempre lo stesso: c’è un campo elettrico che viene applicato, soltanto che è stato ottimizzato al tal punto da richiedere un tempo brevissimo. Così le proteine che si trovano sulla membrana possono essere visualizzate.
Quando trasferiamo le nostre proteine sulla membrana, la membrana che inizialmente era bianca continua ad essere bianca perché le proteine per poterle visualizzare hanno bisogno di un metodo di colorazione. Ciò che noi vediamo sulla membrana sono soltanto le proteine del marker che erano già precolorate e che continuano ad essere colorate sulla membrana. Per essere sicuri che abbiamo trasferito le proteine è possibile colorarle con un colorante rosso chiamato rosso blusseau.
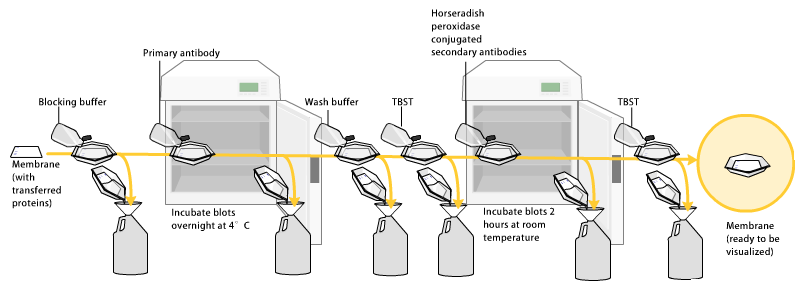
La terza fase è l’incubazione della membrana con l’anticorpo primario che si lega alla nostra proteina di interesse. Bisogna quindi scegliere un anticorpo che sia diretto contro la proteina di interesse. Molto spesso questi anticorpi che vengono messi in commercio sono aspecifici, cioè non si vanno solo a legare all’epitoco della proteina di nostro interesse, ma vanno anche a legarsi con altre proteine ottenendo come risultato finale delle bande aspecifiche. Per mettere in evidenza questo legame tra anticorpo e proteina l’anticorpo primario, che è quello diretto contro la nostra proteina, viene a sua volta fatto reagire con un anticorpo secondario.
Quindi dopo l’incubazione con l’anticorpo primario, si fanno degli opportuni lavaggi e, nella vaschetta che contiene la membrana, viene aggiunto un anticorpo secondario che è specifico per il suo anticorpo primario. Quando si aggiunge l’anticorpo secondario bisogna tener conto della specie animale in cui è stato prodotto l’anticorpo primario. L’esposizione di un determinato organismo come ad esempio l’uomo a un determinato antigene innesca la risposta immunitaria con la produzione di anticorpi e lo stesso principio vale anche per la produzione di anticorpi che si utilizzano in laboratorio.
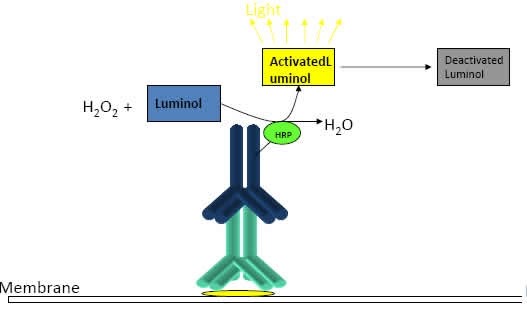
L’anticorpo secondario ha la capacità di essere rilevato in chemi-luminescenza, ciò significa che è coniugato con un enzima che permette lo sviluppo di luce che non è luce visibile ma luce rilevabile con uno strumento chemi-luminescente. Gli anticorpi secondari più utilizzati in laboratorio sono quelli che sono coniugati, per questo tipo di tecnica, con un enzima che è l’HRP, horseradish peroxidase che catalizza la reazione del H2O2 per formare H2O e O2. In presenza di un substrato che è luminolo, il luminolo più H2O2 dà una reazione che è di tipo chemi-luminescente, cioè la luce viene rilevata dallo strumento e questo poi si traduce nella visualizzazione della banda proteica. I substrati dell’enzima quindi sono H2O2 e luminolo. In presenza della perossidasi il luminolo diventa attivato perché l’H2O2 viene scissa in H2O e O2 e questo diviene il segnale di chemi-luminescenza. Questa reazione di sviluppo di chemi-luminescenza non dura perennemente nel tempo ma decade, quindi la velocità di acquisizione dell’immagine deve essere abbastanza elevata e bisogna procedere velocemente.
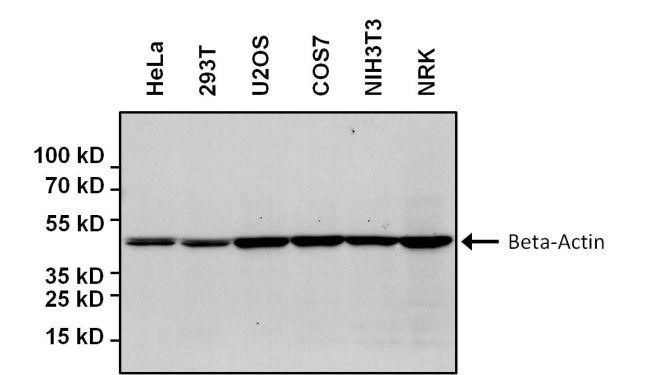
Il risultato che noi abbiamo è un risultato tipo quello riportato in figura. La parte grigia (in realtà è bianca) è la membrana su cui abbiamo trasferito tutte le nostre proteine. Noi volevamo andare ad analizzare solo una proteina che si chiama beta-actina quindi abbiamo fatto l’incubazione con l’anticorpo primario anti-beta-actina, l’incubazione con l’anticorpo secondario e in cui è stato prodotto l’anti-beta-actina e il segnale chemi-luminescente che si ottiene sono le bande nere che corrispondono alla proteina nelle varie lane. Le lane sono distinte tra di loro perché HeLa, 293T, U2OS… sono tutti nomi di linee cellulari che si utilizzano comunemente in laboratorio. Per esempio HeLa sono le prime cellule messe in Henrietta Lacks che era quella donna da cui hanno prelevato le cellule della cervice uterina.
L’utilità del western blotting è che l’intensità delle bande si può tradurre in un numero con l’analisi densitometrica. Dall’intensità delle bande possiamo ottenere una variazione dell’espressione della proteina X in base a trattamenti che noi abbiamo fatto o in base all’influenza di segnali intracellulari o extracellulari.



