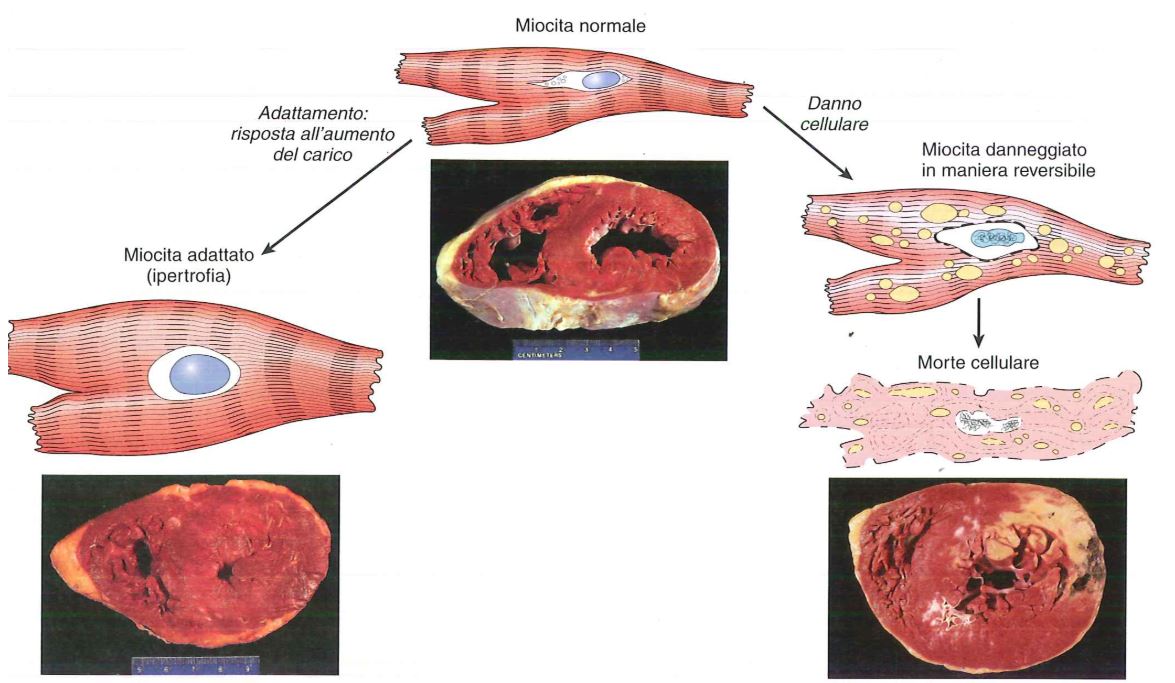
L‘ipertrofia si ha quando le cellule non possono replicarsi e quindi all’aumentata domanda, la cellula risponde con un adattamento che è un aumento delle dimensioni e del contenuto cellulare. L’aumento del volume cellulare è dovuto ad una maggiore sintesi di componenti strutturali. Le cellule che vanno incontro ad ipertrofia possono avere un maggior contenuto di DNA perché, non dividendosi, c’è una quota di DNA maggiore del nucleo.
Ipertrofia fisiologica
Tra gli esempi di ipertrofia fisiologica vi è quella dell’utero durante la gravidanza, dovuto alla pressione degli ormoni estrogeni, quindi si ha in questo caso l’interazione degli ormoni estrogeni con degli opportuni recettori intracellulari e si ha una risposta che si traduce in ipertrofia. Nel caso dell’utero si ha sia un’iperplasia che un’ipertrofia.
Un’ipertrofia si ha anche per la mammella durante l’allattamento grazie agli ormoni prolattina ed estrogeni.
Nell’immagine in basso si possono osservare le variazioni volumetriche all’estrema sinistra di un utero normale, e quello di una donna in gravidanza: passiamo da 4-6 ml in una donna normale a numerosi litri come capacità dell’utero in gravidanza. Come si vede all’immagine microscopica, vi è un aumento del numero delle cellule, quindi un’iperplasia, ma istologicamente osserviamo anche un’ipertrofia della componente cellulare, cioè le cellule diventano più spesse e più ricche di componenti fibrillari, evento tipico delle cellule muscolari, questo perché vi è un superlavoro.
Fonte: Le basi patologiche delle malattie..
Ipertrofia patologica
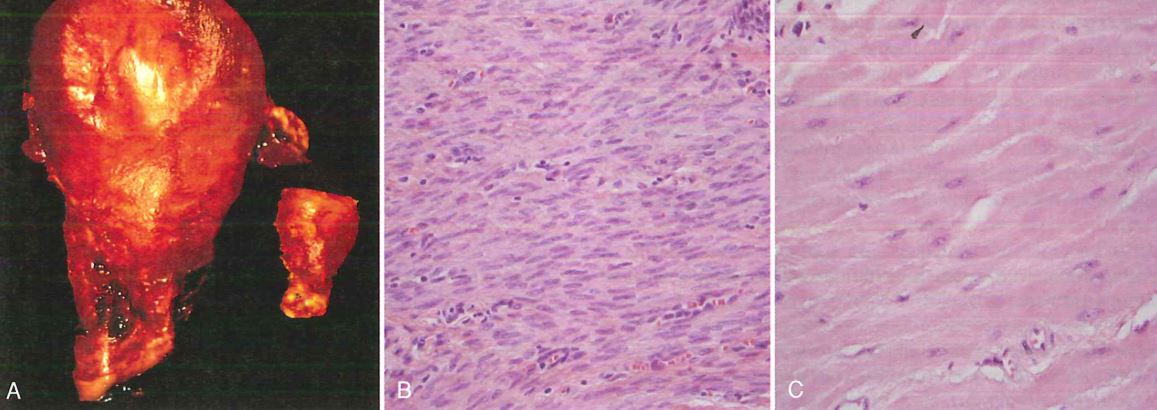
Un esempio classico di ipertrofia patologica è l’ipertrofia del miocardio.
L’ipertrofia del miocardio si verifica nel momento in cui abbiamo un quadro alterato dal punto di vista emodinamico, ascrivibile ad una valvulopatia o all’ipertensione (sovraccarico emodinamico cronico). In questo caso abbiamo una condizione di sofferenza del miocardio, che viene sottoposto ad un superlavoro e quindi diventa ipertrofico. La cosa interessante è che l’ipertrofia del miocardio non vede solo una semplice implementazione delle componenti intracellulari dei cardiomiociti, ma si ha una riespressione di geni che normalmente non dovrebbero essere espressi nei cardiomiociti, ma che sono funzionali al sovraccarico a cui è sottoposto il miocardio.
Per esempio si ha una riespressione dei geni che si esprimono durante le fasi precoci dello sviluppo come il fattore natriuretico atriale (ANF), oppure si ha un cambiamento nell’espressione delle molecole contrattili dei cardiomiociti.
La β-miosina (fetale o neonatale) sostituisce l’α-miosina (adulta), proprio perché dobbiamo avere una contrazione più lenta ed economica.
Dunque l’ipertrofia del miocardio non è una semplice ipertrofia ma è anche un quadro di riespressione genica che porta all’espressione di proteine diverse da quelle del cuore normale.
L’espressione del ANF è importante in questo caso perché è un peptide, prodotto da cellule specializzate del miocardio, che è fondamentale per regolare il flusso di soluti, ioni e, in ultima analisi, acqua a livello dei tubuli renali. Il fattore natriuretico atriale è in grado di favorire la secrezione di ioni sodio ed altri ioni nel lume dei tubuli ed in questo modo, si ha il richiamo di acqua nei tubuli. Ciò si verifica nel cuore ipertrofico per diminuire la pressione sanguigna, quindi la quota di liquidi a livello del distretto circolatorio. Richiamando acqua, diminuisce la pressione.
Esso viene quindi rilasciato in seguito ad un eccessivo aumento del volume ematico (alta pressione sanguigna) da particolari cardiomiociti dell’atrio destro del cuore. La cosa interessante è che il fattore natriuretico atriale nel cuore ipertrofico (così come nell’embrione) viene espresso anche a livello ventricolare perché si è in una situazione di sforzo ed innalzamento della contrazione sistolica.
Fonte: Le basi patologiche delle malattie.
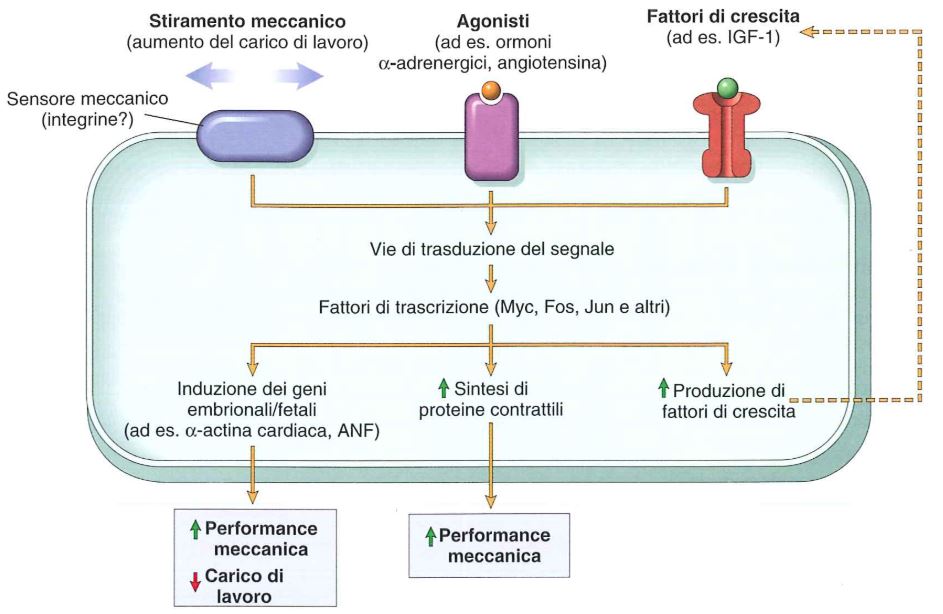
Il cuore ipertrofico è quello che viene definito il cuore dell’atleta entro certi limiti. L’innesco della maggior espressione genica nell’ipertrofia del miocardio è dovuto a stimoli meccanici, fattori di crescita o agenti vasoattivi.
A livello dei cardiomiociti vi sono dei meccanocettori, recettori che sentono lo stiramento, ad esempio in un quadro di ipertensione, e trasducono un segnale intracellulare che porta all’aumento dell’espressione di geni particolari che portano alla sintesi di ANF e β-miosina al posto dell’α-miosina.
I fattori di crescita che possono indurre una risposta genica del cuore ipertrofico sono ad esempio il fattore di crescita insulino simile-1 (IGF-1), il fattore di crescita dei fibroblasti (FGF) e il fattore di crescita trasformante β (TGF-β).
Gli agenti vasoattivi che possono agire sull’espressione genica a livello dei cardiomiociti sono ad esempio gli agonisti α-adrenergici, l’angiotensina II e l’endotelina-1.
Nell’ipertrofia vi è un aumento delle dimensioni dei cardiomiociti, in quanto vi è un aumento del contenuto intracellulare, come ad esempio del contenuto miofibrillare perché dobbiamo avere una risposta a uno sforzo che ci viene imposto da un’ipertensione o valvulopatia. La risposta ipertrofica è adattativa, cioè l’organo si adatta ad una condizione di stimolo.
Purtroppo l’ipertrofia del miocardio oltre certi limiti può portare ad un danno irreversibile, perché la massa ipertrofica del miocardio può diventare così ingente da non essere supportata da una idonea vascolarizzazione, e quindi questa massa ipertrofica può diventare prona a fenomeni di ischemia, cioè mancata irrorazione sanguigna, e quindi infarto. Inoltre i cardiomiociti ipertrofici hanno minore capacità ossidativa dei mitocondri, alterazioni della sintesi o della degradazione proteica e alterazione del citoscheletro.
Si instaurano quindi fenomeni degenerativi quali la lisi e la perdita di elementi contrattili miofibrillari. Infine si ha morte per necrosi o apoptosi.
Fonte: Le basi patologiche delle malattie.
In genere l’ipertrofia innescata da stimoli meccanici è fisiologica e segue la via della PI-3-chinasi e Akt, mentre l’ipertrofia innescata da fattori di crescita e agenti vasoattivi è patologica e segue la via dei recettori associati alle proteine G (vedi le vie di trasduzione del segnale).




