Nel paziente critico, l’assistenza respiratoria riveste un ruolo fondamentale con molteplici obiettivi: garantire la pervietà delle vie aeree, assicurare un’adeguata ossigenazione ematica (valutabile tramite la PaO₂ e la saturazione dell’emoglobina), mantenere una ventilazione alveolare efficace (PaCO₂), prevenire l’inalazione di materiale estraneo, quindi il rischio di polmonite ab ingestis, e, infine, favorire il più rapido ritorno possibile all’autonomia respiratoria del paziente. L’intervento respiratorio deve dunque essere tempestivo, mirato e costantemente adattato alla fisiopatologia sottostante.
Tipologie di insufficienza respiratoria
Esistono due principali forme di insufficienza respiratoria, con meccanismi patogenetici distinti che richiedono approcci diversi.
La “lung failure“ (o insufficienza respiratoria di tipo 1) è caratterizzata da un’ipossiemia in presenza di una normocapnia. In questo quadro si assiste a una compromissione degli scambi gassosi a livello alveolo-capillare, per esempio per edema interstiziale, infiltrati infiammatori o danno della membrana alveolare, ma senza un’alterazione significativa della ventilazione/minuto. Un caso tipico è quello della polmonite severa: l’edema interstiziale ostacola il passaggio dell’ossigeno, che diffonde più lentamente rispetto all’anidride carbonica. Quest’ultima, essendo più diffusibile, può comunque attraversare la barriera edematosa, spiegando perché nei pazienti in questa condizione la PaCO₂ rimane normale.
Diversamente, la “pump failure“ (o insufficienza respiratoria di tipo 2) è una condizione in cui all’ipossiemia si associa anche ipercapnia. Ciò si verifica quando è compromessa la meccanica ventilatoria, ovvero la pompa respiratoria non è in grado di generare un volume minuto adeguato. Questo accade, ad esempio, in presenza di depressione del drive respiratorio o della funzione dei muscoli respiratori. Un esempio classico è il paziente in arresto respiratorio secondario a intossicazione da benzodiazepine: la soppressione del centro respiratorio causa una riduzione della frequenza e della profondità degli atti respiratori, con conseguente diminuzione del volume minuto e accumulo di CO₂. Ne risulta un quadro di ipossia e ipercapnia.
Ossigenoterapia
L’ossigenoterapia è una delle prime strategie di supporto nel trattamento dell’insufficienza respiratoria e consiste nell’arricchire la miscela inalata dal paziente con ossigeno supplementare. È importante sottolineare che essa migliora esclusivamente la componente ossigenativa, senza intervenire sull’eliminazione dell’anidride carbonica. Per questo motivo, è inefficace (e potenzialmente pericolosa) se utilizzata isolatamente nei pazienti con insufficienza respiratoria di tipo 2, nei quali è necessaria una ventilazione assistita che garantisca anche la rimozione di CO₂.
La frazione inspirata di ossigeno (FiO₂) ottenuta mediante ossigenoterapia dipende dal flusso di O₂ somministrato: per ogni litro al minuto erogato, la FiO₂ aumenta di circa il 4%, mentre il primo litro incrementa la FiO₂ di circa il 3% rispetto al valore atmosferico di base (21%). Questo consente di stimare con buona approssimazione la FiO₂ somministrata al paziente a seconda del device utilizzato.
| Flusso erogato (l/min) | % di O₂ somministrato |
|---|---|
| 1 | 24% |
| 2 | 28% |
| 3 | 32% |
| 4 | 36% |
| 5 | 40% |
Tra i device che utilizziamo per l’ossigenoterapia rientrano:
Now loading…
- Cannule nasali a basso flusso (Low Flow Nasal Cannulas, LFNC): sono il dispositivo più semplice e frequentemente usato. Consentono un flusso massimo di 6 L/min, non ostacolano l’alimentazione e non favoriscono il re-breathing di CO₂. Tuttavia, se il paziente respira con la bocca, l’efficacia del trattamento si riduce sensibilmente. Possono inoltre causare secchezza delle mucose nasali.
- Maschera semplice: offre la possibilità di erogare ossigeno a flussi più elevati rispetto alle LFNC, fino a 10 L/min, risultando più efficace nei casi di ipossia marcata. Tuttavia, è meno tollerata, va rimossa durante l’alimentazione e può causare re-breathing di CO₂ a causa del ristagno di anidride carbonica all’interno della maschera. A lungo termine può provocare ulcere da decubito nei punti di contatto con il viso.
- Maschera di Venturi (Ventimask): questo dispositivo sfrutta il principio fisico dell’effetto Venturi, che consente di ottenere una miscela aria-O₂ a concentrazione predeterminata in modo preciso e riproducibile. A differenza dei dispositivi a flusso variabile, la Ventimask garantisce un’accurata regolazione della FiO₂, rendendola ideale in contesti clinici dove è essenziale controllare in modo rigoroso la concentrazione di ossigeno somministrata.
- Maschera con reservoir (non-rebreather mask): costituita da una maschera facciale collegata a un sacchetto (reservoir) che raccoglie l’ossigeno erogato, consentendo l’erogazione di FiO₂ molto elevate, anche fino al 100%, utilizzando flussi tra 10 e 15 L/min. Per contro, questo sistema può causare accumulo di CO₂ ed è quindi indicato solo per periodi brevi, in situazioni di ipossia severa, in attesa di un passaggio a supporti ventilatori più avanzati, come la ventilazione non invasiva (NIV) o l’intubazione endotracheale con ventilazione meccanica.
Ventilazione non invasiva (NIV)
La ventilazione meccanica rappresenta una strategia fondamentale nel trattamento del paziente critico con insufficienza respiratoria, e può essere erogata in modalità non invasiva o invasiva. Quando si parla di ventilazione non invasiva (NIV), si intende la somministrazione di un flusso di gas a pressione positiva attraverso dispositivi esterni, che si sigillano attorno al naso e/o alla bocca, senza la necessità di un accesso diretto alle vie aeree tramite intubazione.
Tra i principali dispositivi utilizzati per la NIV ricordiamo la maschera nasale, la maschera oro-facciale e la maschera full face. La scelta del tipo di interfaccia dipende dalla tollerabilità del paziente, dalla gravità del quadro clinico e dalla necessità di ottimizzare la tenuta e il comfort. Tuttavia, un prerequisito indispensabile per la NIV è che il paziente presenti stato di coscienza conservato, riflessi protettivi delle vie aeree integri e una minima capacità ventilatoria autonoma. In caso contrario, il rischio di inalazione di secrezioni o materiale gastrico impone il ricorso alla ventilazione invasiva, che consente di proteggere le vie aeree in modo efficace.
CPAP (Continuous Positive Airway Pressure)
La modalità più semplice di ventilazione non invasiva è rappresentata dalla CPAP, ovvero la somministrazione continua e costante di pressione positiva di fine espirazione (PEEP). Questa pressione viene mantenuta in tutte le fasi del ciclo respiratorio e ha la funzione di mantenere aperti gli alveoli, evitando il loro collasso (atelettasia), migliorando il reclutamento alveolare e riducendo il lavoro respiratorio del paziente.
Grazie a questi effetti, la CPAP si dimostra particolarmente utile nelle situazioni in cui gli scambi alveolo-capillari sono compromessi, come nelle polmoniti severe con ipossiemia normocapnica, nei primi stadi dell’edema polmonare cardiogeno, o in altre patologie con prevalente componente di “lung failure”. Tuttavia, la CPAP non è indicata nei pazienti con ipercapnia, cioè con insufficienza respiratoria di tipo 2, poiché non fornisce supporto inspiratorio né aumenta il volume minuto: non migliora quindi l’eliminazione di CO₂.
BIPAP e CPAP/ASB (o DuoPAP)
Now loading…
Per i pazienti che presentano ipercapnia, è invece necessaria una modalità ventilatoria che supporti attivamente l’inspirazione. In questo contesto, trovano applicazione la BIPAP (Bilevel Positive Airway Pressure) e la CPAP/ASB, conosciuta anche come DuoPAP.
Questi sistemi erogano due livelli di pressione positiva:
- una pressione più bassa, presente durante l’espirazione (che corrisponde alla PEEP già vista nella CPAP), per evitare il collasso alveolare;
- una pressione più alta durante l’inspirazione, che sostiene attivamente il paziente nel generare un volume corrente adeguato, riducendo l’impegno muscolare toracoaddominale e migliorando sia l’ossigenazione sia l’eliminazione della CO₂.
La differenza tra le due modalità riguarda il modo in cui viene gestita la pressione positiva inspiratoria:
- nella BIPAP, il ventilatore alterna le due pressioni in modo indipendente dalla respirazione spontanea del paziente (modalità asincrona);
- nella CPAP/ASB, invece, la pressione inspiratoria viene erogata solo in risposta ad uno sforzo inspiratorio del paziente, che attiva il ventilatore tramite il cosiddetto trigger inspiratorio (es. contrazione del diaframma).
Queste modalità sono quindi indicate in casi di insufficienza respiratoria tipo 2, in particolare quando vi è una riduzione del drive respiratorio o della forza muscolare respiratoria, ma in cui il paziente è ancora vigile e collaborante.
Ventilazione invasiva

Sebbene la NIV possa portare a un significativo miglioramento dei parametri respiratori, non è sempre sufficiente. Quando ci troviamo di fronte a un paziente con grave ipercapnia e/o ipossiemia refrattaria, o in caso di alterazione dello stato di coscienza con compromissione dei riflessi protettivi delle vie aeree, l’unica opzione terapeutica sicura è rappresentata dalla ventilazione invasiva.
La ventilazione invasiva rappresenta il livello massimo di supporto respiratorio, differenziandosi dalla NIV per l’introduzione diretta di presidi nelle vie aeree. Tra questi spiccano la maschera laringea, il tubo endotracheale e la cannula tracheostomica, posizionabili per via percutanea, con minore rischio di sanguinamento, o chirurgica.
Le indicazioni principali per la ventilazione invasiva comprendono:
- alterazioni significative dello stato di coscienza (punteggio Glasgow < 9), con perdita dei riflessi protettivi;
- arresto respiratorio o cardiaco, shock o situazioni critiche di peri-arresto;
- insuccesso della NIV, nonostante impostazioni adeguate, manifestato da:
- frequenza respiratoria > 30/min;
- persistente desaturazione;
- movimenti paradossi del torace o dell’addome.
In questi contesti, l’intubazione diventa essenziale per tutelare le vie aeree, eliminare completamente il lavoro respiratorio e garantire l’ossigenazione.
Rispetto alla NIV, la ventilazione invasiva consente una protezione totale delle vie aeree da aspirazione di secrezioni e riduzione del lavoro respiratorio, con conseguente risparmio di ossigeno.
Dall’altra parte, comporta rischi maggiori come lesioni tracheali, ventilator-associated pneumonia (VAP) e richiede apparecchiature sofisticate e personale esperto.
Sedazione durante ventilazione invasiva
Una ventilazione invasiva efficace si basa su una sedazione adeguata, garantita da farmaci quali propofol, benzodiazepine e oppioidi, per ridurre lo stress e favorire la sincronia paziente-ventilatore. Propofol è spesso preferito per la sua rapida induzione e risveglio, mentre benzodiazepine e morfina trovano impiego nei pazienti con indicazioni specifiche.
Le linee guida SCCM raccomandano, ove possibile, il livello di sedazione più leggero (RASS 0 a −2), associato a esiti migliori: riduzione della durata della ventilazione e dell’ospedalizzazione. Tuttavia, in alcune circostanze, come ARDS grave, aumento della pressione intracranica o paralisi neuromuscolare; è necessaria una sedazione profonda, con RASS fino a −4/−5 .
La somministrazione di bloccanti neuromuscolari (NMBA) è indicata in particolari situazioni, ad esempio per:
- consentire una ventilazione protettiva nel paziente con ARDS;
- facilitare l’intubazione;
- controllare lo shivering post-arresto cardiaco o in ipertensione intracranica refrattaria.
È indispensabile associare analgesia e sedazione ai NMBA, poiché questi bloccano i muscoli ma non impediscono la percezione di dolore o stress . La profondità del blocco si monitora tramite il Train-of-Four (TOF), mirato a 1–2 risposte su 4 per un blocco adeguato. Questo approccio riduce il rischio di complicanze come l’intensive‑care‑unit‑acquired weakness (ICU-AW).
Al termine della ventilazione invasiva, è fondamentale verificare l’assenza di blocco residuo (TOF ratio > 0,9), per garantire il recupero della funzione muscolare e prevenire complicanze respiratorie.
Funzionamento della ventilazione meccanica
I ventilatori meccanici operano erogando una pressione inspiratoria positiva, che supplisce all’attività del diaframma, mentre l’espirazione è passiva. Alla fine dell’espirazione, viene mantenuta una pressione residua chiamata PEEP (positive end‑expiratory pressure), fondamentale per prevenire il collasso alveolare durante tutto il ciclo respiratorio.
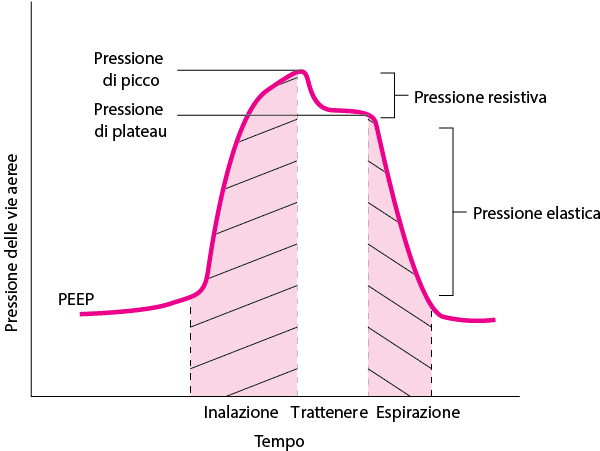
I valori di PEEP vengono calibrati in modo da trovare un equilibrio ottimale: livelli al di sotto di 10 cmH₂O possono favorire l’atelettasia, mentre pressioni troppo elevate aumentano il rischio di barotrauma. Secondo le indicazioni del network ARDS, spesso si impiegano PEEP tra i 6 e i 15 cmH₂O, con plateau pressure mantenute sotto i 30 cmH₂O per minimizzare il danno polmonare.
Il ciclo inspiratorio può essere:
- completamente controllato dal ventilatore, in assenza di sforzo respiratorio del paziente, utile quando si vuole azzerare il lavoro respiratorio.
- attivato in risposta allo sforzo respiratorio, con un trigger che dà inizio al respiro.
Il momento in cui termina l’ispirazione è determinato da criteri preset, come:
- un valore limite di pressione (es. in modalità pressometrica),
- un valore limite di flusso (es. in modalità pressione a flusso decrescente).
Dopo il raggiungimento del criterio, avviene un passaggio automatico all’espirazione passiva fino al valore di PEEP desiderato.
Tipi di ventilazione
- Modalità controllate
Il ventilatore “comanda” ogni respiro: non è richiesta alcuna partecipazione del paziente. Sono utilizzate in situazioni con anestesia profonda o paralisi e si distinguono in:- pressometrica controllata (PC);
- volumetrica controllata (VC);
- volumetrica garantita a pressione regolata (PRVC o VGRP), che unisce i vantaggi tra volume e pressione.
- Modalità assistite
Sono utilizzate quando il paziente conserva almeno un minimo di intervento respiratorio, e include la ventilazione a supporto pressometrico (PSV), la forma più comune in fase di svezzamento: è il paziente a innescare ogni respiro e riceve un aiuto pressorio prestabilito. - Modalità miste
Combinano elementi delle modalità sopra: il ventilatore assiste automaticamente finché il paziente mantiene un sufficiente drive respiratorio; in caso contrario, passa a una modalità controllata generale (es. SIMV, MMV).
Modalità di ventilazione
- Volumetrica: impone un volume corrente preciso, indipendentemente dalla pressione necessaria. Utile nei casi in cui è cruciale controllare il volume (es. traumi cranici, ipertensione intracranica), ma richiede allarmi per prevenire pressioni eccessive .
- Pressometrica: preimposta la pressione massima, lasciando che il volume vari in funzione della compliance polmonare. Previene il barotrauma, ma il volume erogato potrebbe non essere sempre sufficiente.
Complicanze della ventilazione invasiva
La ventilazione invasiva, nonostante la sua efficacia, può causare una serie di complicanze che richiedono una attenta prevenzione e gestione clinica.
Ventilator-Induced Lung Injury (VILI)
Il VILI rappresenta l’insieme delle lesioni polmonari indotte dalla ventilazione meccanica. Tra le principali componenti si distinguono:
- volutrauma, dovuto alla sovradistensione alveolare provocata da volumi correnti elevati;
- barotrauma, causato da pressioni troppo alte, che può portare a pneumotorace, pneumomediastino ed enfisema sottocutaneo. Studi indicano una prevalenza fino al 3% nei pazienti ventilati, con aumento della mortalità fino al 51% rispetto al 39% nei non complicati. La prevenzione si basa su impostazioni protettive, limitando pressione e volume tidal;
- atelettotrauma, da ciclico collasso e riapertura alveolare;
- biotrauma, con rilascio di mediatori pro-infiammatori verso il circolo sistemico, potenzialmente dannosi sia a livello polmonare che extrapolmonare.
Numerosi studi, incluse evidenze da modelli animali e trial clinici, raccomandano di mantenere il volume corrente inferiore a 6–8 mL/kg di peso ideale e la plateau pressure sotto i 30 cmH₂O, per ridurre significativamente il rischio di lesioni polmonari.
Polmonite associata al ventilatore (VAP) e Ventilator-Associated Events (VAE)
La presenza di un tubo endotracheale favorisce la colonizzazione da patogeni Gram-negativi (quali Pseudomonas, Klebsiella) e Gram-positivi resistenti. La VAP, particolarmente grave, può avere una mortalità attribuibile fino al 10%, prolungando la ventilazione e la degenza in ICU. Le compressioni ventilatorie associate, definite VAE, includono:
- VAC (ventilator-associated conditions): aumento stabile della FiO₂ o PEEP;
- IVAC: aggiunta di segni infettivi;
- VAP vera e propria, con infiltrati e sintomi clinici suggestivi.
Effetti sistemici e su altri organi
L’uso di pressioni toraciche positive può ridurre il ritorno venoso, causando ipotensione. Inoltre, la ventilazione può indurre:
- riduzione della clearance mucociliare;
- produzione di radicali liberi e danno endoteliale;
- sviluppo di fibrosi polmonare post-VILI;
- debolezza muscolare respiratoria per decondizionamento .
Neonati prematuri ventilati a lungo possono sviluppare displasia broncopolmonare, dovuta a vulnerabilità polmonare e carenza di surfattante.
Strategie di prevenzione
Per minimizzare le complicanze, si adottano le seguenti misure:
- ventilazione protettiva: volumi tidal 6 mL/kg peso ideale, PEEP ottimale, plateau < 30 cmH₂O;
- approcci di “open-lung”: combinazione di bassi volumi e PEEP per mantenere reclutati gli alveoli;
- sedazione minimizzata e weaning precoce per ridurre i giorni di ventilazione;
- bundle preventivi per VAP: posizione semi-seduta, igiene orale, aspirazione secrezioni subglottiche.
La ventilazione invasiva è una terapia salvavita, ma comporta rischi significativi. Un approccio basato su protocolli rigorosi, ventilazione protettiva, monitoraggio delle pressioni, sedazione controllata, strategie anti-VAP, consente di minimizzare le complicazioni, migliorare lo stato naturo polmonare e garantire migliori outcome clinici.
Fonte: Manuale di anestesia e rianimazione. Concorso Nazionale SSM.