L’antigene di membrana specifico della prostata (PSMA: Prostate-Specific Membrane Antigen) è una glicoproteina transmebrana espressa sulla superficie cellulare del tessuto prostatico ed è sovraespressa nel carcinoma prostatico. Si tratta di una glicoproteina transmembrana di tipo II codificata dal gene folate hydrolase 1 (FOLH1), noto anche come glutamate carboxypeptidase II (GCPII). L’espressione del PSMA sembra aumentare progressivamente nei tumori di grado più elevato, in condizioni di deprivazione androgenica e nelle forme ormono-refrattarie e metastatiche.
Il PSMA è stato identificato come bersaglio nel carcinoma prostatico circa tre decenni fa, quando furono sviluppati i primi anticorpi contro il suo dominio intracellulare.
Un primo approccio consistette nel radiomarcaggio dell’anticorpo capromab con indio-111 (¹¹¹In). Sebbene questo agente fosse approvato dalla Food and Drug Administration (FDA) statunitense, la sua utilità era limitata dal basso uptake dell’anticorpo, dal suo legame con il dominio intracellulare piuttosto che extracellulare del PSMA, e dalla limitata specificità della tomografia a emissione di singolo fotone (SPECT) per la rilevazione, nell’epoca antecedente l’introduzione della SPECT/TC ibrida.
Negli ultimi anni, lo scenario dei radiofarmaci disponibili per l’imaging del carcinoma prostatico è cambiato rapidamente. Tra questi, le piccole molecole che si legano al sito attivo extracellulare del PSMA sono le più promettenti come nuovo standard di riferimento. Rispetto agli anticorpi, presentano i vantaggi di una maggiore affinità di legame, internalizzazione e rapida clearance plasmatica.
Nel 2013, il gruppo di Heidelberg in Germania pubblicò la prima serie di casi clinici con gallio-68 (⁶⁸Ga)-PSMA-11, dimostrando un elevato contrasto tumore/fondo. Il ⁶⁸Ga-PSMA-11 è anche noto nella letteratura come ⁶⁸Ga-PSMA-HBED-CC, ⁶⁸Ga-HBED-PSMA, e ⁶⁸Ga-DKFZ-PSMA-11, ed è attualmente l’agente più utilizzato per la PET con PSMA.
Esso è sintetizzato marcando il precursore PSMA-11 utilizzando come chelante l’acido N,N-bis(2-idrossibenzil)etilendiammin-N,N-diacetico (HBED) con il ⁶⁸Ga. La sintesi può essere effettuata tramite tecniche manuali, semiautomatiche o completamente automatizzate. Il ⁶⁸Ga è un emettitore di positroni con un’emivita breve di 68 minuti. Viene eluato da un generatore di germanio-68 (⁶⁸Ge)/⁶⁸Ga, un piccolo dispositivo con una durata di utilizzo di 6–12 mesi.
Altri radiofarmaci per la PET con PSMA includono:
- ⁶⁸Ga-PSMA-I&T;
- ⁶⁸Ga-THP-PSMA;
- Fluoro-18 (¹⁸F)–DCFPyL;
- ¹⁸F-PSMA-1007.
Questi presentano una biodistribuzione simile ma possono differire per affinità di legame e uptake aspecifico, il che limita i confronti diretti nella valutazione dei cambiamenti nel tempo.
Now loading…
Procedura di imaging, dosimetria delle radiazioni e biodistribuzione
Si raccomanda una dose di radiofarmaco aggiustata per il peso corporeo di 1,8–2,2 MBq/kg, con possibili variazioni dovute all’eluizione variabile durante la vita utile del generatore ⁶⁸Ge/⁶⁸Ga. L’imaging viene effettuato circa 45–75 minuti dopo la somministrazione del radiofarmaco. Il paziente dovrebbe essere ben idratato e urinare immediatamente prima dell’inizio della scansione. Le immagini PET dovrebbero essere acquisite dalla pelvi verso la testa, per minimizzare errori di registrazione tra la componente TC o risonanza magnetica (RM) e la componente PET dello studio, dovuti al riempimento vescicale durante l’acquisizione.
I protocolli di acquisizione TC e RM variano notevolmente tra le varie strutture.
Il ⁶⁸Ga-PSMA-11 è somministrato in dosi nell’ordine dei microgrammi e non sono stati riportati effetti farmacologici o avversi.
L’uso del ⁶⁸Ga-PSMA-11 comporta un’esposizione alle radiazioni relativamente bassa grazie alla breve emivita del ⁶⁸Ga. L’iniezione di un radiofarmaco per ottenere 150 MBq produce una dose efficace mediana di soli 2,4 mSv. L’esposizione aggiuntiva alle radiazioni legata alla TC in un esame PET/TC ibrido dipende dal protocollo utilizzato.
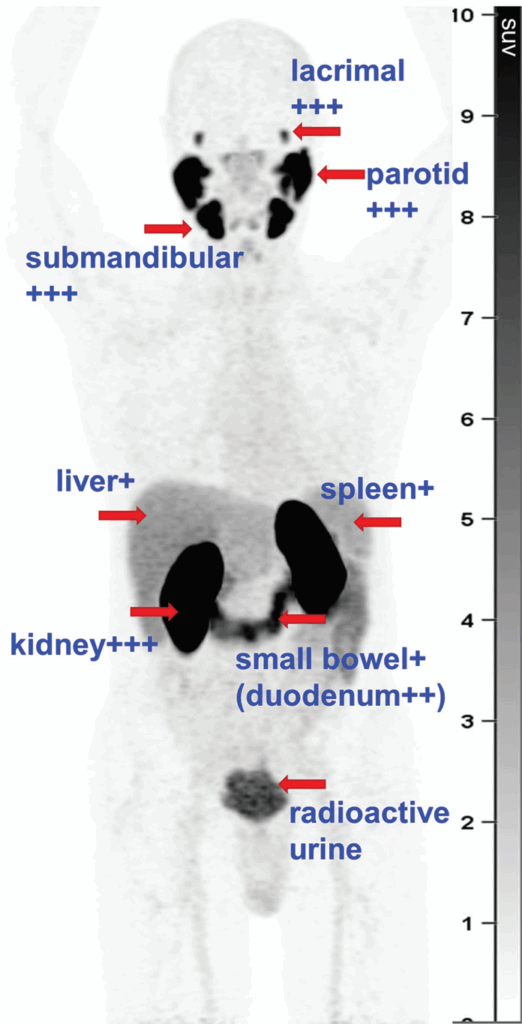
La biodistribuzione fisiologica normale del ⁶⁸Ga-PSMA-11 alla PET rispecchia l’espressione del PSMA nei tessuti normali e la via di escrezione del radiofarmaco. L’uptake di maggiore intensità si osserva nei reni, ureteri e vescica, poiché il composto è escreto per via renale. L’elevata attività urinaria nei reni e nella vescica può causare un artefatto di “alone” nelle immagini PET/TC e PET/RM, e in alcuni casi può essere necessario applicare metodi di ricostruzione alternativi per superare il problema.
Gli artefatti da alone, così come l’elevata attività urinaria, possono ostacolare la valutazione dei linfonodi addominali e pelvici vicini all’uretere o situati nella prostata o in loggia prostatica. Diverse tecniche possono essere utili per differenziare l’attività urinaria fisiologica da un uptake patologico, tra cui:
- somministrazione di furosemide;
- ritardo nell’acquisizione delle immagini;
- impiego di mezzo di contrasto endovenoso in fase urografica tardiva.
Si osserva intenso uptake anche nelle ghiandole lacrimali, parotidi e sottomandibolari. Il meccanismo esatto dell’uptake non è ancora del tutto chiaro, ma probabilmente riflette una combinazione di escrezione aspecifica e espressione del PSMA in questi tessuti. Come accade con lo iodio radioattivo, anche il ⁶⁸Ga-PSMA-11 viene escreto nella saliva, il che può determinare uptake a livello orofaringeo, laringeo o esofageo.
Un uptake ad alta intensità può essere visibile anche a livello dell’intestino tenue, principalmente nel duodeno, dove l’espressione del PSMA potrebbe facilitare l’assorbimento dei folati alimentari. Si osserva un uptake di intensità moderata nel fegato e nella milza.
In genere i valori medi di SUV in ordine decrescente sono:
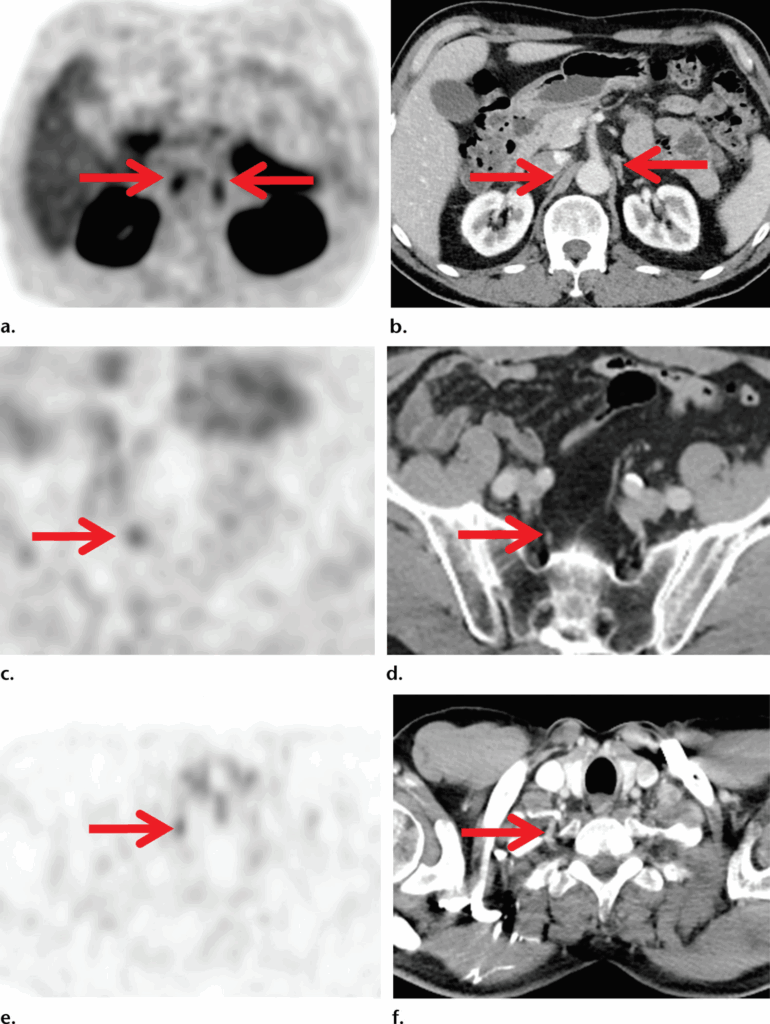
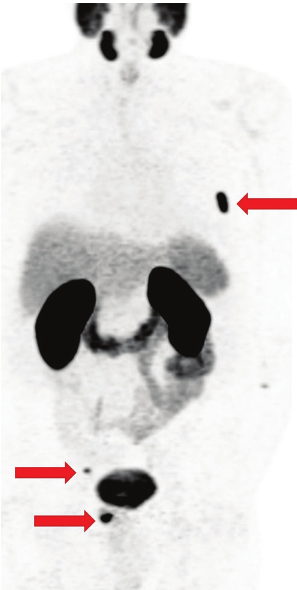
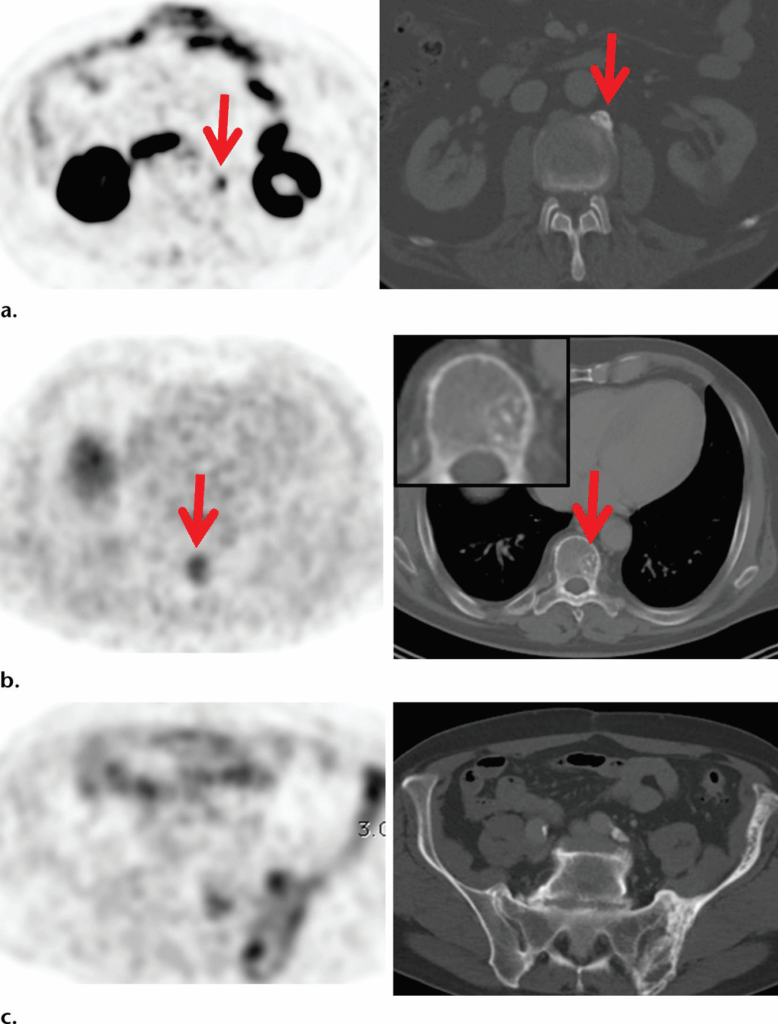
Le immagini PET assiali con PSMA mostrano un tenue uptake (frecce) nei gangli celiaci (a), nel ganglio presacrale (c) e nel ganglio stellato (e).
Le immagini TC assiali corrispondenti (b, d, f) mostrano che le strutture evidenziate (frecce) hanno dimensioni inferiori al centimetro, con un aspetto lineare a virgola.
Tuttavia, a differenza del range fisiologico ristretto di uptake epatico o in altri organi osservato nella PET/TC con ¹⁸F-FDG, la PET con ⁶⁸Ga-PSMA-11 mostra una variabilità fisiologica molto più ampia nei vari organi.
Un basso uptake di PSMA si osserva anche nei gangli parasimpatici, più comunemente nei gangli celiaci e stellati, ma può presentarsi anche in altre sedi, come i gangli presacrali.
La conoscenza delle sedi anatomiche dei gangli, associata al pattern di uptake (tipicamente lineare anziché focale), all’intensità (in genere bassa piuttosto che elevata) e all’aspetto anatomico (forma a “ghiandola surrenale” o “virgola”), aiuta a identificare questa variante fisiologica.
La prossimità di questi gangli a siti linfonodali potenzialmente coinvolti li rende una possibile fonte di falsi positivi. Questi gangli non erano generalmente visibili con le tecniche di imaging anatomico prima della diffusione della PET con ⁶⁸Ga-PSMA-11, ma oggi, grazie all’esperienza, sono facilmente riconoscibili.
La frequenza di visualizzazione dei gangli dipende dal tipo di scanner PET/TC e dal metodo di ricostruzione utilizzato. I dispositivi di nuova generazione sono in grado di rilevare lesioni più piccole, soprattutto quelli dotati di time-of-flight e point-spread function, che aumentano il contrasto nelle strutture di piccole dimensioni.
Caricamento….
Indicazioni cliniche nel carcinoma della prostata
Le potenziali indicazioni per l’utilizzo della PET/TC con ⁶⁸Ga-PSMA-11 sono riassunte nella seguente tabella.
| Beneficio | Indicazione |
|---|
| Alto beneficio stimato o guadagno diagnostico | Stadiazione primaria nei pazienti ad alto rischio secondo la classificazione di D’Amico; recidiva biochimica con valori bassi di PSA (0,2–10 ng/mL) |
| Basso beneficio stimato o guadagno diagnostico | Stadiazione primaria nei pazienti a basso e intermedio rischio secondo la classificazione di D’Amico |
| Applicazione potenziale con dati preliminari promettenti | Guida alla biopsia dopo pregressa biopsia negativa, ma con alta sospetto di carcinoma prostatico (specialmente in combinazione con MRI multiparametrica mediante PET/RM) |
| Applicazione potenziale con attuale mancanza di dati pubblicati | Monitoraggio del trattamento sistemico nel carcinoma prostatico metastatico resistente alla castrazione o sensibile alla castrazione; Sorveglianza attiva (specialmente in combinazione con risonanza magnetica multiparametrica mediante PET/RM); Monitoraggio del trattamento nei pazienti con carcinoma prostatico metastatico resistente alla castrazione sottoposti a terapia con radioligando mirata al PSMA (es. 177Lu-PSMA) |
Stadiazione iniziale del carcinoma prostatico
Le attuali linee guida internazionali raccomandano l’uso di TC, scintigrafia ossea o risonanza magnetica soltanto nei pazienti ad alto rischio. Esistono diversi approcci per la valutazione del rischio. La classificazione più comune è quella di D’Amico, che definisce ad alto rischio un paziente con:
- PSA > 20 ng/mL;
- Gleason score > 8;
- Stadio clinico T2c o T3a.
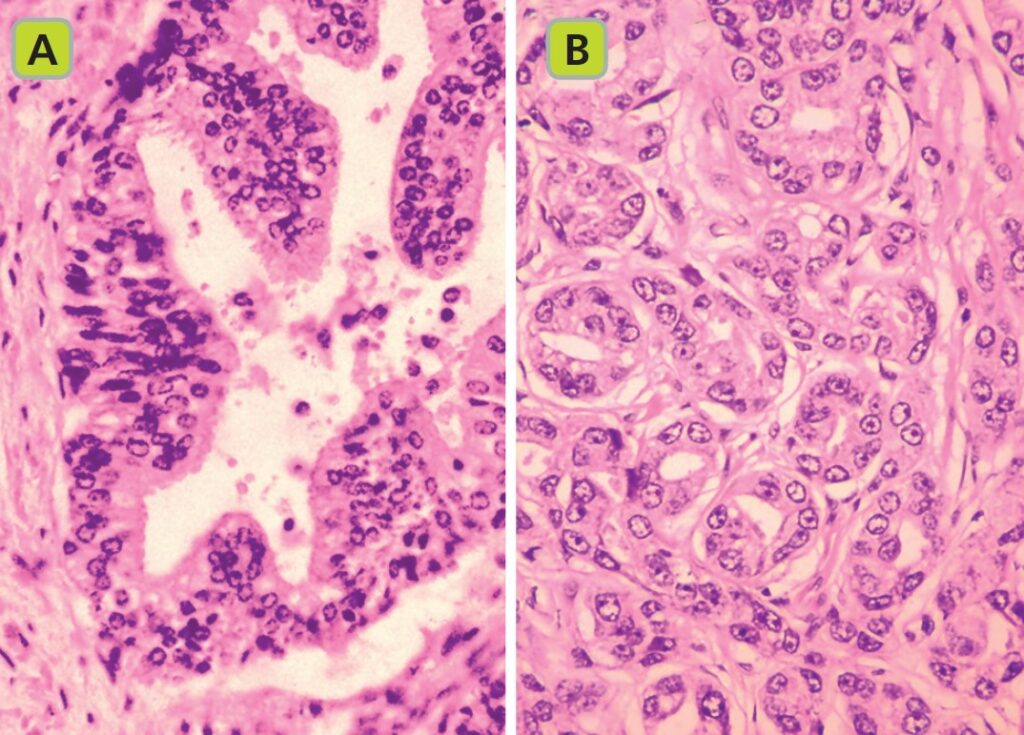
Il Gleason Score classifica cinque pattern istologici in base al grado di differenziazione, da quello più differenziato (score 1) a quello meno differenziato (score 5). Il punteggio assegna un grado primario al pattern dominante e un grado secondario al secondo pattern più rappresentato.
Recentemente, è stato adottato un nuovo sistema a cinque gruppi di rischio basato sul Gleason, con una stratificazione prognostica superiore. Questo sistema separa in due entità di rischio distinte:
- Gleason 3+4 (gruppo di grado 2);
- Gleason 4+3 (gruppo di grado 3).
I gruppi di grado 3 e superiori sono considerati ad alto rischio.
La superiore accuratezza della PET con PSMA rispetto all’imaging convenzionale nella stadiazione dei pazienti ad alto rischio può permettere l’identificazione di malattia metastatica a distanza occulta, non rilevabile con le tecniche standard, e potrebbe facilitare approcci terapeutici multimodali personalizzati, specialmente in presenza di malattia oligometastatica.
In alcuni casi, i reperti della PET con PSMA possono essere utilizzati per declassare (downstage) pazienti che erano stati erroneamente classificati come metastatici sulla base dell’imaging convenzionale.
Diversi studi hanno confrontato la PET con ⁶⁸Ga-PSMA-11 con l’imaging convenzionale o con l’analisi istopatologica dopo dissezione dei linfonodi pelvici.
L’esperienza in evoluzione e la letteratura suggeriscono che la PET con ⁶⁸Ga-PSMA-11 ha una maggiore sensibilità e specificità rispetto alla scintigrafia ossea. Tuttavia, in assenza di dati di alta qualità, è difficile quantificare la precisione incrementale rispetto a quella dell’imaging convenzionale.
La maggiore accuratezza diagnostica della PET con 68Ga-PSMA-11 sta rivoluzionando la comprensione dei pattern di diffusione del carcinoma prostatico. Questo esame di imaging molecolare offre una sensibilità senza precedenti nel rilevare sia la malattia locoregionale che le metastasi a distanza.
Per quanto riguarda la diffusione linfonodale, i criteri di classificazione distinguono tra linfonodi regionali e non regionali. I linfonodi pelvici, inclusi quelli iliaci interni/esterni, otturatori, mesorettali e presacrali, rappresentano il drenaggio linfatico primario e sono classificati come N0/N1 secondo lo staging AJCC. La distribuzione delle metastasi linfonodali tipicamente rispecchia la lateralizzazione del tumore primario prostatico.
Una sfida clinica significativa è rappresentata dalla localizzazione intraoperatoria dei linfonodi metastatici subcentimetrici identificati alla PET.
Le metastasi linfonodali a distanza (M1a) seguono pattern di diffusione peculiari. Oltre ai classici siti di metastatizzazione (inguinali, iliaci comuni, paraaortici), sono stati descritti casi di drenaggio diretto verso i linfonodi para-aortici lungo il decorso dei vasi gonadici, bypassando completamente il bacino linfatico pelvico. Particolarmente interessante è la frequente localizzazione sovraclaveare, che riflette il drenaggio linfatico verso il termine del dotto toracico sinistro (linfonodo di Virchow).
Nella malattia metastatica ossea (M1b), la PET/CT con PSMA dimostra una sensibilità superiore rispetto alle metodiche convenzionali. Mentre le lesioni osteoblastiche sono tipiche delle forme ben differenziate, i tumori ad alto grado possono manifestarsi con pattern osteolitici o lesioni PET-positive ma TC-negative. Questa discrepanza imaging-anatomia sottolinea l’importanza dell’imaging molecolare nella stadiazione accurata.
Per le metastasi viscerali (M1c), la tecnica si è rivelata particolarmente efficace nel rilevare localizzazioni atipiche a polmoni, fegato, pleura, surreni e cervello. Tuttavia, l’interpretazione richiede cautela, specialmente per le lesioni polmonari di piccole dimensioni, dove gli artefatti da movimento respiratorio possono ridurre l’apparente intensità di captazione.
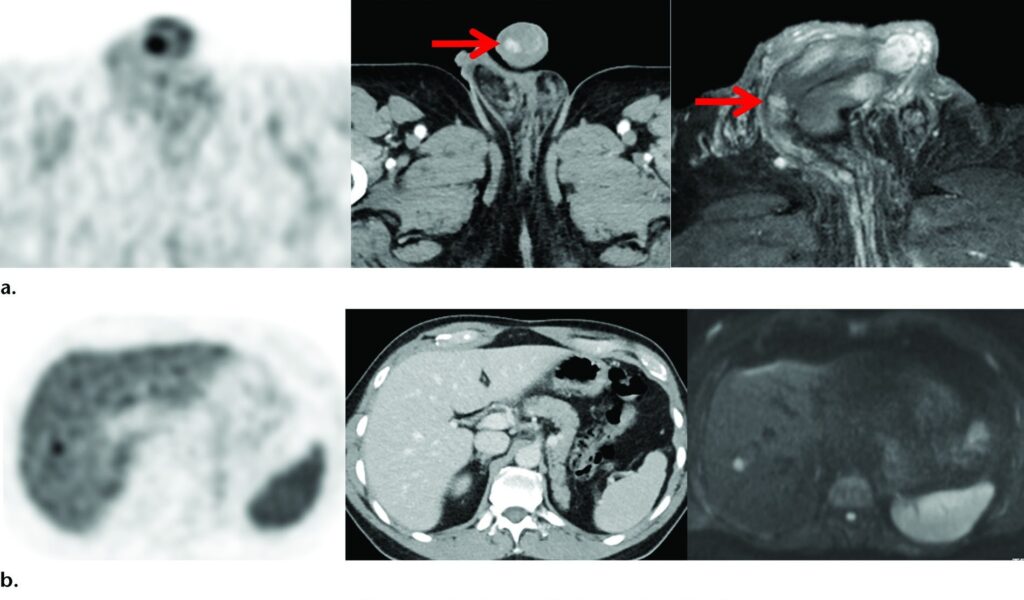
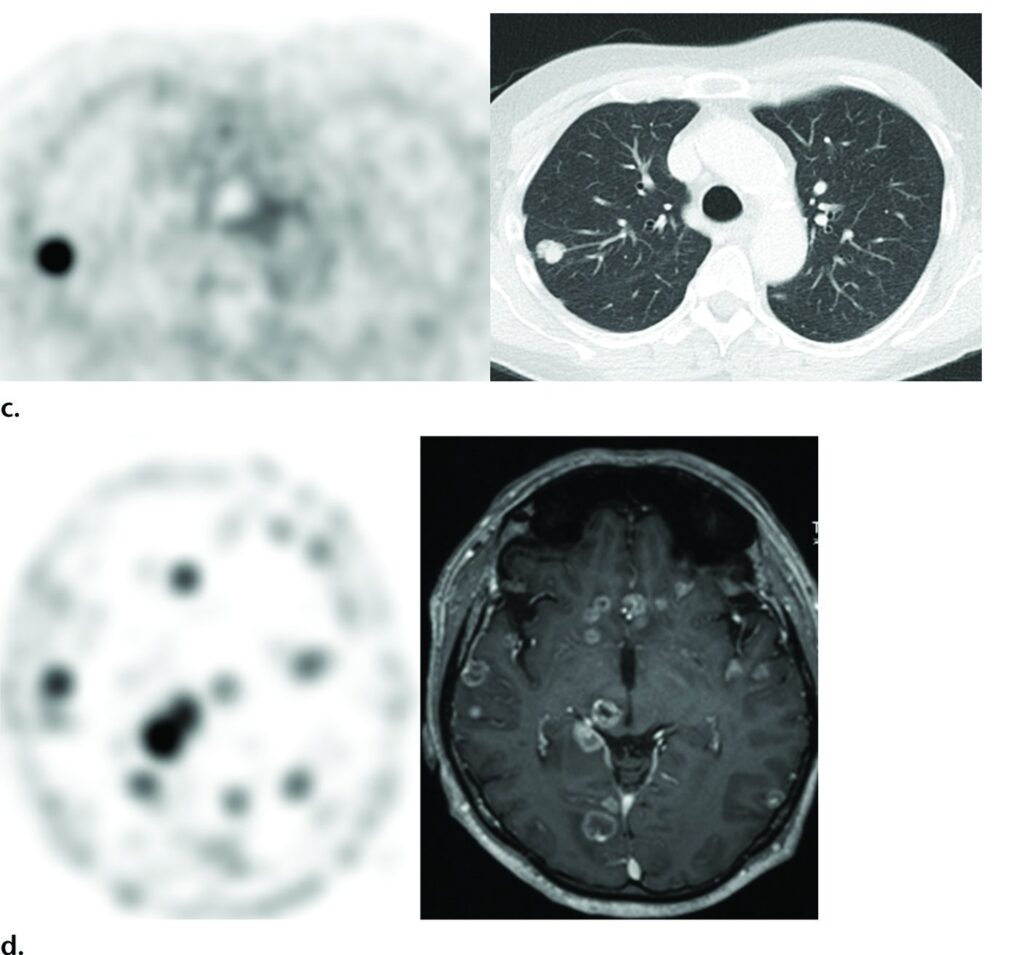
Metastasi viscerali sottocentrimetriche in quattro pazienti diversi osservate nelle immagini PET con ⁶⁸Ga-PSMA-11 (prima immagine di ogni riga), con immagini TC e/o RM correlate. Le immagini mostrano metastasi peniena (frecce) (a), metastasi epatica (b), metastasi polmonare (c) e metastasi cerebrali (d).
Questi avanzamenti diagnostici stanno ridefinendo i paradigmi di trattamento, permettendo una più precisa stratificazione del rischio e l’identificazione di pazienti candidati a terapie mirate. La correlazione tra i reperti PET/CT e i dati istopatologici continua a fornire preziose informazioni sulla biologia metastatica del carcinoma prostatico, con importanti implicazioni per la pratica clinica.
Localizzazione del tumore intraprostatico
Numerosi studi recenti hanno esaminato il ruolo della PET con 68Ga-PSMA-11 nella localizzazione intraparenchimale del carcinoma prostatico. Una ricerca significativa ha dimostrato differenze marcate nell’uptake del tracciante tra aree tumorali e tessuto sano, con valori medi di SUVmax rispettivamente di 11.8 vs 4.9. Lo studio propone una soglia ottimale di SUVmax a 6.5, che offre una sensibilità del 67% e una specificità del 92% nell’identificazione dei segmenti prostatici coinvolti.
Emergono evidenze preliminari sul valore complementare della PET/PSMA rispetto alla risonanza magnetica multiparametrica standard. Uno studio comparativo su 53 pazienti a rischio intermedio-alto ha rivelato differenze significative nella performance diagnostica: mentre la risonanza magnetica con criteri PI-RADS mostrava una sensibilità del 43%, la PET con 68Ga-PSMA-11 raggiungeva il 64%. L’approccio combinato PET/RM, che integra i dati funzionali della PET con le informazioni multiparametriche della risonanza, ha ulteriormente incrementato la sensibilità al 76%.
Queste osservazioni aprono interessanti prospettive per il miglioramento delle strategie diagnostiche. Restano tuttavia da definire i protocolli ottimali per l’integrazione dei reperti PET e RM nella pratica clinica, particolarmente nell’ambito delle biopsie mirate e del monitoraggio in sorveglianza attiva. La ricerca futura dovrà chiarire come combinare al meglio queste tecniche avanzate per massimizzare l’accuratezza diagnostica e personalizzare gli approcci terapeutici.
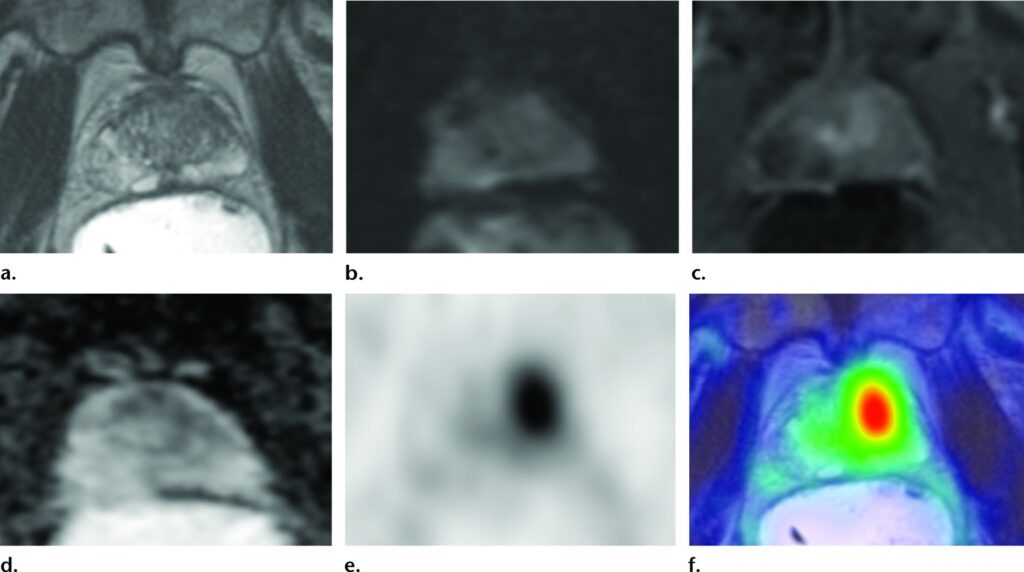
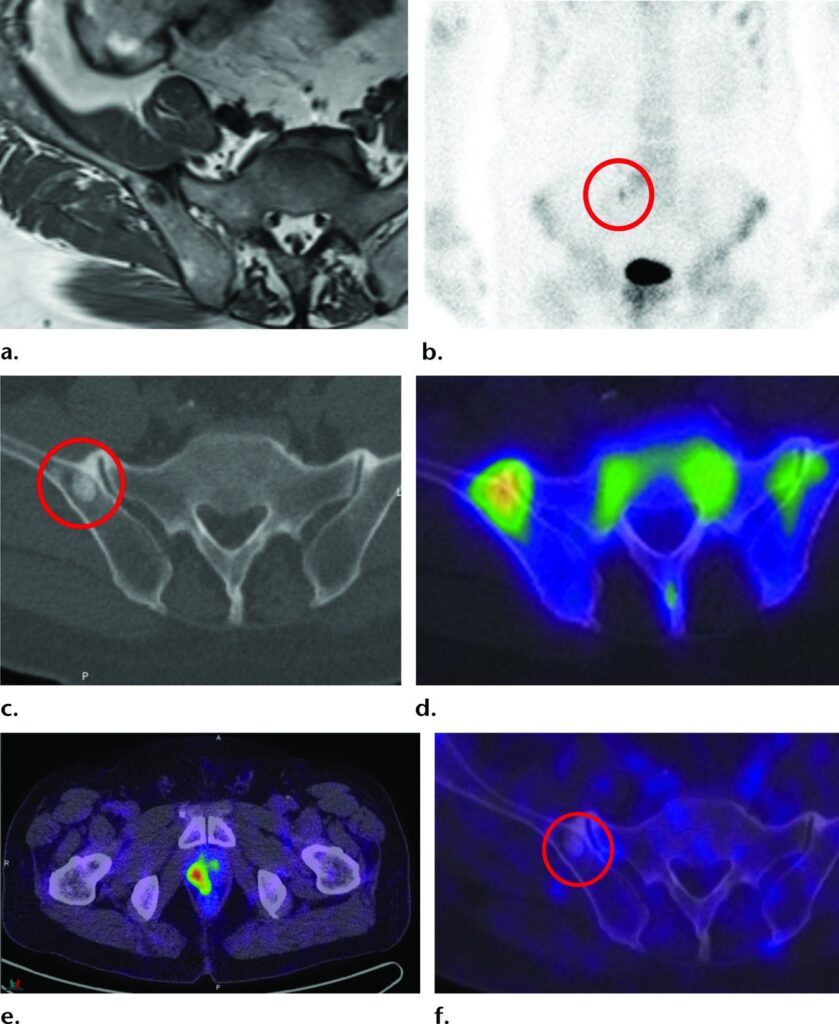
Imaging PET/RM con ⁶⁸Ga-PSMA-11 in un uomo di 63 anni con PSA in continuo aumento fino a 9,4 ng/mL, ma con precedenti biopsie prostatiche negative.
Le immagini RM multiparametriche hanno indicato che il punteggio massimo secondo il sistema PI-RADS era 3, attribuito a una lesione nel lobo medio sinistro della prostata.
Le immagini PET con ⁶⁸Ga-PSMA-11 (e) e PET/TC (f) mostrano un aumento marcato del uptake del tracciante nella regione corrispondente.
Una successiva biopsia mirata ha rivelato un carcinoma prostatico Gleason 4+3.
Recidiva biochimica
Nonostante l’intervento chirurgico o la radioterapia a intento curativo, esiste un rischio significativo di recidiva della malattia, che viene solitamente rilevata da un aumento del livello di PSA.
Dopo prostatectomia radicale, la recidiva biochimica è attualmente definita come un valore di PSA > 0,2 ng/mL che aumenta in almeno due misurazioni consecutive a distanza di almeno 3 settimane.
Dopo radioterapia con fasci esterni, è richiesto un aumento di almeno 2,0 ng/mL rispetto al nadir del PSA, che si verifichi oltre 6 settimane dopo il completamento del trattamento.
Tuttavia, a questi bassi livelli di PSA, l’imaging convenzionale ha una capacità limitata di rilevare la recidiva e pertanto non è raccomandato.
Dopo prostatectomia radicale, la recidiva biochimica viene generalmente trattata in modo empirico con radioterapia di salvataggio al letto prostatico, sebbene questo trattamento fallisca in una percentuale significativa di pazienti.
Esiste oggi una vasta letteratura che dimostra la elevatissima sensibilità della PET/TC con PSMA nel contesto della recidiva biochimica, anche in pazienti con bassi livelli di PSA, nei quali l’imaging convenzionale ha una sensibilità molto bassa.
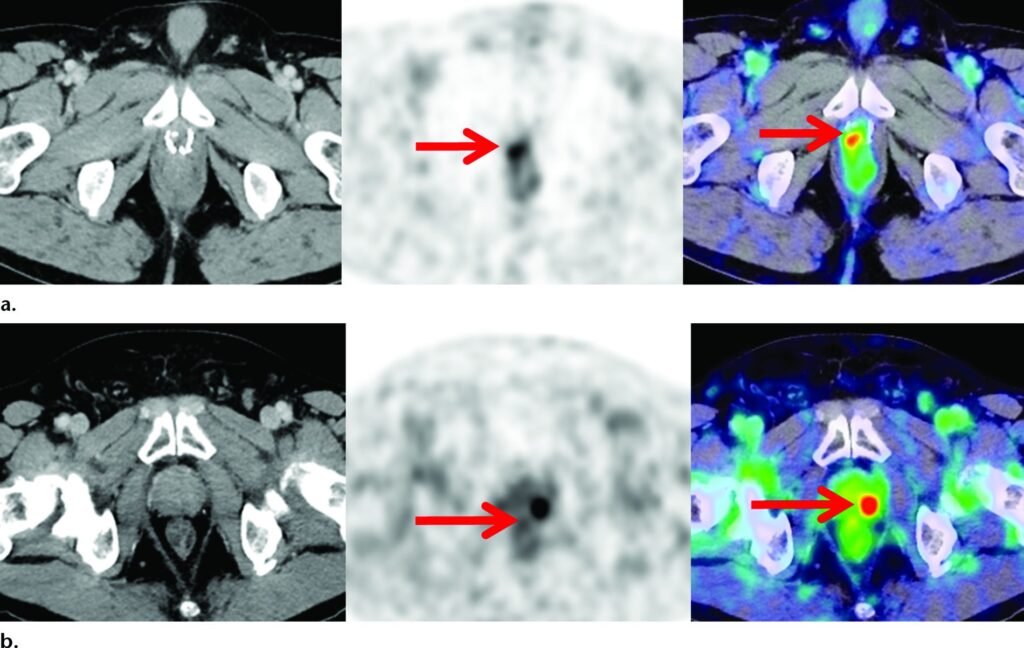
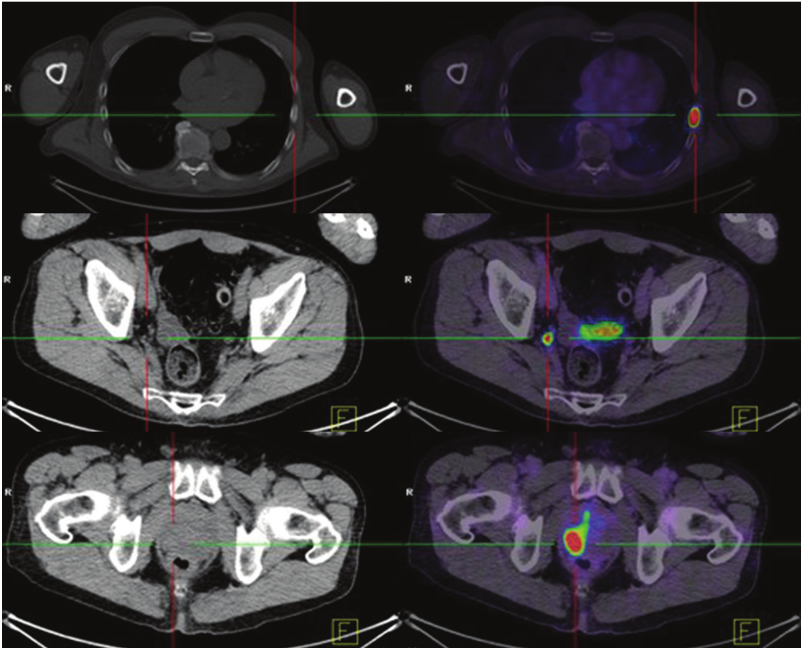
Recidiva biochimica in due pazienti con livelli di PSA in aumento (<1,0 ng/mL).
Le immagini assiali TC (a sinistra), PET (al centro) e PET/TC (a destra) in un paziente sottoposto a precedente prostatectomia radicale (a) e in un paziente trattato con radioterapia esterna (b) mostrano una recidiva localizzata (frecce) nel letto prostatico.
Non vi era evidenza di malattia metastatica a distanza in nessuno dei due pazienti. I riscontri sono stati confermati tramite biopsia in entrambi i casi.
Una meta-analisi di questi studi ha mostrato tassi di rilevazione del 48% a un PSA di 0,2 ng/mL, che aumentano al 56% e al 70% con valori di PSA rispettivamente di 0,5 e 1,0 ng/mL. Questi tassi sono significativamente superiori rispetto a quelli ottenuti con PET/TC con colina o con imaging convenzionale.
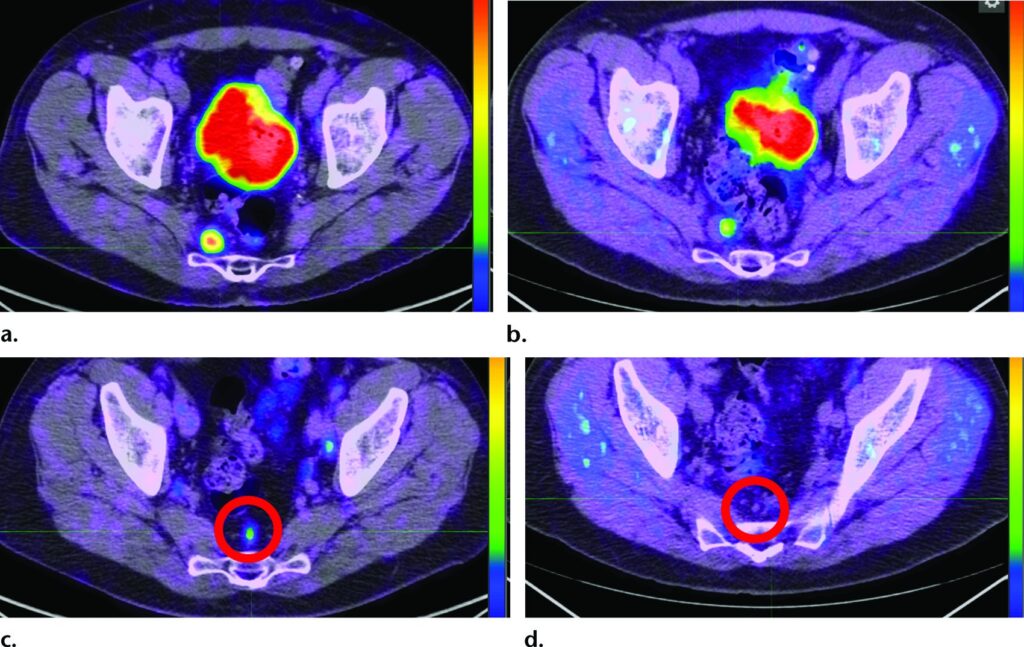
Confronto tra PET/TC con ⁶⁸Ga-PSMA-11 e PET/TC con ¹⁸F-fluorocolina (FCH).
L'immagine assiale PET/TC con ⁶⁸Ga-PSMA-11 (a) mostra un elevato uptake in un linfonodo presacrale (SUVmax=17), rispetto all'immagine PET con ¹⁸F-FCH (b), che mostra un SUVmax di 3,5.
L'immagine assiale PET con ⁶⁸Ga-PSMA-11 (c) mostra chiaramente un linfonodo aggiuntivo di 3 mm con uptake focale (cerchio). Nessuna anomalia visibile (cerchio) è presente sull’immagine assiale PET con ¹⁸F-FCH (d).
In un confronto intraindividuale, la PET/TC con ⁶⁸Ga-PSMA-11 ha mostrato un SUV più elevato rispetto alla PET/TC con ¹¹C-colina o ¹⁸F-colina nel 79% delle lesioni.
La PET con PSMA è in grado di rilevare piccole metastasi linfonodali; uno studio ha riportato che il 78% dei linfonodi avidi per PSMA aveva dimensioni < 8 mm.
La PET con PSMA ha dimostrato un impatto significativo nella gestione dei pazienti con PSA tra 0,05 e < 1,0 ng/mL dopo prostatectomia radicale candidati a radioterapia di salvataggio.
Rispetto alla radioterapia cieca al letto prostatico, la PET con ⁶⁸Ga-PSMA-11 ha modificato la gestione nel 29% dei pazienti, localizzando lesioni in linfonodi regionali o ossa che non sarebbero state incluse nel campo convenzionale di radioterapia di salvataggio.
L’uso della PET con PSMA nel contesto della recidiva biochimica con basso PSA aiuta spesso a identificare pazienti con malattia oligometastatica, trattabili con radioterapia stereotassica o chirurgia di salvataggio.
Tuttavia, mancano attualmente dati di alta qualità che dimostrino un miglioramento degli esiti clinici con l’uso della PET con PSMA in questo contesto.
Va inoltre sottolineato il possibile rischio che trattamenti precoci possano causare più danni che benefici, poiché gli effetti a lungo termine su sopravvivenza libera da progressione e sopravvivenza globale sono ancora incerti.
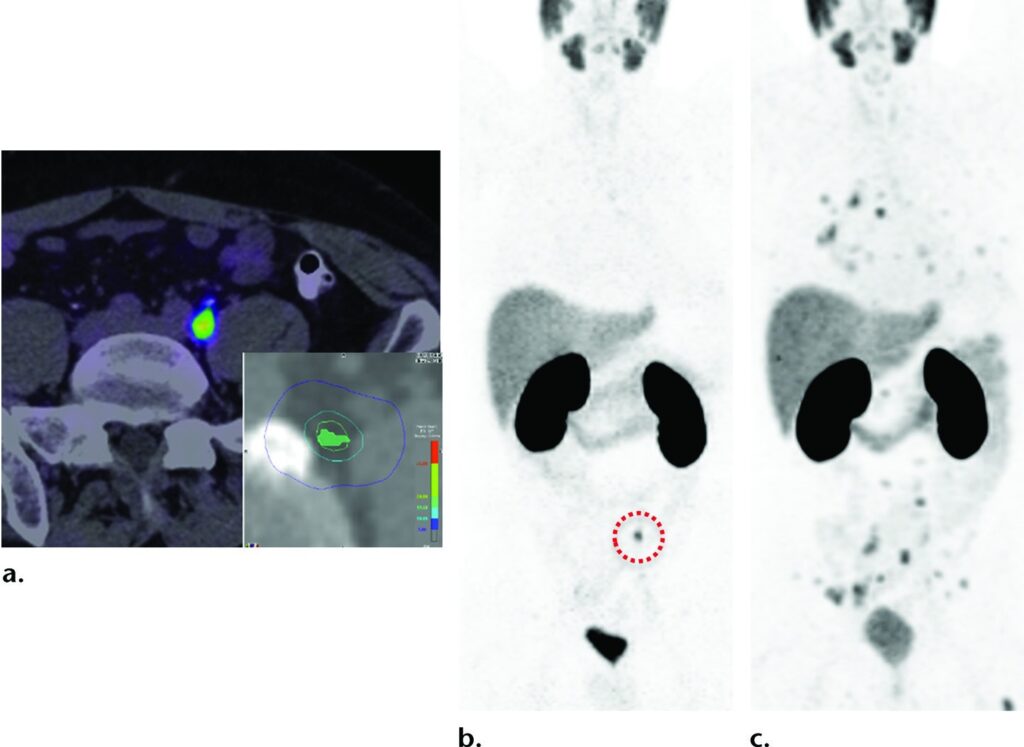
Sulla base dei risultati dell’imaging convenzionale, le opzioni gestionali previste erano osservazione o terapia ormonale.
Le immagini assiali PET/TC con PSMA (a) e coronale (b) mostrano una singola metastasi linfonodale di 8 mm nella regione iliaca comune sinistra (cerchio tratteggiato in b).
Dopo l’identificazione della malattia oligometastatica, le opzioni terapeutiche aggiuntive includevano chirurgia o radioterapia.
Il paziente è stato sottoposto a radioterapia stereotassica (nel riquadro in a è mostrato il piano di trattamento).
L’immagine coronale PET con PSMA (c) eseguita per ristadiazione 3 mesi dopo mostra una malattia metastatica linfonodale e ossea diffusa.
Ristadiazione della malattia metastatica e selezione teranostica
Nei pazienti con carcinoma prostatico metastatico sottoposti a terapia sistemica, l’imaging convenzionale (come scintigrafia ossea, TC o RM), combinato con il valore di PSA e il quadro clinico, è attualmente utilizzato per la valutazione della risposta.
La scintigrafia ossea mostra la reazione osteoblastica alla metastasi come marcatore surrogato, a differenza della PET con PSMA, che visualizza direttamente il tumore prostatico.
Nel contesto della ristadiazione, distinguere una risposta terapeutica da una risposta di guarigione (flare) può essere difficile.
Per la malattia a carico dei tessuti molli, si utilizza generalmente la TC secondo i criteri RECIST (Response Evaluation Criteria in Solid Tumors) per una valutazione formale della risposta. Tuttavia, le lesioni bersaglio sottocentimetriche visibili con sicurezza alla PET/TC con PSMA non sono misurabili con la TC.
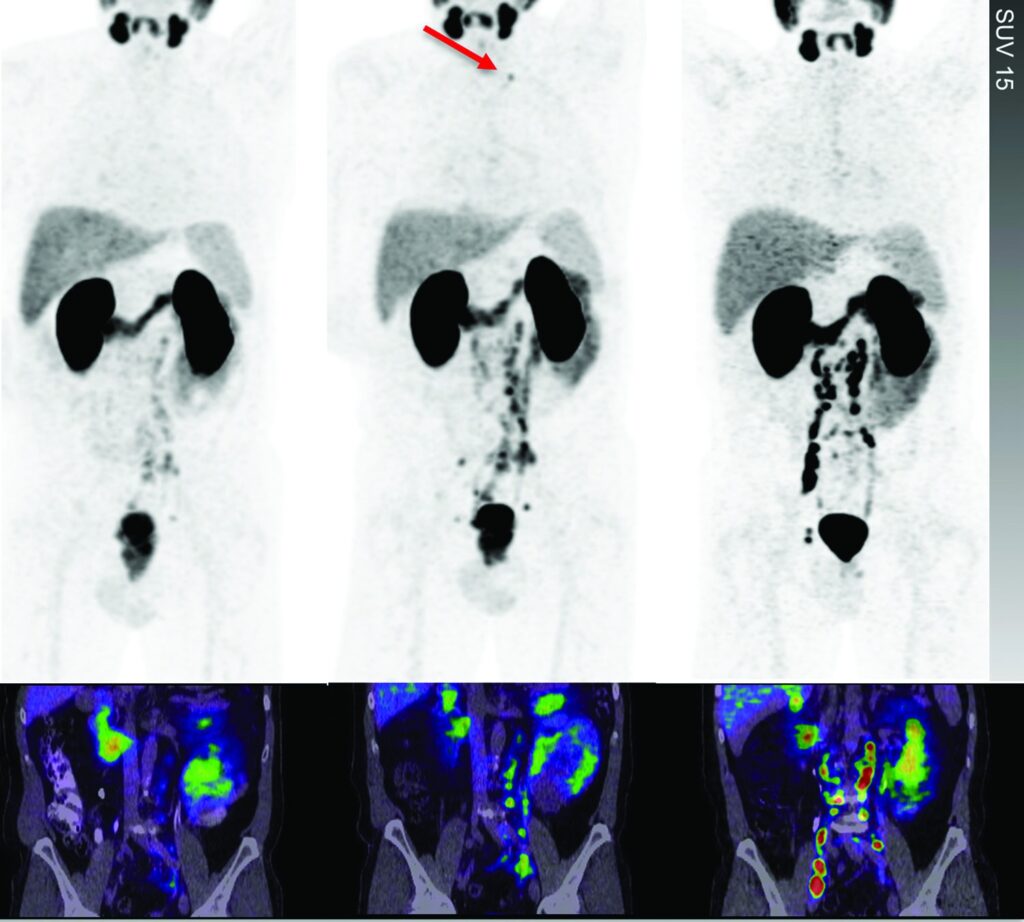
A sinistra: le immagini mostrano metastasi linfonodali pelviche e addominali a basso volume (sottocentimetriche).
Al centro: dopo 1 mese di osservazione, il PSA è salito a 89 ng/mL, e le immagini mostrano progressione della malattia a basso volume, con un nuovo linfonodo sopraclaveare sottocentimetrico (freccia).
A destra: l'inizio della terapia di deprivazione androgenica ha portato a una riduzione del PSA a 0,5 ng/mL, seguita però dallo sviluppo di resistenza alla castrazione con risalita del PSA a 15 ng/mL in 2 mesi.
Le immagini ripetute mostrano risposta in alcune sedi, ma un quadro complessivo di progressione di malattia.
Esistono comunque criteri consolidati, come i Prostate Working Group Criteria (PWGC), per l’interpretazione della risposta con scintigrafia ossea e TC.
La RM whole-body è sensibile nella rilevazione di metastasi ossee, ma le evidenze sul suo utilizzo nella valutazione della risposta sono molto limitate.
Poiché la PET con PSMA visualizza direttamente le cellule tumorali, i dati preliminari suggeriscono vantaggi significativi rispetto all’imaging convenzionale nella valutazione della risposta terapeutica.
La capacità di valutare la risposta locale nella prostata, nei tessuti molli e nelle metastasi ossee in un singolo esame rappresenta un grande vantaggio, anche se sono necessarie ulteriori ricerche per definire criteri di risposta specifici per la PET/TC con PSMA.
È necessaria cautela, poiché è stato osservato un aumento dell’intensità del tracciante PSMA poco dopo l’inizio della terapia ormonale, che può generare un fenomeno di “flare“.
Questo è supportato da dati preclinici che mostrano un aumento dell’espressione del PSMA dopo terapia di deprivazione androgenica.
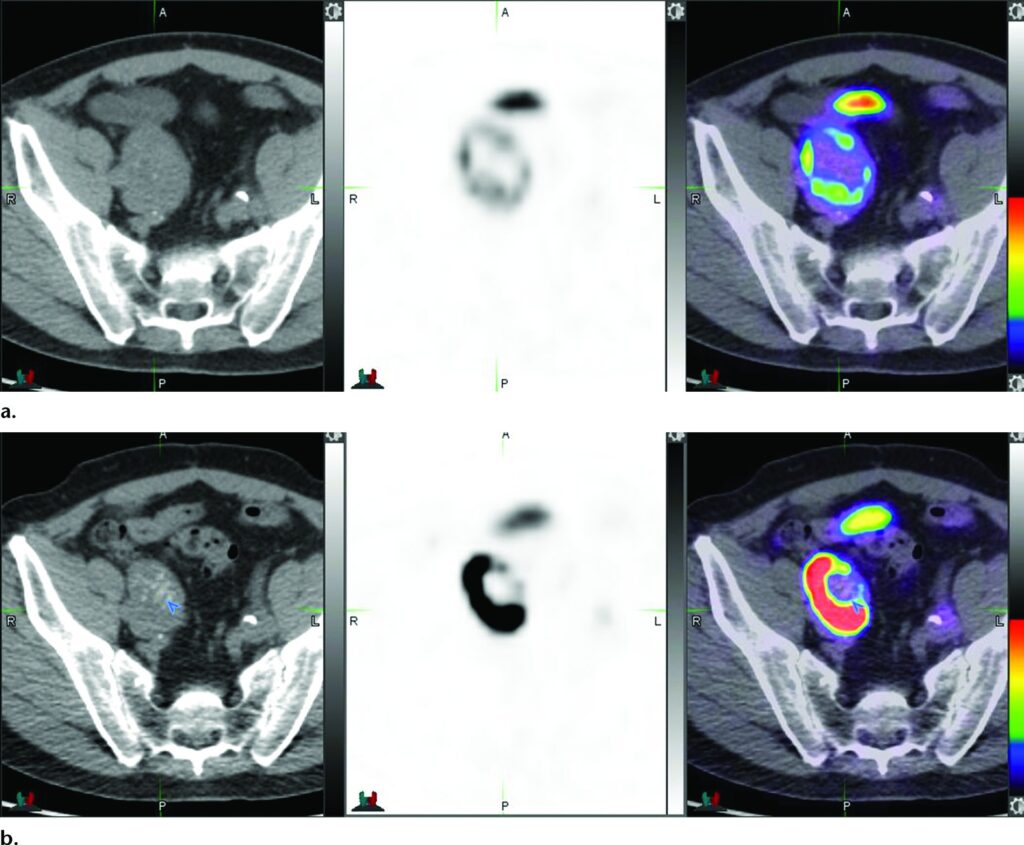
Le immagini assiali PET/TC con PSMA (a) mostrano un uptake moderato in un linfonodo iliaco esterno destro ingrandito (6,6 × 4,8 cm) con SUVmax=19. Il PSA del paziente era 0,21 ng/mL al momento dell’esame. È stata avviata la terapia di deprivazione androgenica.
Le immagini PET/TC assiali ripetute dopo 8 settimane (b) mostrano una rilevante riduzione delle dimensioni del linfonodo (4,8 × 3,8 cm), con progressiva calcificazione, ma un marcato aumento dell’intensità dell’uptake (SUVmax=100).
L’incremento di SUVmax di cinque volte, nonostante una riduzione del 60% del volume, evidenzia le modifiche nell’espressione del PSMA che possono verificarsi dopo l’inizio della terapia di deprivazione androgenica.
La PET con PSMA può essere utile anche per valutare la risposta alla chemioterapia a base di taxani.
Una potenziale limitazione nei pazienti con malattia avanzata è la presenza di bassa o assente espressione di PSMA in focolai di malattia scarsamente differenziata (es. carcinoma prostatico con differenziazione neuroendocrina).
In questi casi, la PET/TC con FDG può fornire informazioni complementari, con un SUV elevato che è prognostico per la sopravvivenza globale.
La PET/TC con PSMA sta assumendo un ruolo sempre più importante nella valutazione dell’idoneità a trattamenti mirati al PSMA, come la terapia radioliganda con ¹⁷⁷Lu-PSMA, per valutare l’espressione bersaglio e quindi prevedere la risposta al trattamento.
Un’elevata captazione alla PET/TC con PSMA è un prerequisito per selezionare i pazienti che possono trarre beneficio dalla terapia radionuclide diretta al PSMA.
Attualmente, sono stati osservati risultati terapeutici notevoli in pazienti con malattia metastatica resistente alla castrazione, che non hanno risposto a terapie convenzionali come la chemioterapia con docetaxel o terapie ormonali avanzate (enzalutamide/abiraterone).
Pitfalls
La PET/TC con PSMA è uno strumento di imaging altamente sensibile e specifico, ma gli specialisti devono essere consapevoli di una varietà di processi fisiologici e patologici che possono esprimere PSMA e portare a errori interpretativi. L’espressione della proteina PSMA è stata scoperta nel tessuto prostatico e nel cancro alla prostata, motivo per cui è definita “prostatica-specifica”. Dal punto di vista funzionale, la PSMA è una folato idrolasi espressa in vari tessuti normali, nel neovascolarismo tissutale e in altri tipi di tumori, sia benigni che maligni. La maggior parte delle captazioni non correlate al cancro prostatico nella PET con PSMA ha bassa intensità o è non focale, a differenza della captazione focale e solitamente intensa nelle lesioni del tumore prostatico.
Un’altra possibile causa di falsi positivi è il mancato riconoscimento di attività fisiologica, come nei gangli o nell’attività urinaria, come descritto in precedenza. Un numero crescente di casistiche e report descrivono la captazione di PSMA in processi benigni, come l’attività osteoblastica, o in tumori benigni con espressione di PSMA, inclusi emangiomi, meningiomi e noduli tiroidei benigni.
Condizioni benigne con espressione di PSMA
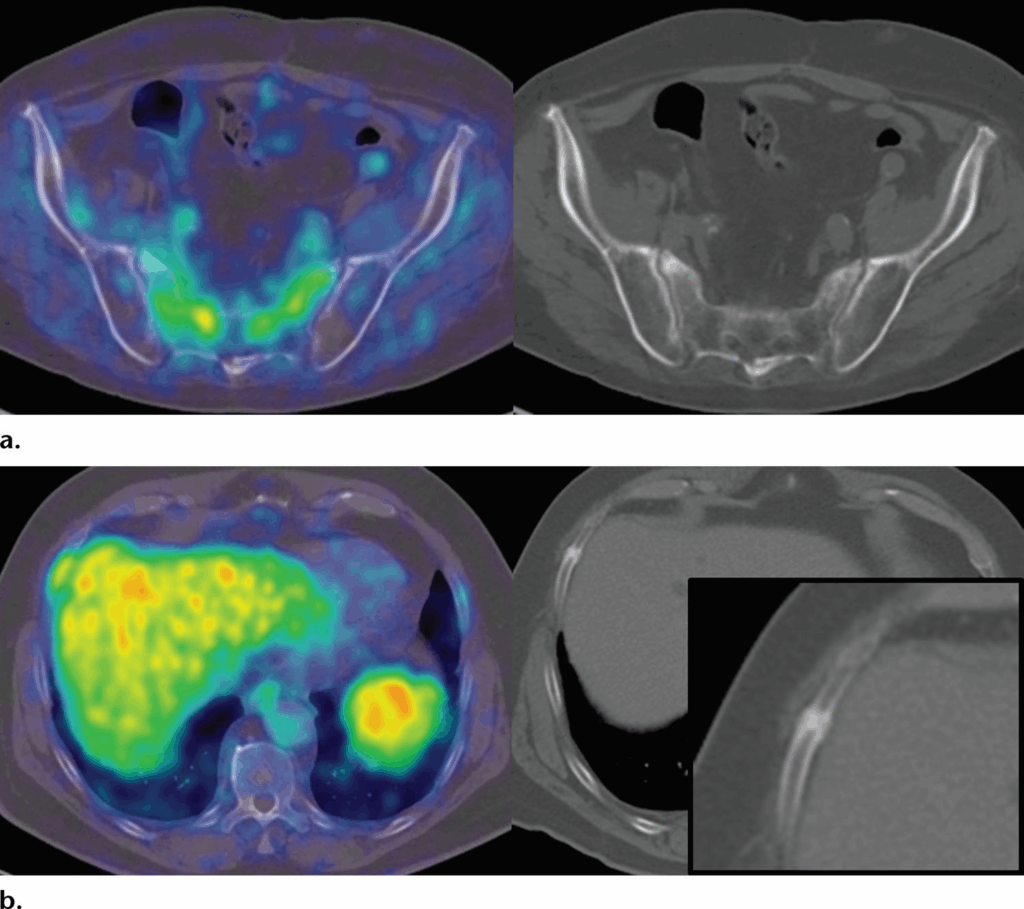
Un’espressione da lieve a moderata di PSMA si osserva nell’attività osteoblastica, con conseguente attività visibile in casi di osteoartrite, alterazioni degenerative, displasia fibrosa e fratture.
Dopo radioterapia pelvica per cancro alla prostata, possono essere visualizzate anche fratture da insufficienza sacrale.
Una captazione diffusa da lieve a moderata si riscontra nel morbo di Paget, probabilmente anch’esso legato a una risposta osteoblastica.
Una stretta correlazione anatomica permette solitamente di caratterizzare con sicurezza queste entità, ma possono sorgere dubbi se non si trova un corrispettivo anatomico.
In particolare, una captazione di basso grado in una singola costa o in più coste contigue dovrebbe essere interpretata con cautela. In caso di incertezza, il monitoraggio continuo del livello di PSA con follow-up mediante PET/TC con PSMA è la strategia più appropriata, preferibile all’esecuzione di ulteriori indagini di imaging, che spesso non permettono di caratterizzare con maggiore sicurezza i reperti dubbi.
Un’uptake moderato può essere osservato negli emangiomi, inclusi quelli cutanei, vertebrali ed epatici.
Sia l’infiammazione acuta che quella cronica possono essere associate a captazione di PSMA. Come nella PET con FDG, il pattern di captazione e i reperti anatomici correlativi sono importanti per differenziare queste condizioni.
Carcinoma prostatico PSMA-negativo
Una piccola percentuale (<10%) di carcinomi prostatici presenta assenza o minima captazione alla PET/TC con PSMA, riflettendo una bassa espressione del marcatore. L’importanza clinica del carcinoma prostatico PSMA-negativo è attualmente incerta. Se il tumore primario non è PSMA-avido, la sensibilità nel rilevare metastasi linfonodali o a distanza sarà inferiore, rendendo necessaria un’attenta valutazione anatomica in tali casi. Tuttavia, se il tumore primario è PSMA-avido, le metastasi solitamente presentano un fenotipo simile. Pertanto, in un paziente con un sito primario PSMA-positivo, un linfonodo ingrandito ma PSMA-negativo è improbabile che rappresenti carcinoma prostatico. Un’eccezione riguarda i pazienti con malattia metastatica resistente alla castrazione in stadio avanzato, specialmente dopo fallimento di diverse linee di chemioterapia, dove alcuni siti tumorali possono perdere l’espressione di PSMA.
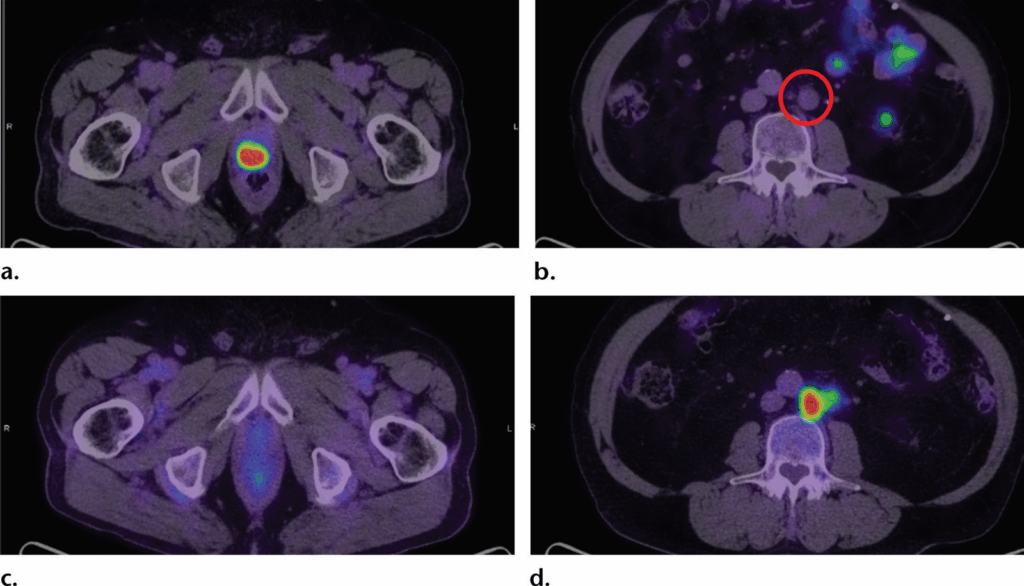
Stadiazione iniziale in un paziente con punteggio di Gleason 4+3 e PSA 20 ng/mL.
La TC di stadiazione evidenziava un linfonodo iliaco comune sinistro di 14 mm, compatibile con metastasi linfonodale non regionale (M1a).
Le immagini assiali PET/TC con PSMA mostrano:
(a) intensa captazione nel tumore primario prostatico;
(b) assenza di captazione (cerchio) nel linfonodo sospetto.
Le immagini assiali PET/TC con FDG rivelano un fenotipo opposto:
(c) nessuna captazione nella prostata;
(d) elevata captazione nel linfonodo.
Il fenotipo differenziale suggeriva una seconda patologia. La biopsia linfonodale ha
diagnosticato un linfoma diffuso a grandi cellule B.
PET con PSMA in altre neoplasie maligne
L’espressione di PSMA è stata descritta in diversi altri tipi di tumori, principalmente correlata alla neoangiogenesi piuttosto che all’espressione nelle cellule tumorali stesse. Una captazione ad alta intensità si osserva in diverse neoplasie maligne, tra cui:
- carcinoma a cellule renali;
- carcinoma duttale delle ghiandole salivari;
- adenocarcinoma polmonare;
- glioblastoma multiforme;
- carcinoma epatocellulare.
Una captazione a minore intensità può essere osservata in un’ampia gamma di tumori:
- carcinoma mammario;
- linfoma;
- meningiomi;
- carcinoma a cellule squamose;
- tumori tiroidei ben differenziati.
Tuttavia, una captazione molto intensa è quasi esclusivamente associata al cancro alla prostata, mentre gli altri tumori possono solitamente essere differenziati in base ai pattern di diffusione e alle caratteristiche anatomiche. In una revisione di 764 studi PET/TC con PSMA in pazienti con sospetto cancro prostatico, l’identificazione di neoplasie maligne sincrone PSMA-avide è risultata rara (0,7%).
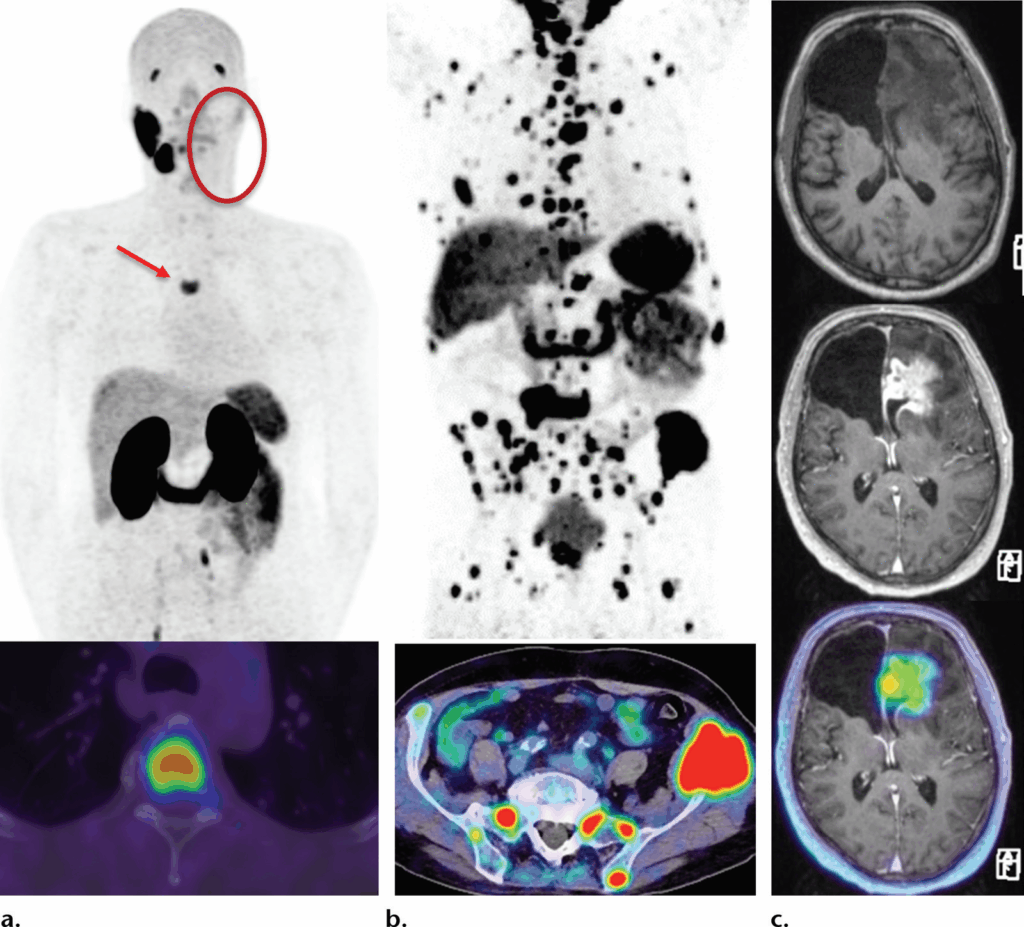
Neoplasie maligne non prostatiche con captazione di PSMA in tre pazienti
(a) Immagini PET con PSMA (in alto) e PET/TC (in basso) in un paziente con pregressa asportazione di un tumore salivare (cerchio) e carcinoma duttale delle ghiandole salivari positivo per i recettori androgeni, confermato istologicamente. Il paziente, successivamente, ha manifestato dolore dorsale e le immagini rivelano una metastasi vertebrale toracica (freccia).
(b) Immagini PET con PSMA (in alto) e PET/TC con PSMA (in basso) in un paziente con carcinoma a cellule renali metastatico mostrano malattia ossea metastatica fortemente PSMA-positiva.
(c) Immagini PET/RM con PSMA in un paziente con glioblastoma multiforme recidivante evidenziano un netto enhancement contrastografico e captazione di PSMA in una lesione sinistra che infiltra il corpo calloso.
Conclusioni
La PET/TC con PSMA si è rapidamente affermata come potenziale nuovo gold standard nell’imaging del cancro prostatico, grazie all’eccezionale contrasto tra tessuto tumorale e background. Prove crescenti dimostrano una sensibilità e specificità superiori rispetto alle metodiche tradizionali, con frequente identificazione di lesioni inferiori a 10 mm.
Questo esame “tutto in uno” è efficace per valutare la malattia nella prostata, nei tessuti molli e nell’osso. Esistono solide evidenze per il suo utilizzo nella stadiazione del cancro prostatico ad alto rischio e nella localizzazione delle recidive biochimiche. Tuttavia, mancano ancora dati sull’impatto clinico, specialmente nelle recidive precoci e nel trattamento mirato della malattia oligometastatica.
Nonostante la definizione “prostatico-specifico”, il PSMA (funzionando come folato idrolasi) è espressa anche in tessuti normali e in altri processi benigni o maligni. La conoscenza della distribuzione fisiologica e delle cause benigne di captazione è essenziale per ridurre i falsi positivi. La PET con PSMA è utile anche per l’imaging di altri tumori PSMA-esprimenti, con maggiore esperienza attualmente nel carcinoma renale a cellule chiare.
Now loading...