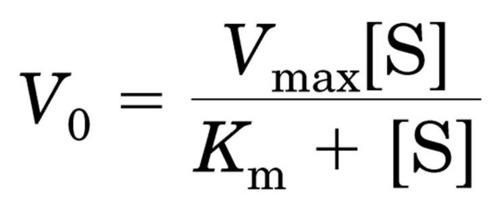
Gli amminoacidi sono biomolecole fondamentali che costituiscono le proteine. Gli aminoacidi sono formati da due gruppi funzionali: un gruppo amminico (-NH2) e un gruppo carbossilico (-COOH) legati ad un carbonio centrale detto carbonio α.
Al Cα sono legati un idrogeno e un gruppo R, detto anche catena laterale o gruppo funzionale, caratteristico di ogni amminoacido e che ne determina le proprietà chimico-fisiche.
Nell’amminoacido glicina, R è un altro atomo di idrogeno, per cui il Cα non è un centro asimmetrico. In tutti gli altri amminoacidi, il Cα è legato a quattro gruppi diversi, per cui determina un centro chirale.
Sebbene possano esistere entrambi gli isomeri D- e L-, in natura tutti gli amminoacidi sono L- (ad eccezione di alcuni amminoacidi liberi non proteici, presenti nella parete batterica).
PROPRIETA’ FISICHE:
Gli amminoacidi sono solidi cristallini bianchi con caratteristiche fisiche paragonabili a quelle dei composti ionici, presentando punti di fusione elevati e scarsa solubilità nei solventi apolari.
PROPRIETÀ ACIDO-BASICHE:
Dalla formula generale degli amminoacidi si nota immediatamente che i gruppi –NH2 e –COOH possono ionizzarsi in risposta a variazioni di pH del mezzo acquoso.Il gruppo -NH2 può accettare un protone, mentre il gruppo –COOH può cederlo: questa caratteristica rende gli amminoacidi degli anfoliti o zwitterioni, cioè ioni dipolari in grado di comportarsi sia come acidi che come basi.
PUNTO ISOELETTRICO:
Esiste un pH a cui l’amminoacido è prevalentemente in forma di ione dipolare (la solubilità è minima); questo valore del pH si chiama punto isoelettrico e non coincide col pH=7 perché le due funzioni amminica e carbossilica hanno costanti di ionizzazione diverse.
Il comportamento in soluzione varia a seconda della natura del gruppo R. In generale il punto isoelettrico degli amminoacidi che hanno solo una funzione basica ed una funzione acida è intorno a 6, quello con due funzioni acide è intorno a 3 e quello con due funzioni basiche è intorno a 9.
Il termine punto isoelettrico deriva dal fatto che lo ione dipolare ha carica netta uguale a zero e se posto in un campo elettrico, non migra ne’ verso l’anodo, né verso il catodo.
A pH diverso dal punto isoelettrico ogni aminoacido avrà carica netta positiva o negativa, perciò migrerà verso l’anodo o verso il catodo, con una velocità che dipende anche dal suo peso molecolare. Questo principio è alla base della tecnica separativa detta elettroforesi.
PROPRIETA’ CHIMICO-FISICHE:
Le proprietà chimico-fisiche degli amminoacidi sono determinate dai loro gruppi R.
Esistono 20 amminoacidi comuni e alcuni amminoacidi rari che costituiscono le unità base delle proteine. Inoltre esistono oltre 150 amminoacidi non proteici, presenti soprattutto nelle piante e nei funghi.
Gli amminoacidi comuni a tutte le proteine sono classificati in base alle caratteristiche dei loro gruppi R: 9 apolari (idrofobici); 6 neutri; 3 a carica positiva (basici); 2 a carica negativa (acidi).
L’organismo è in grado di sintetizzare da sé molti amminoacidi, ma non tutti. Esistono infatti 8 amminoacidi detti essenziali, perché devono essere introdotti con la dieta. Essi sono: fenilalanina, isoleucina, lisina, leucina, metionina, treonina, triptofano e valina.
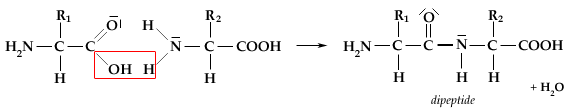
LEGAME PEPTIDICO E PEPTIDI:
Due amminoacidi possono unirsi tra loro attraverso il legame ammidico detto legame peptidico, tra il gruppo –NH2 di un amminoacido e quello –COOH dell’altro amminoacido, con liberazione di una molecola d’acqua (reazione di condensazione). L’unione di due amminoacidi genera un dipeptide. Più amminoacidi uniti tra di loro generano un biopolimero detto polipetide.
Per convenzione i polipeptidi si scrivono riportando a sinistra l’amminoacido con la funzione amminica libera (amminoacido N-terminale), e a destra quello con la funzione carbossilica libera (amminoacido C-terminale).
Ci possono essere oligopeptidi quando sono presenti 15-20 residui di amminoacidi, polipeptidi 21-100 residui, macroproteine quando superano i 100 residui fino a migliaia di amminoacidi.
ORIGINE DELLE PROTEINE:
Le catene polipeptidiche possono ripiegarsi dando origine alle proteine, che sono quindi costituite da polimeri di amminoacidi. La differenza tra un polipeptide e una proteina propriamente detta, consiste nel fatto che la catena polipeptidica della proteina assume una particolare conformazione spaziale che le conferisce le sue caratteristiche funzionali (per esempio un enzima, un anticorpo, un recettore di membrana).
La struttura della proteina è determinata dalla sua composizione amminoacidica. In particolare, la natura delle catene laterali R determina il ripiegamento dei diversi segmenti della catena secondo strutture precise.
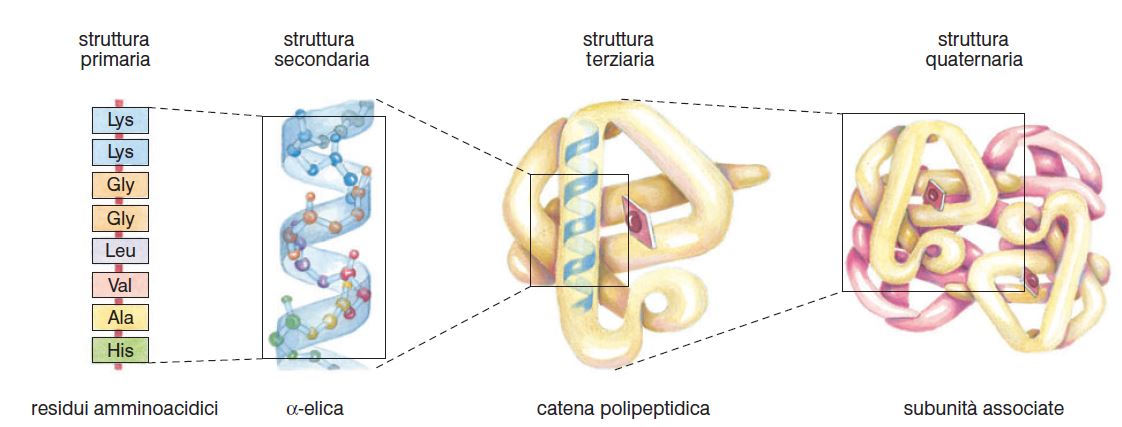
In una proteina si distinguono:
- la struttura primaria, ovvero la sequenza lineare degli amminoacidi della catena polipeptidica;
- la struttura secondaria, determinata da forme di ripiegamento assunte spontaneamente da segmenti della catena polipeptidica, in funzione della loro composizione amminoacidica;
- la struttura terziaria, costituita da ulteriori ripiegamenti e interazioni tra le strutture secondarie delle varie porzioni della catena. Anche questa dipende dalla natura dei gruppi R degli amminoacidi;
- la struttura quaternaria, costituita dall’associazione di più catene polipeptidiche a formare proteine con più sub-unità.
STRUTTURA PRIMARIA:
Nella struttura primaria il legame peptidico è rigido e impone una limitazione alle possibili conformazioni delle catene peptidiche.
STRUTTURA SECONDARIA:
Nella struttura secondaria la catena lineare si ripiega progressivamente in modo da permettere la formazione del maggior numero di legami idrogeno tra i gruppi carbonilici e i gruppi amminici dei legami peptidici.
Questi ponti idrogeno favoriscono la nascita della struttura secondaria della proteina. Tale struttura risulta stabile perché i legami idrogeno nonostante siano legami piuttosto deboli, sono presenti in grande quantità.
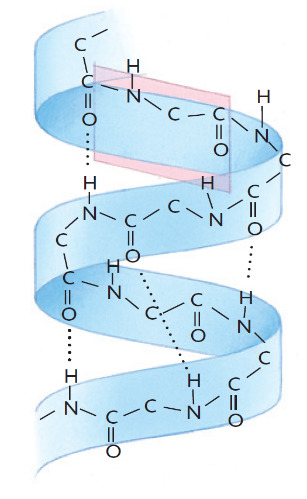
Le catene polipeptidiche in una struttura secondaria possono avvolgersi lungo il proprio asse formando una struttura elicoidale detta alfa elica. In questo modo i gruppi C=O e N—H, sovrapposti e situati alla distanza di 4 amminoacidi, formano i legami a idrogeno in linee parallele all’asse dell’elica.
Questo tipo di struttura viene preferita nelle proteine o in tratti di una proteina con residui voluminosi che possono così disporsi verso l’esterno dell’elica.
Nella cheratina della lana, sette alfa eliche sono avvolte una sull’altra formando una fibra.
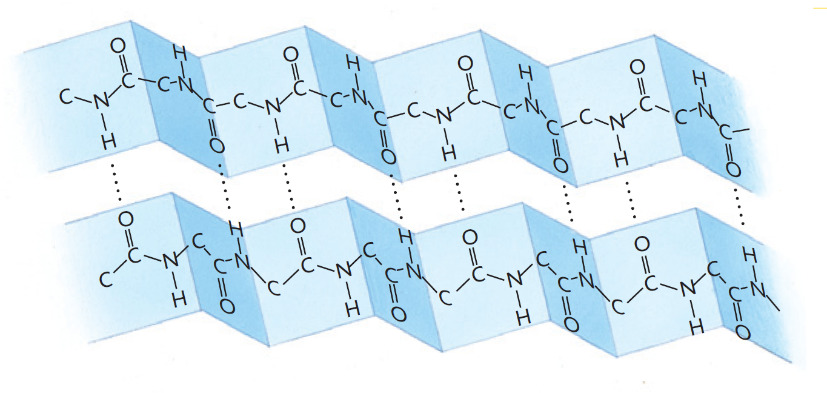
La struttura β è dovuta ad interazioni che avvengono tra due tratti di catena proteica. Essi si collocano a fianco l’uno dell’altro, costringendo la catena peptidica ad assumere una disposizione caratteristica a fisarmonica. Anche in questo caso il numero elevato di ponti idrogeno rende stabile tale struttura. I gruppi R si dispongono molto vicini (poco voluminosi) al di sopra e al di sotto del piano mediano del foglietto.
Se si scalda l’alfa-cheratina, si rompono i legami idrogeno tra le unità dell’elica e la proteina assume una forma più allungata e rigida: la beta-cheratina, fatta di foglietti beta. Per questo i parrucchieri per “stirare” i capelli li scaldano prima.
STRUTTURA TERZIARIA:
Le proteine con struttura terziaria sono costituite da catene polipeptidiche molto lunghe: diversi segmenti di queste catene possono assumere conformazioni a foglietto beta o alfa-elica. Queste diverse strutture sono intercalate da tratti non strutturati, detti a gomitolo casuale o random coil.
Le strutture secondarie a loro volta si ripiegano in complesse conformazioni spaziali, caratteristiche di ciascuna proteina. I responsabili di tale disposizione sono i ponti di solfuro, i legami ionici, le forze di legame idrofobiche e i legami idrogeno.
In base alla forma assunta, le proteine terziarie possono dividersi in globulari e fibrose. Le proteine globulari sono quelle in cui la catena proteica presenta molti ripiegamenti, le proteine fibrose sono quelle in cui prevalgono strutture direzionate senza ripiegamenti random coil.
STRUTTURA QUATERNARIA:
Le proteine con struttura quaternaria si formano quando due o più proteine globulari uguali o diverse si organizzano insieme tramite legami non covalenti per potenziare la loro funzionalità.
ENZIMI:
Gli enzimi sono proteine specializzate per la funzione catalitica che controllano tutti gli eventi metabolici dell’organismo. Essi agiscono da catalizzatori biologici, aumentando notevolmente la velocità delle reazioni ma risultano immutati al termine del processo.
Rappresentano una percentuale rilevante delle proteine cellulari benché ciascun tipo di enzima sia presente intracellularmente in quantità molto bassa.
NOMENCLATURA:
Ad ogni enzima si attribuiscono due nomi: nome corrente e nome sistematico.
Nome corrente: i nomi degli enzimi più comuni portano il suffisso “-asi” unito al nome del substrato della reazione (es. ureasi è l’enzima che agisce sull’urea) o ad una descrizione dell’azione dell’enzima o del tipo di reazione chimica che l’enzima catalizza (es. lattato deidrogenasi è l’enzima che opera sul substrato lattato deidrogenandolo). Alcuni enzimi conservano il vecchio nome comune (es. tripsina, ptialina).
Nome sistematico: gli enzimi sono suddivisi in 6 classi principali. Il suffisso “-asi” è unito ad una descrizione della reazione chimica catalizzata.
Ossidoriduttasi: Catalizzano le reazioni di ossidoriduzione.
Trasferasi: Catalizzano il trasferimento di gruppi funzionali.
Idrolasi: Catalizzano la rottura di legami con l’aggiunta d’acqua.
Liasi: Catalizzano l’addizione di gruppi a doppi legami o l’inverso.
Isomerasi: Catalizzano le reazioni di isomerizzazione.
Ligasi: Catalizzano la formazione di legami accoppiati all’idrolisi di ATP.
STRUTTURA:
Gli enzimi sono costituiti da una o più proteine globulari ad alto peso molecolare che costituiscono l’apoenzima. Talvolta esse svolgono la loro attività enzimatica tal quali (es. lisozima).
In molti casi, gli enzimi necessitano della presenza di Cofattori, Ioni o molecole non proteiche, indispensabili affinché l’enzima possa svolgere la sua attività catalitica.
I cofattori più comuni comprendono ioni metallici (p.es. Zn2+, Fe2+) e molecole organiche (coenzimi) derivanti in molti casi da vitamine.
Cofattore e apoenzima costituiscono la proteina coniugata denominata oloenzima.
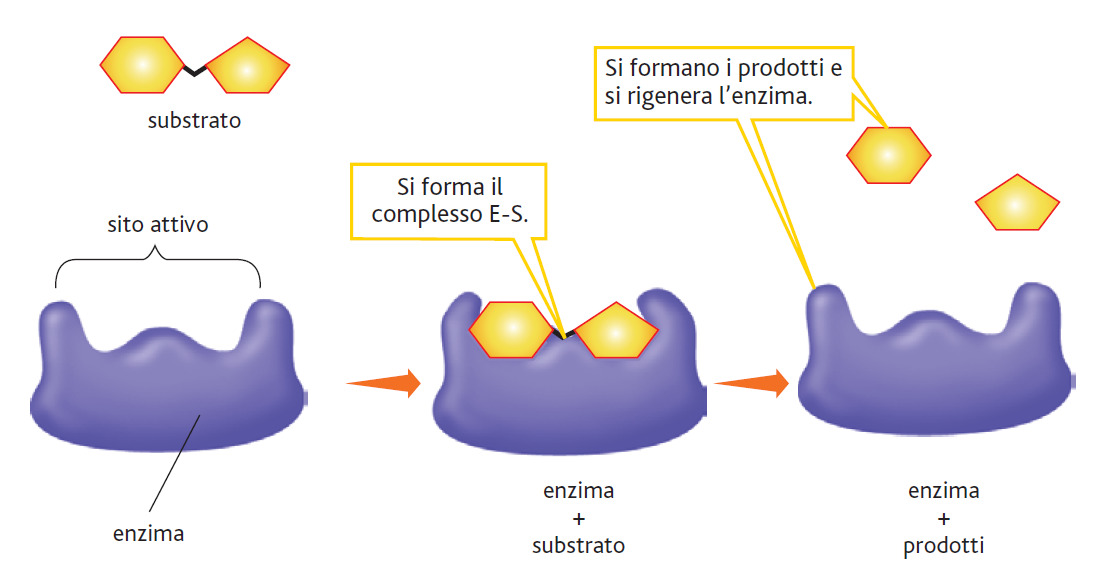
Nelle molecole enzimatiche è presente una speciale tasca o solco, chiamato sito attivo. Esso contiene delle catene laterali di amminoacidi che creano una superficie tridimensionale che è complementare al substrato.
Il sito attivo si lega al substrato, formando un complesso enzima-substrato (ES). L’ES si converte in un enzima-prodotto (EP) il quale successivamente si dissocia in enzima (E) e prodotto (P).
Gli enzimi sono altamente specifici cioè catalizzano soltanto un tipo di reazione chimica ed interagiscono con uno o con pochi substrati. Essi catalizzano un solo tipo di reazione ed eliminano o riducono le possibili reazioni collaterali.
FUNZIONAMENTO:
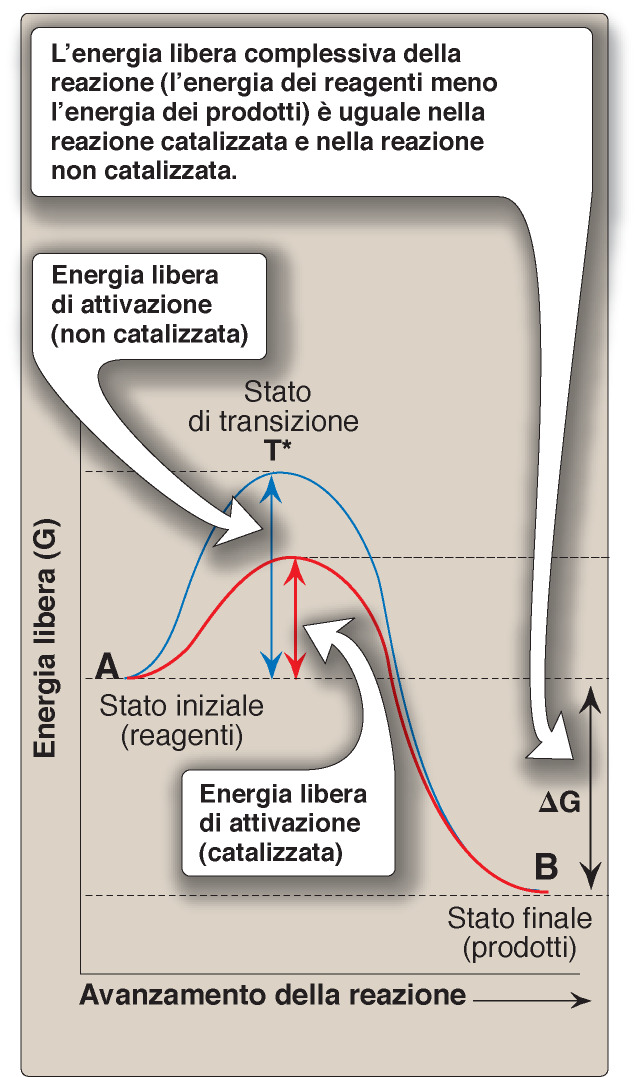
Tutte le reazioni chimiche hanno una barriera energetica (chiamata energia di attivazione) che separa i reagenti dai prodotti.
Questa barriera è la differenza tra l’energia dei reagenti e l’energia dello stato di transizione T* che è uno stato ad alta energia.
A causa dell’elevata energia di attivazione, le reazioni non catalizzate procederebbero spesso con lentezza.
In generale, un catalizzatore aumenta la velocità della reazione abbassando l’energia di attivazione.
L’enzima non modifica l’equilibrio della reazione ma offre alla reazione un percorso alternativo in cui l’energia di attivazione è più bassa.
La velocità delle reazioni catalizzate dagli enzimi può essere influita da quattro fattori:
- La concentrazione del substrato;
- La temperatura;
- Il pH;
- Le modificazioni covalenti.
CONCENTRAZIONE DEL SUBSTRATO:
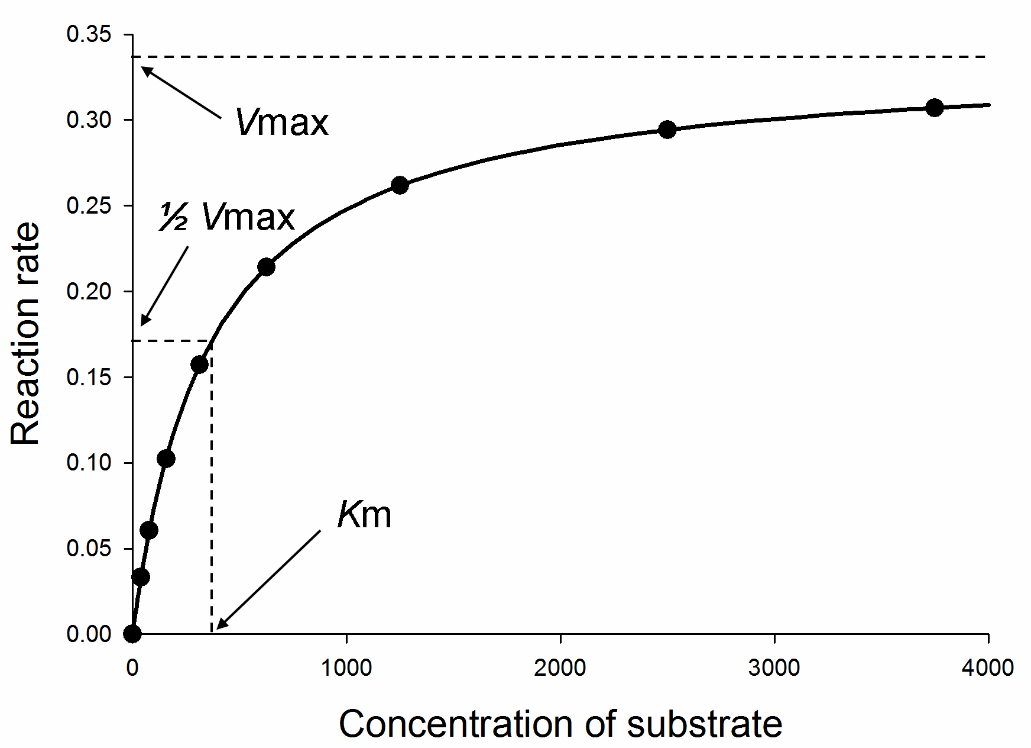
La velocità di una reazione catalizzata da un enzima aumenta all’aumentare della concentrazione del substrato fino a raggiungere una velocità massima (Vmax) che riflette la saturazione con il substrato dei siti attivi delle molecole di enzima presenti.
L’equazione di Michaelis-Menten descrive la variazione della velocità di reazione al variare della concentrazione del substrato.
v0 = velocità iniziale della reazione (*)
Vmax= velocità massima
Km = costante di Michaelis-Menten
[S] = concentrazione del substrato
La Km è pari alla concentrazione di substrato alla quale la velocità della reazione è 1/2 della Vmax.
La Km riflette l’affinità dell’enzima per il substrato:
Km piccola, alta affinità dell’enzima per il substrato
Km grande, bassa affinità dell’enzima per il substrato.
Ogni enzima ha una Km caratteristica per un particolare substrato.
La Km non varia al variare della [E].
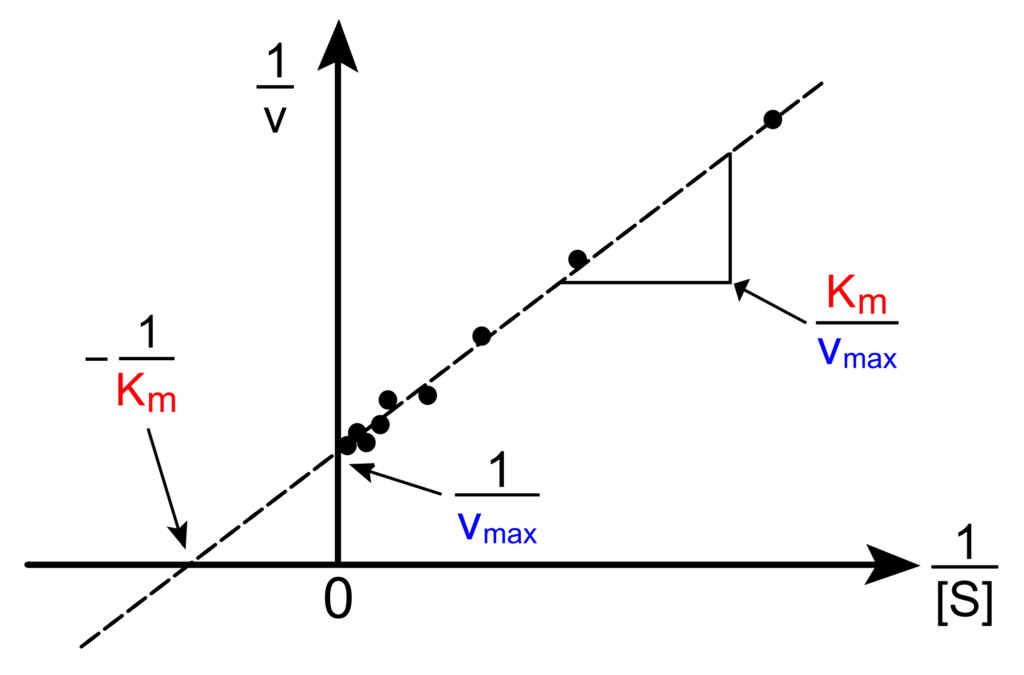
Ponendo in grafico 1/ v0 in funzione di 1/[S], si ottiene una linea retta (grafico di Lineweaver-Burke).
Il grafico di Lineweaver-Burke può essere utilizzato per calcolare la Km e la Vmax e per determinare il meccanismo d’azione degli inibitori enzimatici.
La maggior parte degli enzimi segue la cinetica di Michaelis-Menten.
Il grafico della velocità iniziale (v0) in funzione della concentrazione del substrato [S] ha un andamento iperbolico.
Tracciando tale grafico non sempre si può stabilire con esattezza quando si raggiunge la Vmax poiché per elevate [S] la curva iperbolica ha un andamento asintotico.
TEMPERATURA:
La velocità di reazione aumenta con l’aumentare della temperatura fino a raggiungere un picco.
Un ulteriore innalzamento della temperatura provoca una diminuzione della velocità di reazione a causa della denaturazione dell’enzima.
pH:
Ciascun enzima ha un pH ottimale al quale la reazione è catalizzata con la massima efficienza.
Esso in genere rispecchia quello dell’ambiente in cui l’enzima svolge normalmente le sue funzioni.
La concentrazione degli H+ (pH) influenza l’attività enzimatica modificando la geometria del sito attivo e la distribuzione delle cariche elettriche dei gruppi coinvolti nel legame del substrato o nel processo catalitico stesso.
Valori di pH estremi possono anche provocare la denaturazione dell’enzima.
Un enzima è stabile ad un pH compreso tra 4 e 9 come le altre proteine.
INIBIZIONE DELL’ATTIVITÀ ENZIMATICA:
L’Inibitore è una qualsiasi sostanza capace di far diminuire la velocità di una reazione catalizzata da un enzima. Gli inibitori possono essere:
Inibitori reversibili, quando si legano agli enzimi con legami deboli, non covalenti. La diluizione del complesso enzima-inibitore provoca la dissociazione dell’inibitore e il recupero dell’attività enzimatica. Tale inibizione può seguire un meccanismo di tipo competitivo o non competitivo.
Inibitori irreversibili o (inattivatori): si legano in modo stabile all’enzima, spesso con interazioni covalenti, inattivandolo.
Nell’inibizione competitiva, l’inibitore, strutturalmente simile, compete con il substrato per il legame a quel sito. Quando prevale la concentrazione del substrato, esso riesce a scacciare l’inibitore.
Aumentando la [S] l’effetto di un inibitore competitivo si attenua fino ad annullarsi.
Per una [S] sufficientemente elevata, la velocità di reazione raggiunge ugualmente la Vmax.
L’inibizione non competitiva si verifica quando inibitore e substrato si legano a siti diversi, chiamati siti allosterici. L’inibitore non competitivo può legarsi sia all’enzima che al complesso ES, bloccando la reazione.
La Vmax è diminuita (l’inibizione non competitiva non si annulla aumentando la [S]).
La Km rimane invariata (l’inibitore non competitivo non interferisce con il legame del substrato all’enzima).
Sul grafico di Lineweaver-Burke le due rette (reazione inibita e non) intersecano l’asse y in punti diversi (la Vmax è diminuita) e quello delle x a livello di -1/ Km (la Km è immutata).