Molto importante per le proteine è la distinzione tra proteine semplici e proteine complesse o coniugate.
Le proteine coniugate sono tutte quelle proteine che oltre alla catena polipeptidica contengono dei gruppi di natura chimica diversi. La diversa natura chimica del gruppo prostetico (non proteico) che è legato alla proteina ci permette di identificare varie classi di proteine come: lipoproteine, emoproteine (emoglobina, mioglobina, neuroglobina, citoglobina, ecc…).
Esiste una relazione tra la sequenza amminoacidica e la funzione biologica, infatti proteine con funzione diversa hanno anche sequenza amminoacidica diversa. Migliaia di malattie genetiche dell’uomo possono derivare dalla formazione di una proteina difettosa 1/3 di queste a causa di un’unica sostituzione amminoacidica. Questo ci fa capire l’importanza dell’esatto trasferimento di informazione dal DNA alla proteina, tenendo presente che ci sono malattie legate a mutazioni puntiformi in cui è sostituito un unico nucleotide che corrisponde a un cambio amminoacidico che poi si trasforma in uno stato patologico più o meno grave a seconda dei casi e della condizione di eterozigosi o omozigosi.
Inoltre proteine con funzioni simili ma prodotte da specie diverse hanno una sequenza simile: per esempio andando a sequenziare delle proteine che hanno funzioni simili in organismi che sono filogeneticamente anche molto distanti fra loro si trova l’esatto allineamento degli amminoacidi di circa il 50% e soprattutto si ha una perfetta corrispondenza in quelle zone dette conservative della proteina che sono le zone più importanti per la funzione della proteina in esame.
Infine la sequenza di una data proteina è flessibile: circa il 20-30% delle proteine dell’uomo sono polimorfiche cioè hanno sequenze amminoacidiche variabili nelle popolazioni umane (si parla di polimorfismo). Spesso le proteine contengono nella loro sequenza delle regioni essenziali per la loro funzione mentre variazioni in altre regioni possono non modificare la funzione della sequenza amminoacidica.
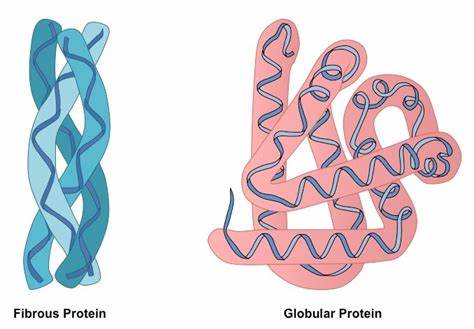
Per quanto riguarda la classificazione delle proteine si possono utilizzare vari criteri. Innanzitutto un criterio di classificazione è quello che si basa sulla forma e le possiamo distinguere in fibrose e globulari.
Si tenga presente la stretta correlazione tra la struttura di una proteina e la sua funzione. Una proteina di tipo fibroso è più limitata come possibilità di funzionamento e la si può immaginare come un bastoncello che non può che svolgere una funzione di tipo strutturale. Ci sono molti esempi: il collagene, l’elastina, la fibrina della seta, la cheratina, ecc… Mentre le proteine globulari sono come palline ed hanno a svariate funzioni; sono proteine globulari: enzimi, immunoglobuline e molecole di trasporto come l’emoglobina.
Le proteine possono essere classificate anche in base alla funzione biologica e quindi abbiamo enzimi (funzione catalitica), proteine di trasporto, deposito, regolatorie, contrattili, strutturali e tante altre.
Un terzo tipo di classificazione poco utilizzato è in base alla solubilità in soluzioni idrosaline, quindi abbiamo le albumine, globuline e gli istoni, ad esempio, che hanno un livello di basicità crescente (H1, H2A, H2B, H3, H4).
La proteina può essere inoltre classificata in monomerica formata da una singola catena peptidica e multimerica più di una. Nell’ambito delle proteine multimeriche che sono molto rappresentate nelle nostre cellule perché il livello di complessità di molte proteine è abbastanza elevata, costituite dall’associazione di almeno due subunità, rientra la sottoclasse di proteine oligomeriche, formate da un numero di sub unità tra 2 e 10. Un esempio di proteina oligomerica è l’emoglobina costituita da 4 subunità e quindi è un tetramero. Poi abbiamo la distinzione tra omomultimero ed eteromultimero se sono uguali o diverse le sub unità.
Now loading…
Livelli strutturali di una proteina
Ogni proteina è caratterizzata da al massimo quattro livelli strutturali e almeno tre livelli strutturali, chiamati struttura primaria, secondaria e terziaria.
La struttura primaria è quella più importante della proteina da dove scaturiscono gli altri livelli strutturali. Rappresenta l’ordine lineare degli amminoacidi che costituiscono lo scheletro peptidico. È così importante l’ordine con cui sono legati gli amminoacidi lungo la catena polipeptidica tanto che sono stati elaborati negli anni dei software di predizione della struttura delle proteine. Conoscendo soltanto l’ordine e il tipo di amminoacidi che costituiscono lo scheletro polipeptidico si può dedurre poi la conformazione nativa della proteina.
Variando la sequenza lineare con cui sono disposti gli amminoacidi di conseguenza varieranno anche gli altri livelli strutturali ecco perché è così importante la corrispondenza DNA-proteina per l’esatto svolgimento delle proteine. Quindi partendo dalla struttura primaria possiamo descrivere la struttura secondaria e poi quella terziaria e a volte c’è anche la struttura quaternaria.
Con la struttura secondaria si intende il livello strutturale che descrive le cosiddette interazioni a piccolo raggio tra i vari amminoacidi. Si parla anche di conformazione locale in quanto viene descritta tramite operazioni di analisi della proteina fatta per brevi segmenti. Per esempio di una catena polipeptidica si analizzano la struttura che assume rispetto allo spazio dei primi dieci amminoacidi e poi dall’undicesimo e così via e si vede come si riarrangiano nello spazio analizzando soprattutto le interazioni che si possono stabilire tra amminoacidi vicinali non troppo distanti fra loro, ecco perché si parla di conformazione locale della proteina.
La struttura terziaria è quel livello di struttura che prende in considerazione le interazioni ad ampio raggio. La struttura terziaria corrisponde alla struttura 3D della proteina ed è la conformazione nativa ossia la conformazione con la quale funziona la proteina. Nel processo di folding delle proteine molto spesso succede che si stabiliscono interazoni anche fra il primo e l’ultimo amminoacido, ecco perché si parla di interazioni fra amminoacidi molto distanti fra loro ad ampio raggio.
Per le proteine monomeriche ci fermiamo a questo livello strutturale.
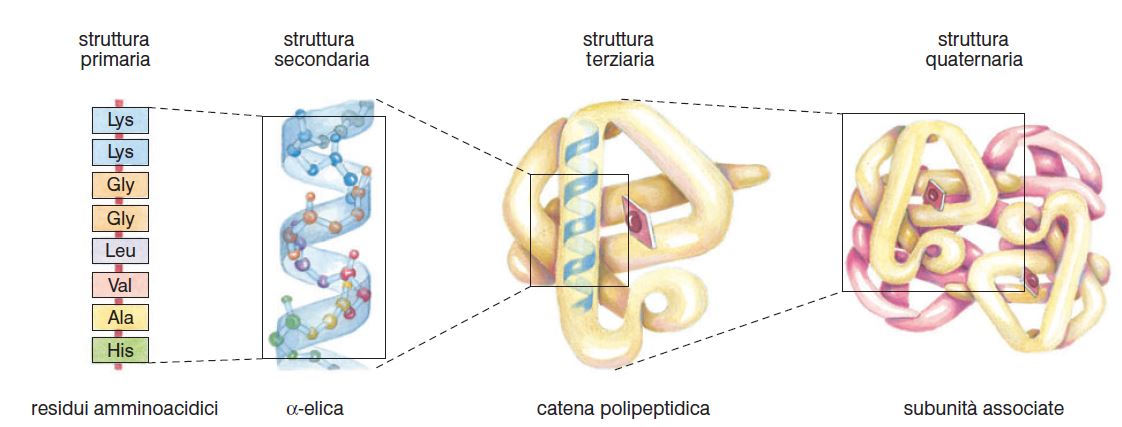
La struttura quaternaria è un livello presente solo per le proteine oligomeriche e multimeriche che sono formate dall’associazione di più sub unità proteiche. Infatti la definizione di struttura quaternaria è quella che descrive le interazioni fra le varie sub unità che sono in tutti i casi di tipo debole così come le interazioni ad ampio raggio e piccolo raggio rispettivamente della struttura terziaria e secondaria (ponti idrogeno, interazioni idrofobiche, interazioni di Van der Waals ecc…) fa eccezione la formazione dei ponti disolfuro: durante l’avvolgimento di una proteina possono trovarsi l’uno di fronte all’altro residui di cisteina, l’amminoacido caratterizzato dalla presenza del gruppo tiolico, si forma quindi il ponte disolfuro che è un legame covalente.
Tra le interazioni deboli il legame di Van Der Waals ha un energia di legame di 0.4-4 kJ/mol, i ponti a idrogeno 12-30 kJ/mol. Si possono formare legami elettrostatici (ionici) se durante il processo della formazione della struttura nativa si trovano uno di fronte all’altro o uno vicino all’altro degli amminoacidi rispettivamente basici e acidi che con le loro catene laterali, come ad esempio la lisina carica positivamente e l’aspartato carico negativamente, si viene a creare questa interazione elettrostatica. Mentre le interazioni idrofobiche sono quelle che si creano fra la porzione idrofobica di un amminoacido ed un altro come leucina e isoleucina che sono le più forti, hanno energia poco inferiore a 40 kJ/mol.
Molto importante, parlando delle interazioni deboli, l’effetto cumulativo. Sebbene siano legami molto deboli, quindi occorre una quantità di energia abbastanza piccola per romperli, in realtà dobbiamo fare la sommatoria di tutte le interazioni deboli che in unità di tempo si formano in una macromolecola, un’energia molto grande, ecco perché è molto stabile la conformazione nativa di una proteina ed è abbastanza difficile denaturare una proteina.