Le lesioni intraepiteliali squamose sono lesioni squamose cervicali precancerose che se non trattate possono progredire in carcinoma squamocellulare infiltrante. Questo tipo di lesioni insorgono in pazienti infettati da HPV e sono state classificate da Bethesda in 2 gradi di progressione a seconda del tipo di infezione (produttiva e non produttiva) e dal tipo di virus implicato:
- LSIL: Lesione Intraepiteliale Squamosa di basso grado (più frequente): è la forma produttiva, una lesione autolimitantesi, piatta o esofitica (condiloma) dell’epitelio cervicale squamoso, associata ad un’infezione produttiva di un qualsiasi HPV che in genere regredisce spontaneamente. L’HPV replicandosi all’interno della cellula infettata ne determina alterazioni nucleari (atipie nucleari con nuclei ingranditi, a profilo irregolare, bi- plurinucleolati, anisocitosi) e citoplasmatiche (atipia coilocitotica, ovvero vacuolizzazione citoplasmatica di basso grado), ispessimento di membrana nucleare, ipercellularità dello strato basale, perdita della polarità, che corrispondono alle alterazioni del CIN 1 (displasia lieve in cui le atipie cellulari sono solo limitate al 1/3 inferiore dell’epitelio).
- HSIL: Lesione Intraepiteliale Squamosa di alto grado è la forma non produttiva, di solito associata/causata da poche varianti dell’HPV che, per il loro potenziale oncogenico, sono stati definiti ad alto rischio di progressione con cellule presenti al di sopra del 1/3 dello spessore dell’epitelio. Le lesioni non produttive sono costituite da cellule atipiche proliferanti con alto rapporto nucleo/citoplasma che corrispondono alle lesioni CIN 2 e CIN 3.
LESIONE INTRAEPITELIALE SQUAMOSA DI BASSO GRADO (LSIL)
Anche chiamata Neoplasia intraepiteliale cervicale di grado 1 (CIN1), displasia squamosa lieve, coilocitosi, è una lesione intraepiteliale di epitelio squamoso che rappresenta la manifestazione clinica e morfologica di un’infezione produttiva di HPV.
Segue l’epidemiologia dell’infezione da HPV, colpendo l’80% delle donne nei loro primi 20 anni e rilevabile in solo il 5% a 50 anni. Sono più di 40 i tipi di HPV responsabili dell’infezione della cervice, di cui 13-15 tipi di alto rischio e 4-6 di basso rischio, ma ciononostante i test clinici più validi testano solo 13-14 tipi di quelli ad alto rischio.
Le lesioni intraepiteliali squamose di basso grado sono asintomatiche e sono identificate attraverso colposcopia e screening citologico.
La colposcopia non differenzia in modo affidabile le LSIL dalle HSIL ed entrambe possono coesistere nella cervice. Due diverse aree possono essere infette da due diversi tipi di HPV o dallo stesso tipo.
Tra i fattori di rischio rientrano: menarca precoce, età della prima gravidanza, numero di gravidanze, classe socio-economica, uso di contraccettivi orali per lungo tempo, immunosoppressione, infezioni sessualmente trasmesse (HVS2 e clamidia) e infiammazioni croniche, ruolo cancerogeno del DNA degli spermatozoi, ruolo cancerogeno dello smegma, ma soprattutto il numero di partners ed età di inizio dell’attività sessuale, storia famigliare positiva, il fumo di sigaretta e l’infezione da HPV 16.
La circoncisione può abbassare i tassi di infezione da HPV tra gli uomini e ridurre i rischi tra i loro partner.
Tuttavia, la maggior parte delle infezioni regredisce spontaneamente, come valutato mediante test del DNA HPV molecolare. Per cui l’infezione da HPV è necessaria ma non sufficiente alla carcinogenesi e il tempo di progressione richiede generalmente decenni.
Le lesioni cervicali di HPV non sono generalmente visibili ad occhio nudo ad eccezione delle lesioni esofitiche o papillari che sono molto spesso simili ad un condiloma acuminato. Anche i condilomi acuminati sono lesioni intraepiteliali squamose di basso grado.
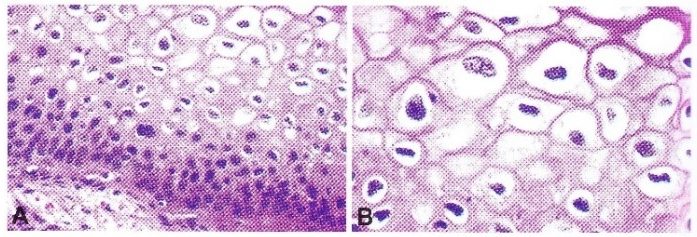
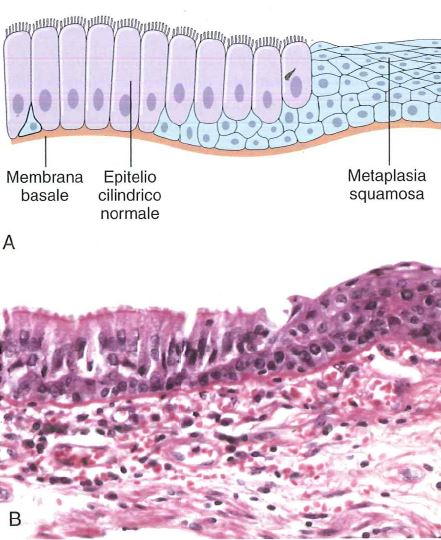
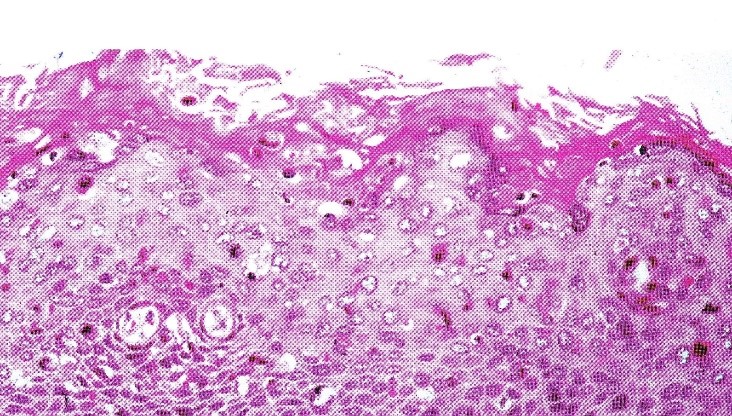
A: L’iperplasia parabasale è confinata al terzo inferiore dell’epitelio. Lo strato superiore mostra differenziazione e coilocitosi.
B: Ingrandimento maggiore che mostra la coilocitosi.
LSIL è la manifestazione morfologica della differenziazione cellulare indotta dal programma di produzione virale di HPV nelle cellule squamose dell’ospite. Non c’è modo per predire il tipo di HPV dalla morfologia anche se alcuni dati suggeriscono che i tipi di HPV 16 e 18 causano lesioni più grandi e una più rapida crescita cellulare. Tali lesioni sono caratterizzate dalla proliferazione di cellule basali e parabasali simili che può essere minima o estendersi al massimo per un terzo dello spessore dell’epitelio.
L’attività mitotica è confinata a questa zona e generalmente non è alterata. Nei due terzi superiori dell’epitelio, le cellule si differenziano e aumentano il citoplasma; tuttavia l’ingrandimento nucleare persiste in modo tale da aumentare il rapporto nucleo-citoplasma. C’è spesso ipercromasia nucleare, irregolarità della membrana nucleare e spesso sviluppo di un vacuolo ben definito intorno al nucleo.
Il cambiamento citoplasmatico più tardivo è definito coilocitosi o effetto citopatico da HPV che è più prominente nel terzo superiore dell’epitelio. La superficie cellulare può esibire ipercheratosi o paracheratosi e le cellule possono essere bi- o multinucleate.
Circa 1/3 dei risultati istologici di LSIL mostrano una diffusa immunocolorazione di p16 coinvolgente lo strato basale e parabasale chiamati black-positive.
Le infezioni da HPV sono ubiquitarie nella popolazione. Gli immunosoppressi sembrano favorire la persistenza dell’infezione da HPV o l’insorgenza di rari tipi di HPV. Il test clinico di suscettibilità familiare/genetica produce poche informazioni riguardo il rischio di progressione verso il carcinoma.
Il risultato bioptico di LSIL è eccellente in quanto è prevista la regressione della lesione nell’arco di un anno.
LESIONE INTRAEPITELIALE SQUAMOSA DI ALTO GRADO (HLIS)
Anche detta neoplasia intraepiteliale cervicale di grado 2 e 3 (CIN2), (CIN3), displasia squamosa moderata, displasia squamosa severa, carcinoma squamoso in situ, è una lesione intraepiteliale squamosa che comporta un significativo rischio di sviluppare carcinoma invasivo se non trattata.
La loro identificazione precede di circa due decenni quella del carcinoma invasivo nel paziente. Infatti, 1/3 delle HLIS progredirà in 30 anni verso il carcinoma invasivo, con un rischio maggiore per le lesioni di più grandi dimensioni, sebbene negli adolescenti si è dimostrata uno sviluppo di HLIS in 2 anni dall’infezione di HPV. La prevalenza nella popolazione occidentale sottoposta a screening è dello 0.5- 1%
I fattori di rischio sono età avanzata, lunga storia di attività sessuale, pochi controlli di screening, HPV 16 E 18 (con un’incidenza ridotta nelle popolazioni vaccinate).
Come per le LSIL, le lesioni HSIL sono asintomatiche e scoperte tramite citologia e colposcopia. Non sono visibili alla visita clinica ad eccezione delle esofitiche (papillari). Quelle associate a positività al Pap test, sanguinanti o ulcerate dovrebbero destare sospetto di carcinoma.
Le HLIS sono caratterizzate da proliferazione di cellule squamose nella zona di metaplasia e vicino l’attuale giunzione squamo-cellulare. Il compartimento cellulare proliferante si estende nel terzo medio (CIN2) e nel terzo superficiale (CIN3) dell’epitelio. Le cellule hanno anomalie nucleari che comprendono un aumento delle dimensioni del nucleo, un aumento del rapporto nucleo-citoplasma, irregolarità delle membrane nucleari e anomale figure mitotiche. Esistono comunque diverse varianti istologiche:
- HSIL sottile è una lesione intraepiteliale di alto grado che ha uno spessore inferiore alle 10 cellule;
- HSIL cheratinizzato è una lesione con epitelio contenente cellule discheratotiche, nuclei atipici e pleomorfi. L’istologia è più simile alle lesioni intraepiteliali di alto grado associate ad HPV osservate nei siti cutanei con epitelio cheratinizzante come vulva e perineo. Molte di queste lesioni sono più spesso associate a localizzazioni ectocervicali.
- HSIL condilomatose con cambiamenti citologici focali che dettano prognosi e trattamento.
- Carcinoma in situ squamoso papillare o carcinoma papillare squamo-transizionale non invasivo è una lesione con papillazioni fini e poco acuminate e che istologicamente assomiglia alla neoplasia uroteliale.
L’immunoistochimica di p16 è estremamente d’aiuto nella differenziazione di HSIL e metaplasia e atrofia squamosa immatura.
Il miglior fattore predittivo di ricorrenza della malattia o presenza di malattia residua è l’identificazione a 12 mesi dalla terapia dell’HPV DNA.
I pazienti sono trattati con laser ablazione, crioterapia, procedura di escissione elettrochirurgica ad anello (LEEP) e conizzazione chirurgica.
Fonte: Anatomia patologica e correlazioni anatomo-cliniche (Mariuzzi).