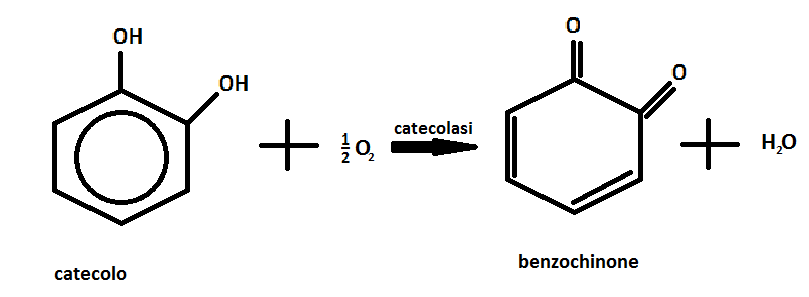CONOSCENZE TEORICHE:
Gli enzimi sono dei catalizzatori in grado di accelerare le reazioni chimiche senza essere né consumati né alterati. Senza di essi la maggior parte delle reazioni biologiche avverrebbe a una velocità talmente ridotta da risultare inadatta al fabbisogno metabolico e alle altre funzioni delle cellule e quindi dell’organismo. I cambiamenti di temperatura, le variazioni del pH possono alterare la struttura e perciò influenzarne l’attività con effetti sulla velocità della reazione che deve catalizzare. La velocità di una reazione enzimatica può essere condizionata anche dalle concentrazioni relative dell’enzima e/o del substrato.
Lo scopo della seguente prova di chimica organica è di studiare l’attività dell’enzima catecolasi (ossidasi del catecolo), contenuto in alcuni frutti e ortaggi. La catecolasi favorisce la reazione tra il catecolo e l’ossigeno e grazie alla sua elevata elettronegatività, l’ossigeno rimuove due atomi di idrogeno dal catecolo ossidandolo a benzochinone, mentre l’aggiunta di due atomi di idrogeno riduce l’ossigeno formando acqua, secondo la seguente reazione:
DPI:
- Guanti in lattice;
- Camice.
RISCHI:
- Rottura della vetreria;
- Ustioni con la piastra;
- Tagliarsi con le lame del frullatore;
- Catecolo: tossicità acuta/a lungo termine e nocività.
Parte 1: Preparazione delle soluzioni
OBIETTIVO: Preparare il succo di patata e la soluzione di Catecolo allo 0,1%
STRUMENTI:
- Becher da 100 mL;
- Carta assorbente;
- Carta filtro;
- Coltello;
- Frullatore;
- Imbuto di vetro;
- Matraccio da 250 mL;
- Spruzzetta con ugello;
- Spatola d’acciaio;
- Supporto metallico.
SOSTANZE:
- Catecolo al 99%;
- Patata;
- H2O distillata.

PROCEDIMENTO:
PREPARAZIONE SUCCO DI PATATA:
- Sbucciare la patata con il coltello e tagliarla a cubetti;
- Frullare i cubetti di patata tramite un frullatore con l’aggiunta di acqua distillata nel contenitore;
- Raccogliere il succo di patata in un becher filtrando la poltiglia con la carta filtro ed un imbuto;
PREPARAZIONE CATECOLO 0,1%:
- Calcolare i mL di Catecolo concentrato al 99% da prelevare per ottenerne una soluzione allo 0,1% secondo il seguente calcolo:
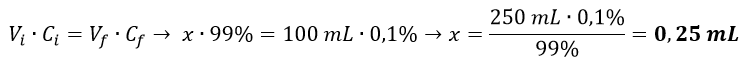
- Quindi prelevare con una micropipetta 0,25 mL di catecolo concentrato ed inserirli in un matraccio;
- Portare a volume il matraccio aggiungendo acqua distillata.
Parte 2: Gli effetti della temperatura sulla velocità di reazione.
OBIETTIVO: Determinare gli effetti della variazione di temperatura sull’attività enzimatica della catecolasi.
STRUMENTI:
- 2 becher da 500 mL;
- 3 provette con porta provette;
- Pipetta Pasteur;
- Pipetta graduata da 5 mL;
- Termometro;
- Piastra riscaldante.
SOSTANZE:
- Soluzione tampone Fosfato (pH 7);
- Succo di patata;
- Cubetti di ghiaccio;
- Catecolo (o,1%).
PROCEDIMENTO:
- Numerare le tre provette e versare in ognuna di esse 3 mL di tampone fosfato a pH 7, utilizzando una pipetta da 5 mL;
- Immergere la prima provetta in un bagno di acqua e ghiaccio, si lascia la seconda provetta nel porta provette a temperatura ambiente e si immerge la terza provetta in un bagnomaria ad una temperatura compresa tra i 50 e i 60 °C;
 Attendere 5 minuti, in modo da far scendere al di sotto di 10 °C la soluzione tampone della prima provetta, mentre la soluzione tampone della terza provetta tra i 50-60 °C;
Attendere 5 minuti, in modo da far scendere al di sotto di 10 °C la soluzione tampone della prima provetta, mentre la soluzione tampone della terza provetta tra i 50-60 °C;- Inserire 10 gocce di succo di patata;
- Aggiungere 10 gocce di catecolo allo 0,1 % e attendere 5 minuti, favorendo la reazione e il conseguente viraggio di colore;
Annotare i risultati nella tabella che segue, indicando l’intensità della colorazione in ogni provetta dopo 5 minuti ( / = assenza di colore; +, ++, +++ = in base all’intensità crescente di colore).
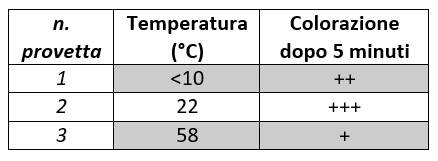 RISULTATI:
RISULTATI:
In base ai dati rinvenuti nella tabella, si può osservare come la variazione di colore sia più intensa intorno ai 22°C (temperatura ambiente). La scarsa intensità di colore ai 58°C è dovuta alla denaturazione dell’enzima, che dopo aver raggiunto il picco di velocità massima, causa una diminuzione della velocità di reazione.
Ad una temperatura inferiore ai 10°C la reazione avviene molto più lentamente rispetto alla soluzione a temperatura ambiente.
Parte 3: Gli effetti del pH sull’azione degli enzimi.
OBIETTIVO: Determinare gli effetti del pH sull’attività enzimatica della catecolasi.
STRUMENTI:
- 3 Provette con portaprovette;
- Pipetta graduata da 5 mL;
- Pipetta Pasteur.
SOSTANZE:
PROCEDIMENTO:
- Numerare le provette e inserire 3 mL di soluzione tampone fosfato a pH 4 nella prima, 3 mL a pH 7 nella seconda e 3 mL a pH 10 nella terza;
- Aggiungere in ogni provetta 10 gocce di succo di patata aiutandosi con una pipetta Pasteur;
- Aggiungere 10 gocce di catecolo allo 0,1%;
- Agitare per qualche minuto le tre provette per far avvenire la reazione;
- Annotare i risultati (cambiamento di colore) in tabella.
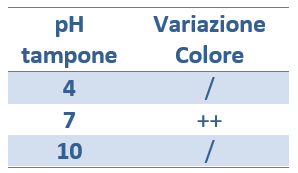 RISULTATI:
RISULTATI:
Nella seconda provetta (quella con la soluzione tampone a pH 7), si nota la variazione di colore (la soluzione diventa rosa), che indica l’avvenimento della reazione catalizzata dall’enzima catecolasi.
Nella prima e nella terza provetta, invece, il colore non è cambiato e la reazione non è stata catalizzata dall’enzima catecolasi in quanto il pH troppo acido e quello troppo basico hanno denaturato l’enzima. Quindi ogni enzima ha un suo pH ottimale.
Parte 4: Gli effetti della concentrazione del substrato sulla velocità dell’azione degli enzimi.
OBIETTIVO: Determinare gli effetti della variazione della concentrazione del substrato sulla velocità dell’azione enzimatica.
STRUMENTI:
- 4 Provette con portaprovette;
- Pipetta graduata da 5 mL;
- Pipetta monouso;
SOSTANZE:
- Soluzione tampone Fosfato (pH 7);
- Succo di patata;
- Catecolo (0,1%).
PROCEDIMENTO:
- Numerare le provette;
- Inserire 5 mL di soluzione tampone fosfato a pH 7 in tutte le provette;
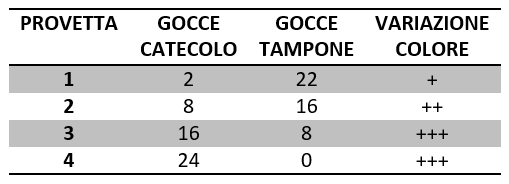
- Aggiungere nella prima provetta 2 gocce di catecolo e 22 gocce di soluzione tampone;
- Aggiungere nella seconda provetta 8 gocce di catecolo e 16 gocce di soluzione tampone;
- Aggiungere nella terza provetta 16 gocce di catecolo e 8 gocce di soluzione tampone;
- Aggiungere nella quarta provetta 24 gocce di catecolo;
- Inserire in tutte le provette 30 gocce di succo di patata;
- Agitare tutte le provette e annotare la variazione di colore di tutte le provette in tabella.
 RISULTATI:
RISULTATI:
La variazione di colore in ciascuna provetta, aumenta con l’aumentare della concentrazione del substrato, ciò significa che se si aumenta la quantità di substrato, la velocità di reazione è maggiore e la velocità della reazione catalizzata dalla catecolasi è proporzionale all’intensità di colore che si sviluppa in ogni provetta.
La terza e la quarta provetta hanno la stessa intensità di colore, questo significa che si ha una velocità massima oltre la quale la concentrazione del substrato non influisce sulla velocità della reazione perché tutto l’enzima è già impegnato nel complesso enzima-substrato. Quindi, ogni enzima ha una propria velocità ottimale di azione per una certa quantità di substrato.