Un capitolo rilevante della chimica biologica che fa parte delle vie di trasduzione (trasferimento) all’interno della cellula è la modificazione post-traduzionale delle catene polipeptidiche. Può essere modificata la catena laterale covalentemente con l’aggiunta di un gruppo chimico.
Il gruppo chimico che è maggiormente studiato e presente come modificazione covalente è il gruppo fosforico, infatti ci sono una serie di enzimi che sono coinvolti nella trasduzione del segnale che sono gli enzimi chinasi e fosfatasi. Una chinasi è una famiglia (classe) di enzimi a cui appartengono tutti quelli enzimi che catalizzano reazioni di fosforilazione (di aggiunta di un gruppo fosforico) a una determinata molecola (substrato). L’enzima antagonista della chinasi è la fosfatasi, l’enzima che rompe il legame che unisce il gruppo fosforico con la molecola di inizio. Quindi in queste vie di trasduzione del segnale sono importanti questi enzimi che a loro volta vengono attivati. Il risultato finale dell’azione di questi enzimi è l’aggiunta di un gruppo fosforico che può derivare da una molecola di ATP.
In una catena polipeptidica non tutti gli amminoacidi possono essere il sito di legame del gruppo fosforico, ma soltanto alcuni e il gruppo chimico che si presta meglio a reagire con il gruppo fosforico è il gruppo ossidrilico (-OH) e quindi tutti gli amminoacidi che posseggono un gruppo laterale –OH possono essere soggetti a fosforilazione. Esempi classici sono la serina, la treonina e a volte anche la tirosina che rispetto a treonina e serina è un amminoacido abbastanza idrofobico mentre queste reazioni avvengono in ambiente acquoso intracellulare.
Queste modificazioni post-traduzionali possono essere di tipo attivatorio o inibitorio: ci sono alcuni enzimi che con l’aggiunta del gruppo fosforico diventano più attivi e altri enzimi che invece si disattivano. Quando abbiamo due vie antagoniste fra loro, l’esempio classico è la via di degradazione/sintesi del glicogeno (omopolisaccaride del glucosio che rappresenta la maggior riserva di glucosio delle nostre cellule soprattutto a livello epatico e muscolare). Il metabolismo del glicogeno è governato dallo stato energetico in cui si viene a trovare la cellula. Quindi quando c’è una richiesta di energia si va incontro alla degradazione del glicogeno con l’enzima glicogeno fosforilasi, quando invece lo stato energetico della cellula è sufficientemente elevato e non c’è bisogno della degradazione di glicogeno, il glucosio viene immagazzinato sotto forma di glicogeno e quindi l’enzima è la glicogeno sintetasi. Questi due enzimi sono regolati in maniera molto specifica affinché la cellula sia rispondente a richieste di energia in qualsiasi livello della giornata e in qualsiasi tessuto. La cosa interessante è che una delle modalità per regolare il metabolismo (catabolismo e anabolismo) del glicogeno è l’aggiunta di un gruppo fosforico dove lo stesso tipo di modificazione covalente viene effettuata sia sull’enzima catabolico (glicogeno-fosforilasi) che su quello anabolico (glicogeno-sintasi), soltanto che hanno un effetto inverso, perché la glicogeno-fosforilasi diventa più attiva con l’aggiunta del gruppo fosforico, la glicogeno-sintasi diventa meno attiva. Questa è una dimostrazione dell’intelligenza della cellula che sfrutta lo stesso tipo di modificazione covalente su enzimi antagonisti con significato opposto. Quindi contemporaneamente attiva una via e inibisce quella antagonista.
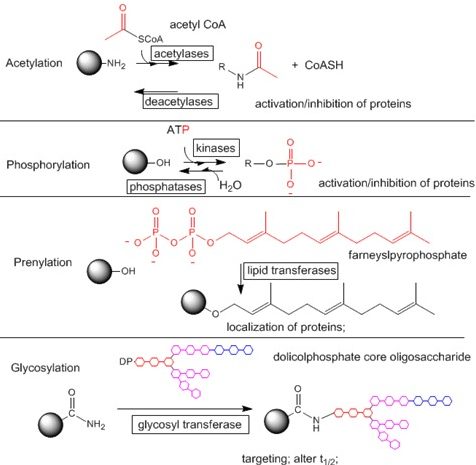
Altri tipi di modificazioni covalenti sono l’acetilazione, prenilazione e glicosilazione. Tra questi tre tipi di modificazioni covalenti la più importante è l’acetilazione. Acetilazione vuol dire legare un gruppo acetilico, un frammento bicarbonioso che deriva dall’acetil-Coenzima A. Questo gruppo acetilico può essere legato in corrispondenza della lisina che tra i vari amminoacidi che terminano con un gruppo amminico, è quello che può andare incontro a questo tipo di modificazione. Infatti ci sono molti anticorpi usati in laboratorio che permettono di determinare lo stato di acetilazione di vari tipi di proteine che sono rivolti verso la lisina acetilata. Anche in questo caso l’aggiunta di questo gruppo può avere un significato di attivazione o inibizione delle proteine. Un esempio di significato biologico rilevante per quanto riguarda l’acetilazione è quello che si ha nella catena respiratoria in cui molte sub unità enzimatiche possono andare incontro a modificazioni post-traduzionali, tra cui c’è anche l’acetilazione e deacetilazione.


