I radicali liberi dell’ossigeno sono coinvolti in numerose patologie. Il radicale libero è una specie chimica che presenta un elettrone spaiato, che ha sete di stabilizzarsi, e lo fa interagendo con numerose strutture cellulari a cui sottrarre elettroni per stabilizzarsi (proteine, lipidi di membrana, acidi nucleici). Normalmente i radicali liberi dell’ossigeno vengono prodotti dalla cellula, tuttavia esistono dei sistemi antiossidanti in grado di eliminarli. Quando la produzione di questi diviene soverchiante rispetto agli antiossidanti fisiologici si parla di stress ossidativo. I radicali liberi sono prodotti soprattutto a seguito di scorretta ossigeno-terapia, a seguito di infiammazione, a seguito di inalazione di smog e dopo radioterapia.
Non bisogna pensare che i ROS siano sempre dannosi: in molti casi tornano utili! Ad esempio vengono prodotti da fagociti, in particolare acqua ossigenata ed anione superossido, per demolire il materiale fagocitato durante il processo infiammatorio.
I ROS (Reactive Oxygen Species) più importanti sono:
- Anione superossido O2–: è un sottoprodotto della fosforilazione ossidativa a livello del complesso IV (citocromo c ossidasi). Infatti non sempre la riduzione dell’ossigeno nella catena respiratoria è completa e così si ottiene come sottoprodotto l’anione superossido. Può danneggiare il DNA, tuttavia la sua azione è molto limitata in quanto è instabile termodinamicamente rispetto agli altri ROS. Ad ogni modo può essere trasformato dall’enzima superossido dismutasi (SOD) in perossido di idrogeno e successivamente demolito dalla catalasi ad acqua ed ossigeno attivo.
- Perossido di idrogeno o acqua ossigenata (H2O2): prodotto fisiologicamente dalla superossido dismutasi, la quale è in grado di reagire con l’anione superossido in modo da trasformarlo in perossido di idrogeno. È prodotto anche da alcune perossidasi lisosomiali. Può essere degradato da catalasi, le quali lo demoliscono ad acqua ed ossigeno attivo (lo si può notare quando si applica acqua ossigenata sulle ferite).
- Radicale ossidrilico •OH: può essere prodotto da lisi di acqua dovuta a radiazioni, o tramite la reazione di Fenton dal perossido di idrogeno e ione ferroso (che si ossida a ione ferrico). Questo radicale può produrre numerosi danni, ma può essere inattivato tramite la glutatione perossidasi che lo trasforma in acqua.
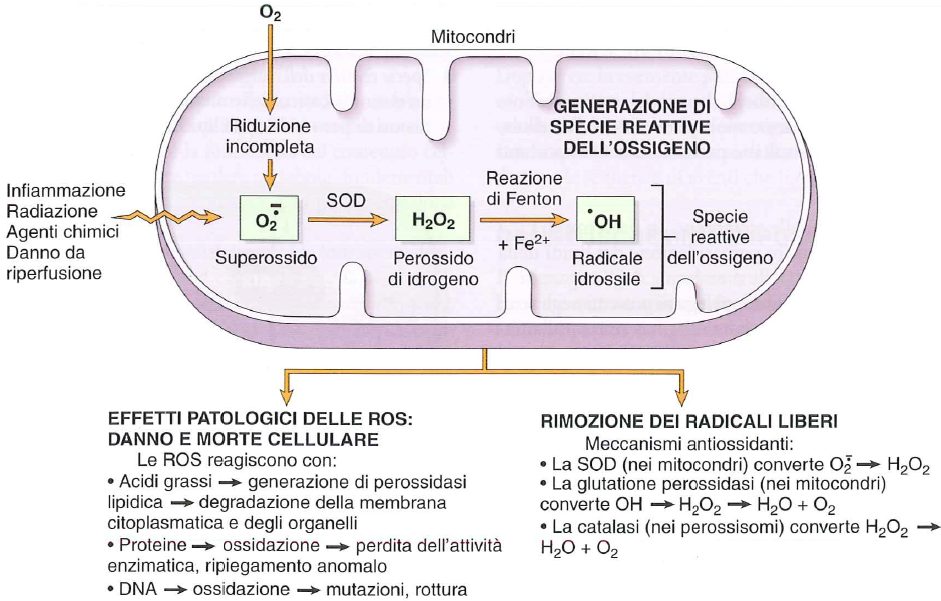
Il radicale ossidrilico può essere prodotto dalla reazione di Fenton, che però ossida lo ione ferroso a ione ferrico. Questo però, reagendo con l’anione superossido può ridursi a ione ferroso: il risultato è che la reazione si autoalimenta in quanto lo ione ferroso prodotto può generare altro radicale ossidrilico reagendo col perossido di idrogeno. Tale reazione viene definita reazione di Haber-Weiss catalizzata dal ferro, o reazione di Fenton promossa dall’anione superossido.
La produzione di radicali liberi può essere innescata da:
- Respirazione mitocondriale;
- Raggi UV;
- Radiazioni ionizzanti (da questo deriva l’efficacia dei trattamenti radioterapici);
- Ossido nitrico: può essere prodotto da macrofagi durante il processo infiammatorio, ma anche da cellule endoteliali e neuroni. Questo può produrre i radicali liberi dell’azoto (RNS, Reactive Nitrogen Species) e reagire con l’anione superossido dando origine al perossinitrito;
- Produzione nei leucociti fagociti (soprattutto neutrofili ma anche macrofagi sono in grado di attivare una forte produzione di ROS che danneggiano il tessuto);
- Sostanze chimiche (es: tetracloruro di carbonio quando viene metabolizzato da determinate ossidasi intracellulari si può avere la formazione di radicali liberi);
- Presenza di metalli: nel nostro organismo abbiamo sistemi che immagazzinano il ferro (come transferrina e ferritina, molecole responsabili dell’accumulo di rame come ceruloplasmina. C’è un disordine genetico a livello di proteine responsabili della escrezione del rame attraverso la bile, questi hanno un surplus di rame, chiamato morbo di Wilson).
I sistemi enzimatici in grado di favorire la rimozione di radicali liberi dal nostro organismo sono molti:
- superossido dismutasi (quella mitocondriale usa il manganese come cofattore, mentre quella citoplasmatica il rame-zinco) può prendere l’anione superossido e trasformarlo in acqua ossigenata. L’acqua ossigenata può dismutare spontaneamente, oppure grazie all’azione della catalasi dare origine ad acqua e ossigeno.
- glutatione perossidasi: Il perossido di idrogeno può essere rimosso grazie alla GSH (glutatione ridotto) e si ha la formazione di GSSG (glutatione ossidato e dimerizzato) e poi l’acqua. Ovviamente per far star bene la cellula dobbiamo avere un ottimo rapporto tra GSSG e GSH infatti tale rapporto informa dello stato ossido riduttivo della cellula.
- Catalasi: presente nei perossisomi, capace di convertire l’acqua ossigenata.
I ROS possono provocare danni a livello di lipidi, proteine e a livello del materiale nucleare. Uno dei principali meccanismi di danno da radicali liberi riguarda il danneggiamento di membrane biologiche della cellula tramite perossidazione delle catene degli acidi grassi polinsaturi delle code dei fosfolipidi di membrana, innescando una reazione a catena che si autoamplifica. L’olio rancido è un esempio di avvenuta perossidazione lipidica (sul fondo della bottiglia si crea un aggregato biancastro costituito da perossidi lipidici).
Nella perossidazione lipidica c’è una reazione di innesco fra acido grasso polinsaturo (PUFA, Polyunsaturated Fatty Acids) e il radicale libero, a livello di un doppio legame dell’acido grasso stesso. Il radicale ruba un elettrone dal doppio legame, producendo pertanto un radicale lipidico il quale può reagire con l’ossigeno producendo un radicale perossilipidico, che può andare ad interagire con un altro lipide. Il processo pertanto si autoamplifica (reazione di propagazione) fino a che non si giunge ad una reazione di arresto. La perossidazione produce non solo perossidi lipidici, ma induce anche delle distorsioni delle code dei fosfolipidi con effetti sulle membrane di cui fanno parte.
La reazione di arresto è costituita dalla reazione di due radicali lipidici o perossilipidici fra di loro, in modo che si neutralizzino a vicenda. Tuttavia nella cellula la reazione d’arresto può essere mediata anche da una molecola scavenger antiossidante, come la Vitamina E (tocoferolo): antiossidante naturale formidabile, dona un elettrone al radicale lipidico o perossilipidico trasformandosi a sua volta in un radicale α-tocoferossilico, il quale tuttavia è relativamente stabile grazie alla risonanza, e può essere ripristinato dal glutatione ridotto (che diviene glutatione ossidato, il quale successivamente viene ripristinato a glutatione ridotto dalla glutatione reduttasi con consumo di NADPH) o dalla Vitamina C o dal coenzima Q10. Pertanto la Vitamina E è essenziale nella dieta, una sua carenza porta ad emolisi, essendo la membrana eritrocitaria particolarmente suscettibile a danni ossidativi dati dalla perossidazione lipidica.
Un aspetto importante del danno da ROS, è il ruolo che rivestono nei traumi del SNC: in caso emorragie cospicue il ferro può dare origine a radicali liberi. La guaina mielinica è particolarmente ricca in lipidi, pertanto il SNC è particolarmente sensibile a danno da ROS. I ROS avrebbero anche un ruolo in alcune malattie neurodegenerative, quali l’Alzheimer.
Il danno alle membrane biologiche è diverso a seconda della membrana coinvolta:
- Membrana mitocondriale: determina apertura del poro di transizione di permeabilità mitocondriale e liberazione delle proteine contenute all’interno, capaci di innescare la morte per apoptosi.
- Membrana citoplasmatica: perdita dell’equilibrio osmotico, con ingresso di liquidi e ioni e fuoriuscita del contenuto cellulare.
- Membrana lisosomiale: fuoriuscita degli enzimi lisosomiali nel citoplasma e conseguente attivazione delle idrolasi. Gli enzimi contenuti nei lisosomi causano digestione di proteine, RNA, DNA, glicogeno e morte della cellula per necrosi.
Nel danno da ROS si può avere anche un danneggiamento di proteine e si possono avere:
- ossidazioni a carico delle catene laterali degli amminoacidi;
- formazione di legami crociati fra le catene proteiche (per reazione fra catene laterali radicaliche degli amminoacidi) che inducono ulteriori distorsioni nelle proteine;
- reazioni di frammentazione causate da minore stabilità delle strutture polipeptidiche.
Nel DNA i radicali liberi possono indurre la formazione dei dimeri di timina e questo processo è coinvolto nell’invecchiamento cellulare e nelle trasformazioni neoplastiche.





