Fonte: Manuale di preclinica.
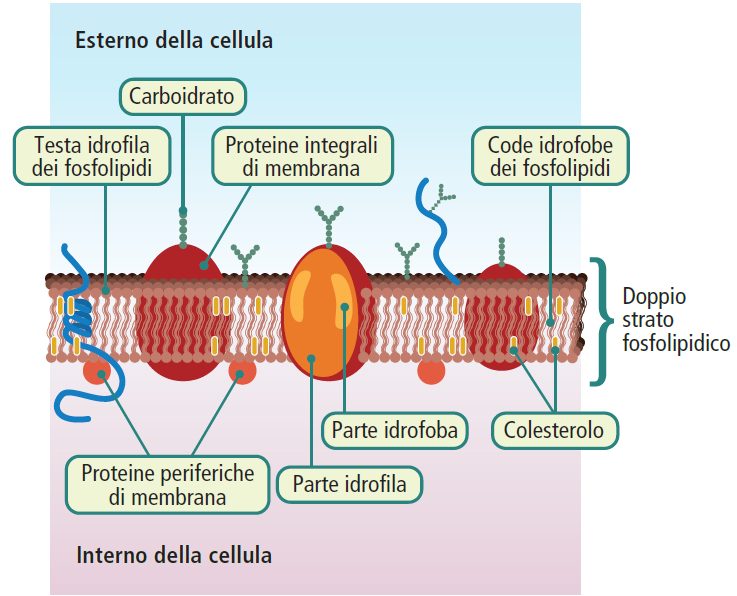
La membrana plasmatica presenta una struttura semipermeabile che consente il passaggio selettivo di determinate sostanze.
Essa permette il movimento di molecole idrofobe come lipidi, ormoni steroidei e acidi grassi. Inoltre, alcune piccole molecole polari, come acqua, urea, glicerolo, etanolo e indolo, riescono a attraversarla, anche se con qualche difficoltà, a condizione che non siano zwitterioniche.
Al contrario, le sostanze idrofile come ioni e molecole polari, o molecole di dimensioni più grandi, non possono dissolversi nel doppio strato fosfolipidico e richiedono pertanto specifici meccanismi di trasporto.
Esistono due tipi di trasporto attraverso la membrana:
- Trasporto passivo: in questo caso, le molecole attraversano il doppio strato fosfolipidico seguendo un gradiente di concentrazione, senza richiedere l’utilizzo di energia.
- Trasporto attivo: in questo caso, il movimento delle molecole avviene contro il gradiente di concentrazione e richiede l’apporto di energia. Il trasporto attivo può essere di due tipi: primario o secondario.
Trasporto passivo
Le molecole di dimensioni ridotte e idrofobe, come ad esempio alcuni gas come ossigeno, azoto e anidride carbonica, attraversano facilmente la membrana plasmatica. Esistono due tipi di trasporto passivo all’interno della cellula:
- Diffusione semplice: se la molecola è piccola e priva di carica, si muove attraverso la membrana seguendo il gradiente di concentrazione, cioè dalla zona di maggiore concentrazione verso quella di minore concentrazione.
- Diffusione facilitata: la maggior parte delle molecole come amminoacidi, zuccheri, nucleotidi, ioni, ecc., passa attraverso la membrana grazie a proteine trasportatrici o canali proteici.
Le proteine trasportatrici sono specifiche per un tipo di molecola e, mediante cambiamenti nella loro conformazione, consentono il passaggio di specifiche molecole da un lato all’altro della membrana attraverso legami deboli.
I canali ionici, invece, sono specifici per un particolare ione, come il sodio (Na+), il potassio (K+), il calcio (Ca++) o il cloro (Cl–).
Fonte: Manuale di preclinica.
Le proteine canale possono essere costantemente aperte o controllate da meccanismi come stimoli meccanici, chimici o elettrici. Le proteine trasportatrici, invece, permettono il passaggio delle molecole secondo il gradiente di concentrazione modificando la loro conformazione.
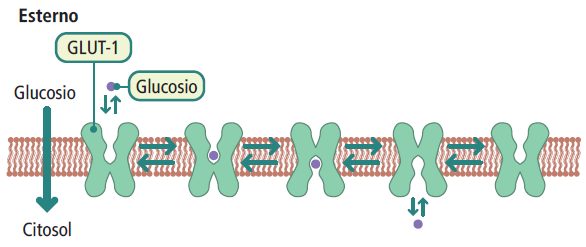
Un esempio noto di proteine trasportatrici è la famiglia delle GLUT (glucose transporter), che trasferiscono il glucosio attraverso la membrana plasmatica. Nell’uomo, ci sono diverse isoforme di GLUT (GLUT-1, GLUT-2, GLUT-3, GLUT-4, GLUT-n), ognuna con caratteristiche specifiche di cinetica, distribuzione tissutale e funzione.
La GLUT-4, in particolare, è il trasportatore del glucosio più conosciuto ed è presente nel citoplasma. La sua traslocazione sulla membrana cellulare è stimolata dall’insulina, facilitando l’assorbimento del glucosio nell’interno della cellula. Dopo che la concentrazione di glucosio nel sangue si normalizza e la secrezione di insulina diminuisce, le molecole di GLUT-4 vengono gradualmente rimosse dalla membrana plasmatica e sequestrate all’interno di vescicole mediante endocitosi.
La GLUT-2, presente principalmente nel fegato, svolge un ruolo importante nel passaggio del glucosio tra la cellula epatica e il liquido interstiziale. Questo è cruciale per la gluconeogenesi, il processo di sintesi del glucosio a partire da aminoacidi, glicerolo e acido lattico, che deve poi essere rilasciato nel sangue. La GLUT-2 può trasportare anche altri zuccheri come galattosio, mannosio e fruttosio.
Il fruttosio è anche trasportato dalla GLUT-5, che ha una maggiore affinità per il fruttosio rispetto al glucosio.
Le GLUT-1 e GLUT-3 sono trasportatori del glucosio indipendenti dall’insulina e si trovano principalmente negli eritrociti e nei neuroni. La GLUT-1 è coinvolta nell’assunzione basale di glucosio, mentre la GLUT-3 è responsabile dell’assunzione basale di glucosio nei neuroni.
Il trasporto passivo dell’acqua attraverso la membrana avviene mediante osmosi, in cui le molecole di acqua si spostano attraverso la membrana dalla soluzione con minore concentrazione di soluti (soluzione ipotonica) a quella con maggiore concentrazione di soluti (soluzione ipertonica). In molti tessuti e tipi cellulari, il trasporto dell’acqua è mediato da canali specifici chiamati acquaporine, che permettono il passaggio selettivo dell’acqua.
Trasporto attivo primario e secondario
Nel trasporto attivo, ioni e molecole vengono spostati contro il proprio gradiente di concentrazione (o potenziale) utilizzando energia tramite proteine chiamate “pompe“.
Nel trasporto attivo primario, le proteine utilizzano ATP per generare un gradiente di concentrazione e, nel caso del trasporto di ioni, anche un gradiente elettrico attraverso la membrana, come nel caso della pompa Na+/K+ ATPasi. Questa proteina ubiquitaria transmembrana svolge un ruolo fisiologico principale nel controllo del volume cellulare e nella conferenza di eccitabilità alle cellule nervose e muscolari. Inoltre, è correlata ai trasporti attivi secondari di glucidi ed amminoacidi. La pompa è un antiporto, trasporta attivamente tre ioni sodio (Na+) dall’interno verso l’esterno della cellula e due ioni potassio (K+) dall’esterno verso l’interno, mantenendo il gradiente di soluti e la polarità elettrica della membrana (bassi livelli di sodio e abbondante potassio intracellulare).
Durante il processo di trasporto, all’inizio, tre ioni Na+ si legano a siti specifici intracellulari ad alta affinità della proteina intermembrana che funge da pompa. Questo legame stimola la fosforilazione dipendente dall’ATP della pompa, determinando un cambiamento conformazionale della proteina di trasporto. I siti di legame per gli ioni Na+ vengono esposti verso l’ambiente extracellulare, riducendo così l’affinità della proteina per questi ioni, che vengono quindi rilasciati fuori dalla cellula. Contemporaneamente alla fuoriuscita degli ioni Na+, due ioni K+ si legano a siti specifici esposti verso l’ambiente extracellulare, stimolando la defosforilazione della proteina, che torna al suo stato conformazionale iniziale e rilascia questi ioni all’interno della cellula. Questo processo contribuisce al mantenimento dei gradienti ionici che sono alla base della differenza di potenziale esistente tra l’ambiente intra- ed extracellulare, che è di circa -70 mV. Tale differenza è nota come potenziale di membrana.
La concentrazione di sodio all’esterno della membrana cellulare è di 143 mM, mentre all’interno è di 14 mM. Al contrario, la concentrazione di potassio è da 10 a 14 volte maggiore all’interno (circa 150 mEq/litro).
Nel trasporto attivo secondario, le proteine sfruttano il gradiente di concentrazione generato da un trasporto attivo primario anziché utilizzare energia direttamente. Un esempio classico di ciò è rappresentato dai trasportatori SGLUT (sodium glucose transporter), che sono simporti Na+-glucosio localizzati sulla membrana apicale degli enterociti. Questi cotrasportatori consentono l’ingresso di glucosio all’interno della cellula contro il suo gradiente di concentrazione, utilizzando il movimento di ioni sodio che entrano nella cellula secondo il loro gradiente di concentrazione, generato dalla pompa sodio-potassio ATPasica.
Esistono due tipi di trasportatori SGLUT, codificati dal gene SLC5A1: il primo, chiamato SGLUT-1, è principalmente espresso nelle cellule dell’intestino tenue e nei segmenti s2 e s3 del tubulo renale, e cotrasporta una molecola di glucosio e due ioni sodio. Il secondo, chiamato SGLUT-2, è maggiormente espresso nel segmento s1 delle cellule del tubulo renale e cotrasporta una molecola di glucosio e un ione sodio. Il legame del sodio provoca una modificazione conformazionale che facilita il legame del glucosio e viceversa. Poiché la concentrazione di Na+ è molto più elevata nello spazio extracellulare rispetto al citosol, grazie all’attività della pompa sodio-potassio, il trasportatore riesce a accumulare il glucosio all’interno della cellula contro il suo gradiente di concentrazione.



