Per i radiofarmaci esistono molteplici vie di somministrazione, tra cui orale, endovenosa, intra-arteriosa, sottocutanea e inalatoria. I radiofarmaci PET vengono più frequentemente somministrati per via endovenosa, mentre procedure meno frequenti si basano sull’inalazione di gas radioattivi, come [11C] CO, [11C] CO2, [15O] CO e [15O] O2.
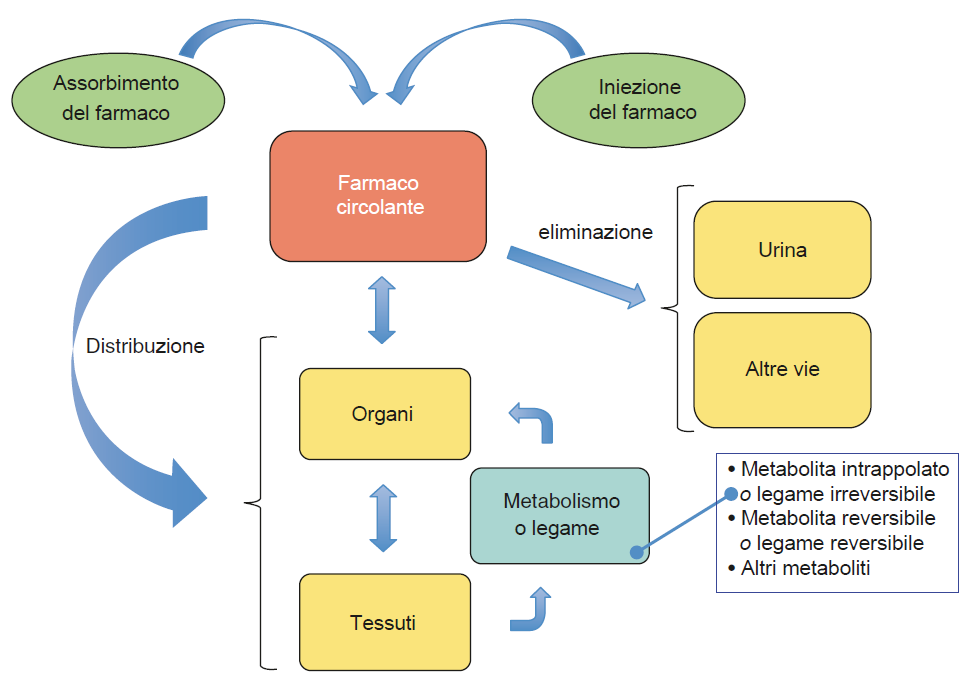
Il sangue è sia il veicolo che distribuisce il radiofarmaco in tutto il corpo, sia l’ambiente biochimico iniziale a cui è esposto il radiotracciante. Le caratteristiche molecolari/biochimiche del radiofarmaco determinano la sua permanenza nel sangue circolante così come il suo destino metabolico.
Le interazioni con le componenti del sangue (proteine e cellule) devono essere considerate anche per garantire che il radiofarmaco non venga degradato o trasformato. La fase vascolare è importante nell’analisi dei dati, poiché la distribuzione del tracciante (funzione di ingresso) è un parametro chiave.
La dimensione molecolare, la polarità e la presenza di meccanismi di permeazione attiva influenzano la capacità di un radiofarmaco di attraversare l’endotelio vascolare e diffondersi nello spazio interstiziale. Il [18F] FDG entra nel cervello attraverso un processo di diffusione facilitata mediato dal trasportatore del glucosio-1 (GLUT-1). Molti organi hanno endotelio altamente specializzato (come la barriera emato-encefalica); quindi, ogni tracciante deve soddisfare requisiti specifici che devono essere considerati a priori durante la progettazione della molecola.
I parametri classici comunemente utilizzati nella progettazione dei farmaci (LogP, LogS, PSA, ecc.) vengono considerati durante la fase di progettazione del tracciante come caratteristiche necessarie (anche se non sempre sufficienti).
Caratteristiche molecolari e test precoci per la loro valutazione
| Proprietà molecolari | Caratteristiche | Descrizione | |
|---|---|---|---|
| Dimensione/peso molecolare | MW influisce sul coefficiente di diffusione nelle membrane fisiologiche | ||
| Lipofiliaa | Calcolob di log P | ||
| Solubilità | Solubilità prevista (calcolata da parametri molecolari) | ||
| Area superficiale polare | Metrica (Å2) utilizzata per prevedere la capacità di un farmaco di permeare le barriere cellulari | ||
| Accettori di legami H | Numero di gruppi che sono accettori di legami ad idrogeno | ||
| Donatori di legami H | Numero di gruppi che sono donatori di legami ad idrogeno | ||
| Lipofilia | Logaritmo del coefficiente di partizione della molecola tra un solvente organicoc e l’acqua (specie neutra). | ||
| Legame ad idrogeno | (log P N-ottanolo/acqua )-(log P esano/acqua) | ||
| Lipofilia/ionizzazione | Logaritmo del coefficiente di distribuzione tra un solvente organico e un tampone (di solito pH = 7.4) | ||
| Solubilità | Speciazione effettuata in acqua e/o fluidi biologici | ||
| Acido-base | Il logaritmo negativo della costante di ionizzazione in acqua | ||
| Indice di idrofobicità cromatica | Parametro derivato da test analitici (HPLC), condotti sulla sostanza candidata | ||
Proprietà sperimentali (biologiche in vitro) | Stabilità metabolica | Il plasma e il sangue contengono idrolasi, in particolare proteasi e esterasi, con attività idrolitica su legami esteri e/o ammidi | |
| Frazione di farmaco libera | Il legame alle proteine plasmatiche può influenzare profondamente la biodisponibilità del farmaco al bersaglio | ||
| Biotrasformazione Stabilità metabolica | Gli epatociti contengono tutti gli enzimi metabolizzanti dei farmaci e riproducono perfettamente la situazione in vivo. La preparazione microsomale epatica contiene tutti gli isoenzimi del CYP e altri enzimi metabolici, come FMO e UGT, per la metabolizzazione ossidativa e coniugativa | ||
| Affinità di legame | EC50= concentrazione di farmaco necessaria per ottenere la metà della risposta massima IC50= concentrazione di un inibitore che riduce la risposta (o il legame) del 50% |
||
| Permeabilità delle biomembrane | Modello cellulare che deriva da cellule di adenocarcinoma del colon umano e che esprime trasportatori di efflusso (e vari trasportatori di ingresso) | ||
| Permeabilità delle biomembrane | Modello di cellule renali canine Madin-Darby. Cellule polarizzate con bassa espressione di trasportatori ABC | ||
bCalcolo basato sulla struttura molecolare e sui gruppi chimici presenti nella molecola.
cDi solito viene utilizzato l’ottanolo; possono essere utilizzati altri solventi per esplorare particolari caratteristiche di legame ad idrogeno della molecola (neutro/donatore/accettore, ad esempio esano/cloroformio/dipelargonato di propilen glicole).
I traccianti PET generalmente subiscono specifiche interazioni molecolari per raggiungere un tessuto/organo bersaglio specifico.
Quando si quantifica la distribuzione della radioattività, è importante distinguere la forma chimica che porta il radionuclide. Le trasformazioni che possono verificarsi dal sangue all’escrezione finale devono essere conosciute. Questo è obbligatorio quando si utilizza un approccio di modellazione per stime quantitative della concentrazione regionale di una specie radiomarcata selezionata. Il campionamento del sangue e l’analisi radiochimica possono essere necessari per identificare i metaboliti derivati dal radiofarmaco originale.
D’altra parte, la biotrasformazione in vivo per sé può essere l’obbiettivo dell’indagine con un tracciante PET. Ad esempio, l’ischemia tissutale porta all’alterazione della capacità redox locale e del pH; alcuni tracciatori PET possono rispondere a queste alterazioni cambiando la loro natura chimica iniziale e causando così l’accumulo locale di radioattività. Il miocardio ipossico o i tumori ipossici sono i bersagli tipici per questo approccio di imaging. I traccianti che si accumulano nei tessuti ipossici si basano su elementi sensibili alla redox (come il rame nel 67Cu-PTSM) o su gruppi molecolari sensibili alla redox (come la componente 2-nitroimidazolo del 18F-FMISO).
I traccianti la cui stabilità dipende dal pH, come 68Ga-citrato o pHLIPs (peptidi di inserzione a pH basso), sono marcati sia con 18F che con 68Ga. Tuttavia, il meccanismo di accumulo locale dei traccianti sensibili alla redox e al pH non è ancora completamente chiaro.
La maggior parte dei traccianti PET sono progettati per adattarsi ad una specifica tasca di legame di una molecola bersaglio o entrare in una via biochimica. Pertanto, la struttura molecolare e l’impatto della porzione di marcatura (radionuclide e gruppo prostetico se presente) devono essere attentamente valutati per progettare traccianti adatti.
Recettori e enzimi, bersaglio di diversi ligandi/tracciatori PET, costituiscono le applicazioni più tipiche per sfruttare la selettività e la specificità del meccanismo a chiave e serratura. Il ligando del recettore (o il substrato dell’enzima) si adatta a un sito di legame specifico e, facendo ciò, determina la risposta biochimica. Una vasta varietà di sistemi di recettori è stata valutata con tracciatori PET.
Radiotraccianti per sistemi neurotrasmettitoriali e recettoriali
| 18F-FDOPA | Sintesi della dopamina | Dopamina | Malattia di Parkinson (DA) Insulinoma (DA) |
| 18F-Fluorometiltirosina (18F-FMT) | Tumori cerebrali (DA, RT) | ||
| [11C]SCH23390 | Antagonista del recettore D1 | Sindromi parkinsoniane (RT) Schizofrenia (RT) Sviluppo di farmaci del SNC |
|
| [11C]NNC-112 | |||
| [11C]N-metilspiperone | Densità dei recettori D2/D3 e 5HT2A | ||
| [11C]raclopride | Antagonista dei recettori D2/D3 | ||
| [11C]-(+)-PHNO | Agonista dei recettori D2/D3 | ||
| 18F-fallypride | Recettore D2 extrapiramidale (reversibile) | Psicosi nella AD (RT) Disturbi del controllo dell’impulso nella PD Sviluppo di farmaci del SNC |
|
| [11C]WIN-35428 | Trasportatore della dopamina | Narcolessia (RT) Abuso di farmaci/droghe (RT) |
|
| [11C]cocaina | |||
| 18F-FECNT | Malattia di Parkinson (DA) Sintomi psichiatrici nella PD (RT) Demenza (a corpi di Lewy) (RT) |
||
| 18F-FP-β-CIT |
|||
| 18F-nor-β-CIT |
|||
| [11C]idrossitriptano ([11C]5-HTP) | Precursore di sintesi della serotonina | Serotonina | Tumori neuroendocrini (DA) Disforia e disturbi di ansia sociale (RT) |
| [11C]WAY-100635 | Antagonista dei recettori 5HT1A | Depressione Recupero funzionale post-infarto (RT) |
|
| 18F-altanserina | Antagonista dei recettori 5HT2A | ||
| 18F-setoperone | Antagonista dei recettori 5HT2A | ||
| 4-18F-ADAM | Trasportatore della serotonina | Disturbi del comportamento (RT) Depressione (RT) Sviluppo di farmaci del SNC |
|
| [11C]AFM | |||
| [11C]MADAM | |||
| [11C]diidrotetrabenazina ([11C]DTBZ) | Trasportatore di monoammine vescicolare | Monoammine | Depressione (CA, RT) Monitoraggio terapeutico (RT) |
| [11C]L-deprenyil-D2 | Inibitore irreversibile delle MAO-B | ||
| [11C]clorgiline | Inibitore irreversibile delle MAO-A | ||
| [11C]carfentanil | Agonista μ-OR | Recettore degli oppioidi (OR) | Schizofrenia (RT) Dipendenze (RT) Sistemi cerebrali di aspettativa e ricompensa (RT) Cambiamenti di umore (RT) |
| [11C]LY-2795050 | Antagonista κ-OR | ||
| 18F-(-)cyclofoxy | Antagonista μ/κ-OR | ||
| [11C]metilnaltrindolo | Antagonista δ-OR | ||
| [11C] o 18F-diprenorfina | Antagonista μ,κ,δ-OR | ||
| 18F-FE-PEO | Agonista completo degli OR | ||
| [11C]buprenorfina | Agonista e antagonista misto degli OR | ||
| 18F-FPEB | mGluR sottotipo 5 (mGluR5) | Recettore del glutammato metabotropico (mGluR) | Dipendenza da alcol (RT) |
| [11C]ABP688 | Displasia corticale focale (RT) | ||
| [11C]ITMM | mGluR sottotipo 1 (mGluR1) | Disturbi neuropsichiatrici (schizofrenia, disturbo bipolare, dipendenza) (RT) | |
| 18F-FIMX |
|||
I ligandi PET possono facilitare le fasi iniziali dello sviluppo di un composto farmaceutico per valutare la farmacocinetica negli esseri umani. La localizzazione di questi agenti radiomarcati dimostra il principio di funzionamento, risparmiando tempo nello sviluppo di nuovi farmaci.
L’alta radioattività specifica dei traccianti PET svolge un ruolo chiave in questa applicazione, poiché possono essere somministrati e tracciati anche a basse concentrazioni di ligandi nei loro siti di segnalazione. Nel caso specifico dei ligandi recettoriali, la reversibilità del legame e l’affinità del ligando PET con il bersaglio devono essere considerate, per garantire che il tracciante rifletta il vero comportamento del recettore nelle condizioni fisiologiche e nell’uso previsto (ad esempio, per la mappatura del numero totale di recettori, la mappatura della modulazione del recettore, ecc.).
Esistono due principali strategie per valutare un processo enzimatico: substrato suicida, per cui il tracciante interagisce con il sito di legame in modo irreversibile, e substrati “normali”, per cui il tracciante interagisce con l’enzima secondo il percorso previsto.
Un esempio del primo tipo di substrato è il [11C]-l-deprenyl-D2, utilizzato per investigare l’astrocitosi nelle malattie neurodegenerative. Questo ligando si lega selettivamente e irreversibilmente alla monoamino ossidasi-B (MAO-B) nel cervello e agisce come un inibitore suicida attraverso la formazione
di un legame covalente con la parte enzimatica, permettendo così una mappatura regionale dei siti di densità enzimatica.
Il [18F]FDG è un esempio paradigmatico del secondo tipo di interazione substrato/enzima. Il [18F]FDG è un substrato dell’enzima esochinasi che lo trasforma nel prodotto fosforilato, [18F]FDG-6-P. A sua volta, [18F]FDG-6-P, che non è adatto ad essere un substrato dell’enzima glucosio-6-fosfato isomerasi, rimane intrappolato nella cellula. Infatti, il tasso di fosforilazione e il rapporto trasporto/estrazione non sono gli stessi per [18F]FDG e glucosio, e devono essere utilizzati correttivi adeguati per misurare i tassi metabolici del glucosio locale utilizzando i dati derivati dalla PET sui tassi di estrazione del [18F]FDG.
A questo scopo, è stata calcolata una “lumped constant” (LC) da alcuni esperimenti confrontando [18F]FDG con [3H]glucosio o [14C]glucosio (biochimicamente identico al glucosio nativo).
In questo contesto, è importante considerare che il lumped constant può variare tra diversi tessuti, diverse regioni del cervello e anche all’interno dello stesso tessuto/organo durante le condizioni di malattia rispetto a quelle fisiologiche.
L’esempio del [18F]FDG come substrato intrappolato metabolicamente ha aperto la strada allo sviluppo di altri traccianti PET.
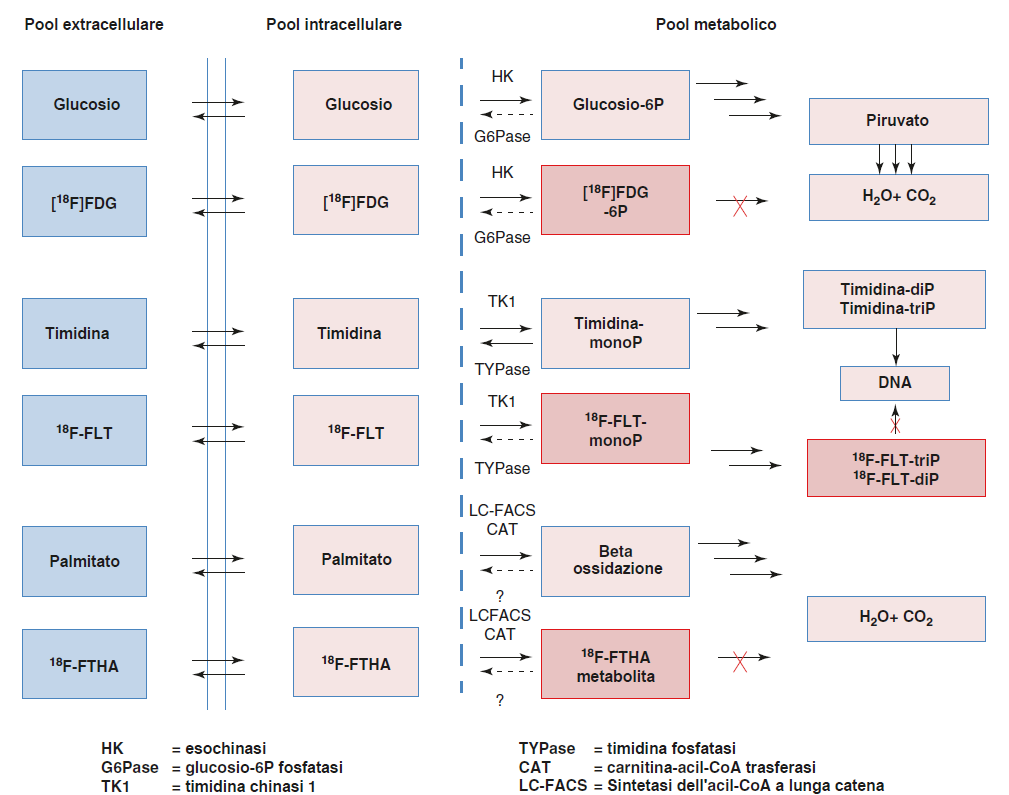
Un ulteriore obiettivo dei traccianti PET è la valutazione del trasporto molecolare e delle misurazioni del pool. L’omeostasi e la funzione cellulare si basano ampiamente su meccanismi che regolano il transito delle molecole attraverso le membrane e la loro concentrazione intracellulare.
Le proteine trasportatrici di soluti, i recettori legati ai canali ionici, i recettori legati alle proteine G e i recettori legati agli enzimi sono stati sfruttati per sviluppare traccianti PET per l’imaging molecolare. Ad esempio, molti sistemi di trasporto per gli aminoacidi (AA) sono potenziati nelle cellule neoplastiche. La [11C]metil-L-metionina è stata utilizzata per l’immagine del trasporto aumentato di AA e del metabolismo delle proteine nei tumori cerebrali, superando così i limiti della PET con [18F]FDG dovuti all’elevato sfondo associato all’assorbimento fisiologicamente elevato di [18F]FDG nel cervello.
Lo sviluppo di AA marcanti con 18F, con tempi logistici e di scansione migliorati, ha notevolmente ampliato le applicazioni cliniche di questo approccio, mirando a diversi tumori tramite i sistemi di trasporto degli AA associati.
I trasportatori regolano anche l’efflusso di xenobiotici e sostanze tossiche dallo spazio intracellulare a quello extracellulare. La famiglia dei trasportatori ABC (dall’inglese ATP-binding cassette), ed in particolare la glicoproteina-P (PgP) nella sua isoforma I (MDR1/ABC1 o Multidrug Resistance Pump), può essere mirata con traccianti PET per la selezione dei pazienti per la chemioterapia e per l’adattamento del trattamento. I traccianti PET per i substrati di PgP (ad es. [11C]daunorubicina) o gli inibitori di PgP (ad es. [11C]verapamil) sono stati testati per valutare l’espressione e la quantificazione di MDR nei pazienti affetti da tumori maligni.
La proteina translocator a 18 kDa (TSPO) è minimamente espressa nelle cellule gliali normali e viene sovraespressa in risposta a lesioni cerebrali e infiammazione dovuta all’attivazione delle microglie; i substrati di TSPO sono stati marcati con radioisotopi per valutare la neuroinfiammazione così come alcuni tipi di tumori e infiammazione periferica.
Esempi dei traccianti che rappresentano il trasporto molecolare sono riassunti nella seguente tabella.
| [15O]acqua | Substrato liberamente diffondibile | Flusso sanguigno miocardico e perfusione | Perfusione regionale (cardiologia, oncologia) |
| [13N]ammoniaca | Diffusione facilitata; intracellularmente intrappolato come glutammina | Perfusione miocardica, trasporto attraverso la barriera ematoencefalica | |
| 18F-flurpiridaz | Inibitore dell’NADH-ubiquinone ossidoreduttasi del complesso-1 mitocondriale (MC-1) | Perfusione miocardica | |
| 82Rb-cloruro | Internalizzato come catione monovalente e substrato di Na/K-ATPasi | Perfusione miocardica | |
| [18F]FDG | Trasporto facilitato da GLUT. Intrappolato intracellularmente, dopo fosforilazione da parte dell’esachinasi, con relazione diretta al tasso metabolico del glucosio | Metabolismo regionale | Oncologia Neurologia Cardiologia Infezione Infiammazione |
| [11C]colina | Trasporto e fosforilazione della colina aumentati nei tumori. Sottoposto a fosforilazione da parte della chinasi della colina, la [11C]colina fosforilata viene essenzialmente intrappolata all’interno delle cellule | Cancro alla prostata Sistema colinergicoa |
|
| [18F]FTHA | Trasporto facilitato dalla famiglia dei trasportatori monocarbossilati. Sono substrati delle sintetasi intracellulari di acetil-CoA. FTHA rimane intracellularmente intrappolato a causa dell’interruzione della β-ossidazione per sostituzione di zolfo per metilene lungo la catena | Metabolismo ossidativo Steatoepatite non alcolica e malattia del fegato grasso |
|
| [11C]palmitato | |||
| [11C]acetato | |||
| 18F-FMISO | Tutti sono basati sul 2-nitroimidazolo. Il tracciante diffonde passivamente attraverso le membrane e quindi viene ridotto da nitroreduttasi e forma legami covalenti intracellularmente sotto livelli ridotti di O2 | Ipossia regionale | Ossigenazione del tumore in oncologia (prima della terapia radiante) |
| 18F-FAZA | |||
| 18F-FETNIM | |||
| 64Cu-62Cu-ATSM | Il tracciante diffonde passivamente attraverso le membrane; il complesso subisce una riduzione intracellulare mediata da tioli. Il Cu(I) si separa dal complesso e si lega alle proteine intracellulari (via del Cu) | Ossigenazione del tumore in oncologia Ischemia/Ipossia miocardica |
|
| 68Ga-PSMA (e 18F-PSMA) | Indirizzato sulla glutammato carbossipeptidasi II o sull’antigene specifico della prostata (PSA) | Sovraregolazione della funzione ed espressione proteica | Tumore prostatico |
| [11C]-metil-L-metionina ([11C]MET) | Sistema L (trasporto di amminoacidi neutri indipendente da Na+) | Trasporto aumentato di aminoacidi | Tumori cerebrali |
| [11C]α-1-metiltriptofano ([11C]AMT) | Biomarcatore del processo epilettogenico | ||
| 18F-fluoroetiltirosina (18F-FET) | Tumore prostatico | ||
| 18F-fluciclovine(18F-FACBC) | ASCT2 (Sistema di scambio di aminoacidi dipendente da Na+ per Ala-Ser-Cys-Asp-Gln) | Tumore prostatico | |
| 18F-cis-4-fluoro-L-prolina | Sistema A (Trasporto dipendente da Na+ di amminoacidi neutri) e B0,+ (Trasporto indipendente da Na+ di cisteina e amminoacidi neutri e dibasici) | Preclinico: neurodegenerazione cerebrale e radionecrosi | |
| 18F-propil-L-glutammato | Sistema Xc- (antiportatore cisteina/glutammato) | Preclinica: resistenza ai farmaci basati su glutatione | |
| [11C]PK11195 | Ligandi candidati per la proteina del translocatore di 18 kDa | Sovraregolazione della funzione ed espressione proteica | Neuroinfiammazione (Attivazione della microglia) |
| [11C]DPA-713 | |||
| 18F-GE-180 | |||
| [11C]verapamil | Inibitore di glicoproteina P | Multi resistenza a farmaci | |
| [11C]loperamide | Substrato della glicoproteina P | ||
| 18F-fluoropaclitaxel | |||
| [11C]-6-bromo-metilpurina | Substrato della proteina multidrug resistance | ||
| [11C]dantrolene | Proteina di resistenza del cancro al seno |
aE’ richiesta un’elevata radioattività specifica.
Oltre al trasporto attraverso le membrane, è anche importante studiare ciò che accade all’interno delle cellule, incluso l’attività di geni specifici. I geni segnalatori possono essere un substrato (trasformato in un prodotto che è intrappolato metabolicamente all’interno della cellula o che agisce come substrato suicida) di un enzima codificato dal gene segnalatore. In alternativa, un ligando radiomarcato che agisce come sonda segnalatore può essere utilizzato per legarsi al recettore codificato dal gene segnalatore. Il principale limite di questo approccio è l’immunogenicità associata all’uso del transgene terapeutico, in particolare quelli basati su fonti virali e non umane.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.







