I radiofarmaci rappresentano una categoria di medicinali utilizzati in ambito medico per scopi diagnostici e/o terapeutici. La caratteristica distintiva di un radiofarmaco è la presenza di uno o più radionuclidi, ossia nuclei radioattivi, incorporati nella sua composizione.
Questa definizione genera una nuova prospettiva, superando la vecchia distinzione tra “tracciante” (originariamente utilizzato per molecole marcate di interesse biologico in studi metabolici in vitro o in vivo) e “indicatore” (riservato a molecole marcate per scopi diagnostici).
Attraverso l’uso di radiofarmaci specifici, la medicina nucleare consente di valutare aspetti funzionali e processi biochimico-metabolici a livello di organi, tessuti e, talvolta, persino a livello cellulare. In generale, un radiofarmaco è costituito da una combinazione di un radionuclide, responsabile del segnale rilevabile dall’esterno del corpo, e un composto che determina le proprietà biologiche della molecola.
Oltre alla classificazione basata sulla loro struttura chimica, meccanismo di localizzazione e potenziale azione terapeutica, i radiofarmaci possono essere categorizzati in base al tipo di visualizzazione che producono in un’applicazione diagnostica specifica, che può essere “positiva” o “negativa”. In particolare, un radiofarmaco indicatore positivo si accumula in modo selettivo nei siti di processi patologici, evidenziando direttamente la sede dell’alterazione metabolica specifica. Al contrario, un radiofarmaco indicatore negativo si accumula nei tessuti normali e funzionanti dell’organo, evidenziando il processo patologico come un’area di mancata captazione. Va notato che questa distinzione non è sempre rigida, poiché alcuni radiofarmaci possono comportarsi sia come indicatori positivi che negativi, a seconda dell’applicazione.
Ad esempio, in campo tiroideo, il radioiodio o il 99mTc-Pertecnetato sono indicatori negativi per i noduli tiroidei non funzionanti (“freddi”), ma diventano indicatori positivi in caso di iperfunzione tiroidea, sia nodulare che diffusa. Allo stesso modo, alcuni radiofarmaci utilizzati nella scintigrafia miocardica di perfusione, come il 99mTc-Sestamibi e il 201Tl-Cloruro, possono essere indicatori negativi quando evidenziano un deficit di perfusione miocardica e positivi quando localizzano lesioni focali ipermetaboliche, come adenomi paratiroidei o altre lesioni tumorali.
Inoltre, il radiofarmaco PET [18F]Fluoro-2-deossiglucosio ([18F]FDG) può essere utilizzato sia come indicatore negativo, per visualizzare aree di sostanza grigia con metabolismo ridotto nel Sistema Nervoso Centrale, sia come indicatore positivo, per visualizzare lesioni neoplastiche con un elevato consumo di glucosio.
I radiofarmaci vengono somministrati in quantità molto inferiori rispetto ai mezzi di contrasto utilizzati in radiodiagnostica e non devono essere confusi con questi ultimi. Durante una singola scansione TC con mezzo di contrasto, ad esempio, la quantità di iodio somministrata può essere di diversi grammi, mentre i radiofarmaci sono somministrati in quantità che raramente superano i pochi milligrammi, più spesso frazioni di milligrammo. Queste quantità ridotte di radiofarmaci di solito non causano perturbazioni significative nei sistemi biologici studiati, ma in rari casi possono verificarsi reazioni di idiosincrasia. Inoltre, per alcuni radiofarmaci utilizzati a scopi terapeutici, le quantità somministrate possono essere più elevate e richiedere monitoraggio dei parametri vitali come la pressione arteriosa e la frequenza cardiaca.
Va notato che la somministrazione di radiofarmaci costituiti da macromolecole eterologhe, come gli anticorpi monoclonali marcati di origine murina, può innescare risposte immunitarie nei pazienti, aumentando il rischio di reazioni collaterali avverse in caso di somministrazioni successive.
La maggior parte dei radionuclidi utilizzati in medicina nucleare emette raggi gamma, consentendo la produzione di immagini scintigrafiche sia planari che tomografiche attraverso la tecnica di Single Photon Emission Computed Tomography (SPECT).
Nel campo delle applicazioni diagnostiche, i principali radionuclidi utilizzati includono gli isotopi dello iodio, del tecnezio, dell’indio, del gallio e del tallio. Questi radioisotopi, tra cui spicca l’iodio-124 con decadimento positronico, insieme ad altri radionuclidi comunemente impiegati in medicina nucleare, vengono sintetizzati e caratterizzati in termini di varie proprietà fisiche, come riassunto nella seguente tabella.
| 123I* | Alogeno | 12,8 | 159 | Emissione anche di β– a bassa energia (elettroni di Auger) |
| 131I | Alogeno | 196,8 | 284, 364, 637 | Emissione anche di β– con energia 606 Kev |
| 125I* | Alogeno | 1440 | 35 | Emissione anche di β– a bassa energia (elettroni di Auger) |
| 99mTc | Metallo di transizione | 6 | 140 | Elevata reattività chimica |
| 111In* | Metalloide | 67,9 | 171, 245 | Emissione anche di β– a bassa energia (elettroni di Auger) |
| 67Ga* | Metalloide | 78,3 | 93, 184, 300 | |
| 201Tl* | Metalloide | 73 | 72, 135, 166, 167 | |
| * Decadimento anche per cattura elettronica, con emissione secondaria di un raggio X caratteristico | ||||
Oltre alle proprietà fisiche del radionuclide stesso, un radiofarmaco può essere classificato in base a vari parametri aggiuntivi:
- Forma Chimica: Ad esempio, il radioiodio può essere somministrato come ioduro di sodio (NaI).
- Radioattività: Viene misurata in Becquerel (Bq), ma talvolta è espressa in Curie (Ci) per conformità ai vecchi standard.
- Attività Specifica: Rappresenta il rapporto tra la radioattività e la quantità di radiofarmaco presente nella preparazione, spesso espressa in moli (MBq/nmole) o microgrammi (MBq/μg).
- Concentrazione Radioattiva: Indica il rapporto tra la radioattività e il volume della soluzione del radiofarmaco, ad esempio, MBq/mL.
- Volume Totale della Soluzione: Specifica la quantità totale di soluzione contenente il radiofarmaco.
I radiofarmaci possono essere costituiti da radionuclidi presenti sotto forma ionica. Ad esempio, lo iodio-123 o lo iodio-131 possono essere somministrati come ioduro di sodio. In alternativa, il tecnezio-99m pertecnetato (99mTcO4–) viene eluito in soluzione fisiologica da un generatore di molibdeno-99. Altri esempi includono il gallio-67 citrato, il fluoro-18 fluoruro, lo stronzio-89 cloruro, il tallio-201 cloruro e il rubidio-82 cloruro. Questi radiofarmaci possono essere utilizzati per applicazioni diagnostiche e terapeutiche poiché alcuni sono identici chimicamente agli elementi nativi nel sistema biologico, mentre altri sono analoghi chimici di elementi normalmente presenti nel corpo.
Nella maggior parte dei radiofarmaci in uso oggi, il radionuclide svolge un ruolo fondamentale nell’abilitare la localizzazione scintigrafica del radiofarmaco all’interno del corpo attraverso l’emissione di raggi gamma o beta. Può anche essere coinvolto nell’azione terapeutica attraverso l’emissione di particelle beta negativa (β–) o, più raramente, particelle alfa (α). Tuttavia, la distribuzione e la localizzazione specifiche in determinate regioni del corpo dipendono dalla sua incorporazione in una molecola più complessa, dotata di proprie caratteristiche farmacocinetiche e farmacodinamiche (destino biologico).
La reazione chimica utilizzata per introdurre un radionuclide all’interno di una molecola più complessa è nota come “reazione di marcatura“. Questo processo può avvenire attraverso la sostituzione diretta di un atomo nativo nella molecola con un isotopo radioattivo. Ad esempio, sostituendo un atomo di iodio nativo (iodio-127) nella L-Tiroxina (un ormone tiroideo che normalmente contiene 4 atomi di iodio) con un atomo di iodio-131, si ottiene un tracciante radioattivo identico alla L-Tiroxina originale. La distribuzione e il metabolismo di questa molecola all’interno del corpo sono quindi identici a quelli della L-Tiroxina prodotta dalla tiroide.
Un esempio più contemporaneo di marcatura radiochimica riguarda la preparazione di radiofarmaci per applicazioni PET (Tomografia ad Emissione di Positroni), in cui atomi non radioattivi in posizioni specifiche nella struttura di sostanze biologicamente rilevanti (come aminoacidi, altri metaboliti o farmaci) vengono sostituiti da atomi emettitori di positroni β+ (ad esempio, ossigeno-15 al posto di ossigeno-16 nativo, carbonio-11 al posto di carbonio-12 nativo, azoto-13 al posto di azoto-14 nativo, e così via). Poiché il radiofarmaco prodotto è chimicamente identico alla sostanza di partenza, è considerato un vero “tracciante“. Dopo l’administrazione al paziente, segue esattamente le stesse tappe metaboliche della sostanza nativa.
Tuttavia, queste indagini sono spesso complesse poiché richiedono correzioni per la concentrazione radioattiva registrata in un tessuto specifico per i metaboliti intermedi e terminali ancora radioattivi che si formano durante il processo di degradazione metabolica del radiofarmaco. Questi metaboliti hanno a loro volta cinetiche di distribuzione e accumulo specifiche.
Nella simbologia radiochimica, la presenza di un radionuclide all’interno di una molecola è indicata racchiudendo il radionuclide tra parentesi quadre, ad esempio, [11C]Colina, [11C]Glucosio, [13N]Ammoniaca, [11C]Timidina, [18F]Fluoro-2-deossiglucosio ([18F]FDG), [18F]Fluorouracile, [125I]Iodo-2’-deossiuridina, e così via.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Quando non è possibile ottenere una molecola chimicamente equivalente alla sostanza biologicamente attiva desiderata attraverso la marcatura, un radiofarmaco può essere creato sostituendo un gruppo funzionale (come -OH– o -CH3) con un radionuclide (come uno ione ioduro o fluoruro) o un gruppo chimico contenente il radionuclide (come –11CH3) che abbia dimensioni e carica elettrica simili a quelle dei gruppi originali e sia posizionato in una parte della molecola che non influenzi significativamente il suo destino biologico (ad esempio, in una zona non biologicamente attiva).
La marcatura radiochimica è tanto più agevole quanto più grande è la molecola bersaglio, un fenomeno comune nelle macromolecole proteiche. Spesso, per scopi di marcatura, si sfrutta la presenza di una tirosina tra gli aminoacidi costituenti della molecola bersaglio, specialmente se posizionata in modo “esposto”. La tirosina può essere facilmente marcabile tramite la radioiodazione. In questo caso, sebbene la struttura finale del peptide possa differire leggermente da quella della molecola originale (a causa della presenza di iodotirosina invece di tirosina), le caratteristiche biochimiche della molecola risultante (ora un radiofarmaco) non sono drasticamente diverse da quelle della proteina originale. Un esempio di questa metodica è la marcatura con radioiodio della sieroalbumina umana, che è stata ampiamente utilizzata in passato sia per studi metabolici sia come indicatore intravascolare.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.
Quando nella molecola bersaglio non sono disponibili gruppi reattivi per l’introduzione del radioiodio, la marcatura può essere eseguita tramite un legame con un radionuclide metallico attraverso una reazione di chelazione. Questo comporta la funzionalizzazione preventiva della molecola bersaglio mediante l’inserimento di un opportuno gruppo chelante, che è in grado di legare il radionuclide desiderato (come il Tecnezio-99m, l’Indio-111, ecc.).
Dal punto di vista della simbologia radiochimica, i radiofarmaci marcanti attraverso queste reazioni (note come reazioni di addizione) sono indicati con il simbolo del radionuclide (senza parentesi quadre) seguito da un trattino e il nome “triviale” della parte restante del radiofarmaco. Ad esempio: 131I-Albumina, 99mTc-Fitato, 99mTc-Macroaggregati di Albumina, 99mTc-Pirofosfato, 111In-Pentetreotide, 68Ga-DOTA-TOC, e così via.
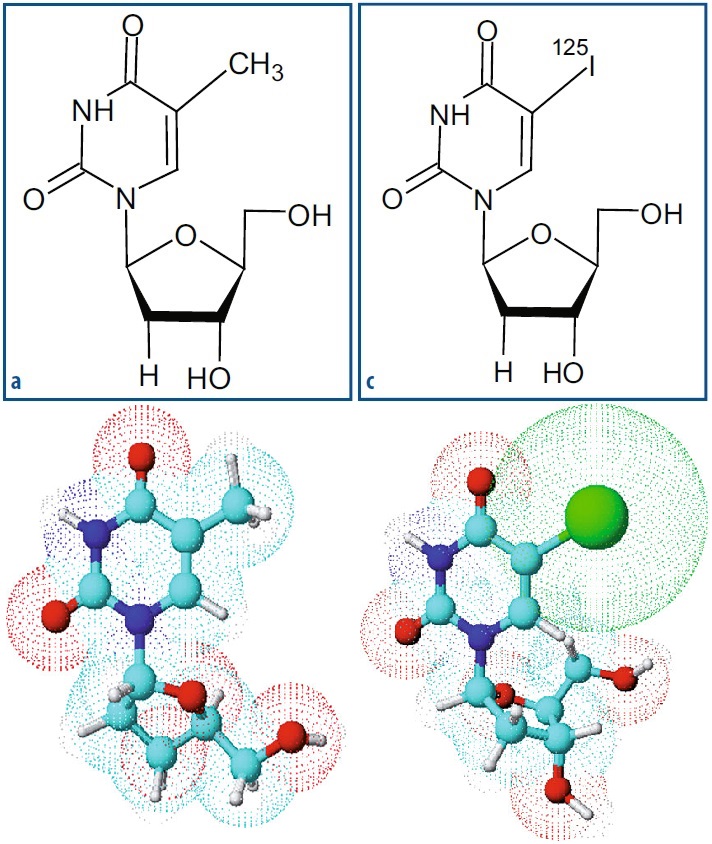
Inizialmente, molti composti radioattivi sviluppati per applicazioni nella medicina nucleare (come radiofarmaci o traccianti per studi metabolici) si basavano sulla marcatura con il radioiodio, in particolare 131I per applicazioni in vivo e 125I per applicazioni in vitro. L’introduzione di un atomo di iodio in una molecola complessa può avvenire attraverso diversi meccanismi, tra cui lo scambio isotopico, la sostituzione nucleofila, la sostituzione aromatica elettrofila e la somma di doppio legame, a seconda della tecnica di marcatura utilizzata.
Uno dei metodi di marcatura radiochimica utilizzati è lo scambio isotopico, che comporta la sostituzione di un atomo non radioattivo, precedentemente presente nella struttura originale della molecola, con un atomo radioattivo dello stesso elemento. In questo processo, l’entità dello scambio è direttamente proporzionale al rapporto molare tra il substrato da marcare e il radioiodio. Ad esempio, un rapporto iniziale di 1:1 tra radioiodio e substrato dovrebbe, in teoria, portare all’incorporazione del 50% del radioiodio, mentre un rapporto di 20:1 dovrebbe risultare nell’incorporazione del 95% del substrato. Questa reazione di marcatura è facilitata dalla presenza di sali di rame(I) e da un ambiente riducente. Tuttavia, è importante notare che, tipicamente, la reazione di marcatura per scambio isotopico produce radiofarmaci con una bassa attività specifica.
Un altro metodo ampiamente utilizzato è la sostituzione nucleofila, che coinvolge la sostituzione di un gruppo funzionale presente nella struttura molecolare originale con un radionuclide in forma anionica, come ioduro, il fluoruro o il cianuro. Questo tipo di marcatura è comunemente usato per composti alifatici ma può anche essere applicato a substrati aromatici. La sostituzione nucleofila tende a produrre radiofarmaci con un’alta attività specifica.
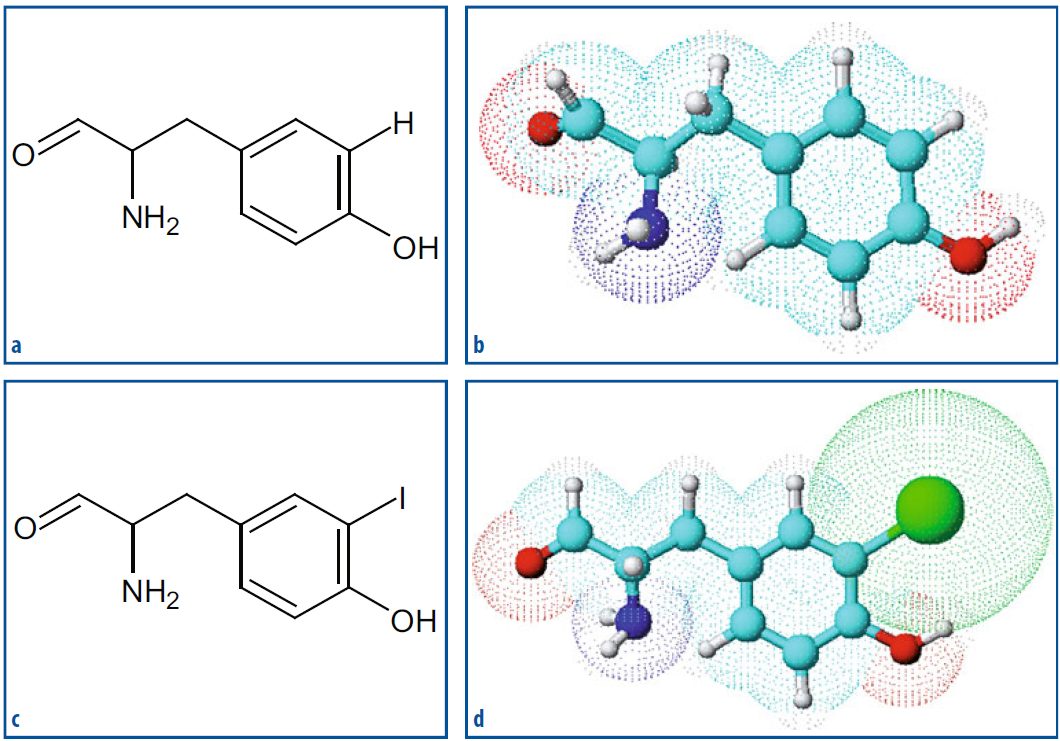
Un metodo efficiente di marcatura radiochimica coinvolge la sostituzione elettrofila aromatica, che si basa sulla sostituzione di un atomo di idrogeno, all’interno di una molecola aromaticamente ricca di elettroni, con un atomo di radioiodio nella forma reattiva I+. Questo metodo è stato inizialmente sviluppato per la radioiodazione dei residui di tirosina nelle proteine, ma è ora ampiamente utilizzato per marcare molecole contenenti anelli aromatici ricchi di elettroni. Le reazioni avvengono in condizioni di pH blande, che evitano la denaturazione delle molecole da marcare, e di solito a temperatura ambiente in presenza di ossidanti. È importante mantenere rigorosamente sotto controllo le condizioni della reazione poiché possono produrre una miscela di isomeri indesiderati. La trasformazione dello ione ioduro I– nella forma reattiva I+ avviene mediante ossidazione in presenza di agenti ossidanti, come la cloramina-T, la dicloramina-T, IODOGEN™, la N-bromosuccinamide o la lattoperossidasi/H2O2.
Quando le proteine o altre macromolecole non contengono residui amminoacidici direttamente marcabili con radioiodio, si può utilizzare il reagente di Bolton-Hunter, chiamato N-succinimidil-3-(4-idrossifenil)-propionato. Questo reagente attiva l’anello fenolico per la radioiodinazione elettrofila, e l’estere attivo N-idrossi-succinamide permette la reazione di coniugazione con i residui amminici presenti nella proteina, spesso quelli delle catene laterali della lisina.
Per la marcatura con 99mTc, possono essere utilizzate due procedure: il metodo diretto e quello indiretto.
Nel metodo diretto, il radiometallo è legato alle molecole sfruttando la capacità coordinante degli atomi di zolfo presenti nella struttura delle molecole. Questi atomi di zolfo spesso svolgono una funzione strutturale all’interno delle macromolecole attraverso la formazione di gruppi disolfuro -S-S- che collegano i segmenti principali.
Il pre-tinning è un metodo relativamente semplice in cui viene utilizzato Sn2+ in elevate concentrazioni per generare gruppi disolfuro liberi e ridurre il pertecnetato.
Altri approcci utilizzano agenti riducenti come il dimercaptoetanolo per scoprire gruppi sulfidrilici senza frammentare la molecola. Tuttavia, questo metodo non offre un controllo preciso sulla regione della molecola a cui si lega il radiometallo.
Nel metodo indiretto, noto anche come metodo per coniugazione, si utilizza un chelante bifunzionale contenente un gruppo chelante (A) per il radiometallo e un gruppo che si lega selettivamente alla molecola bersaglio (B). Questi gruppi sono separati da un linker (C) che riduce l’ingombro sterico del gruppo chelante sulla molecola coniugata. Il radiometallo può essere aggiunto alla molecola da radiomarcare già legata all’agente chelante bifunzionale o complessato prima del legame con la molecola bersaglio. Questo metodo offre maggiore controllo sulla posizione del radiometallo nella molecola.
Per la marcatura con 111In, vengono spesso utilizzati agenti chelanti, come il DTPA o il DOTA, legati a gruppi bifunzionali che fungono da ponte tra l’atomo di indio radioattivo e la macromolecola.
Il Gallio-68 (68Ga) è utilizzato per la marcatura di radiofarmaci PET, come analoghi della somatostatina, impiegando spesso il DOTA come agente chelante già legato al peptide.
Infine, l’Ittrio-90 (90Y) trova applicazioni nella terapia medico-nucleare grazie alle sue particelle β+ ad alta energia. Per marcare macromolecole complesse, come anticorpi monoclonali per la radioimmunoterapia, può essere utilizzato un chelante bifunzionale specifico chiamato tiuxetano.
Fonte: Fondamenti di medicina nucleare. Tecniche e applicazioni.