L’insufficienza renale cronica è un’insufficienza renale sostenuta, progressiva (peggiora gradualmente), globale (insufficienza di entrambi i reni) e irreversibile (non sono disponibili soluzioni per curare l’IRC se non un trapianto di rene) delle funzioni renali come conseguenza di una perdita progresiva e irreversibile del numero di nefroni funzionanti.
L’insufficienza renale cronica non ha espressione clinica fino a quando la perdita dei neuroni funzionanti non supera il 70% dei totali.
I cambiamenti fisiopatologici della IRC si spiegano tramite la teoria dei nefroni intatti, secondo la quale il numero dei nefroni è ridotto, però i rimanenti funzionanti hanno un’attività normale o aumentata per via di un’ipertrofia compensativa.
Nell’insufficienza renale cronica muoiono e spariscono nefroni, la cui attività viene compensata dai nefroni rimanenti che sono costretti a svolgere un lavoro maggiore.
Tutti questi cambiamenti possono essere provocati da molecole vasoattive (come l’angiotensina II), citochine e fattori di crescita che favoriscono la filtrazione glomerulare e le funzioni tubulari.
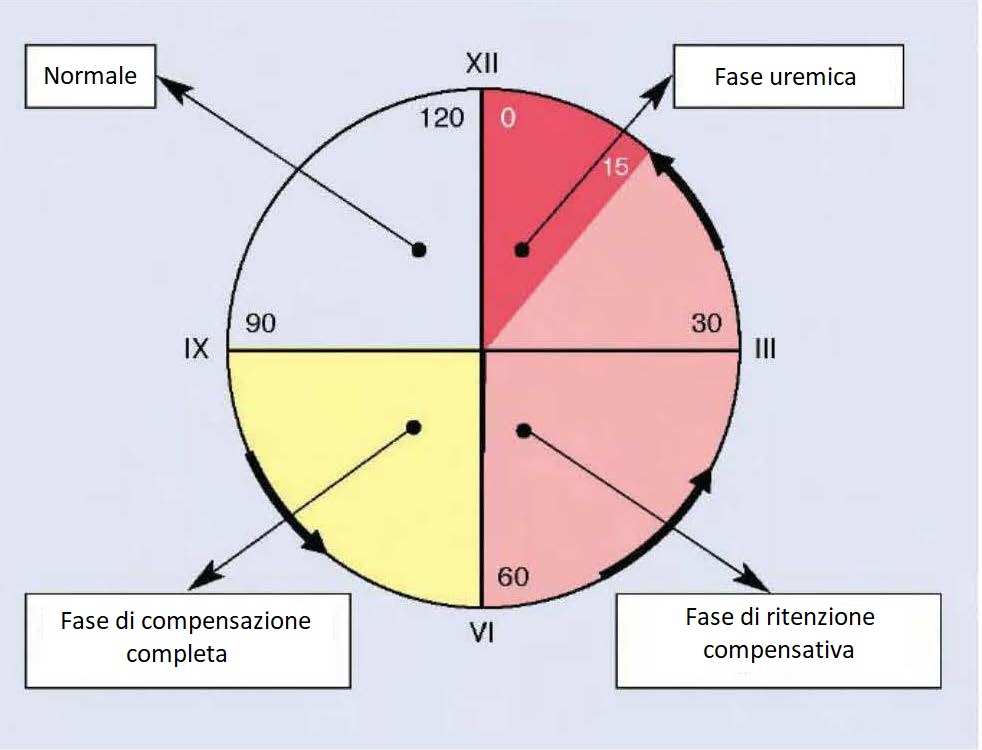
Evoluzioni del processo di IRC
A seconda del numero di nefroni coinvolti e di conseguenza della capacità filtrativa dei glomeruli (GFR) è possibile passare da uno stato di funzionamento normale, quando il filtrato è nel range di normalità, ad uno stato di compensazione completa, ad una fase di compensazione parziale (o di ritenzione compensativa), fino alla fase finale (uremica).
Fase di compensazione completa
In questa fase qualcosa (di origine interna o esterna) inizia ad attaccare il rene che comincia ad adattarsi allo stimolo.
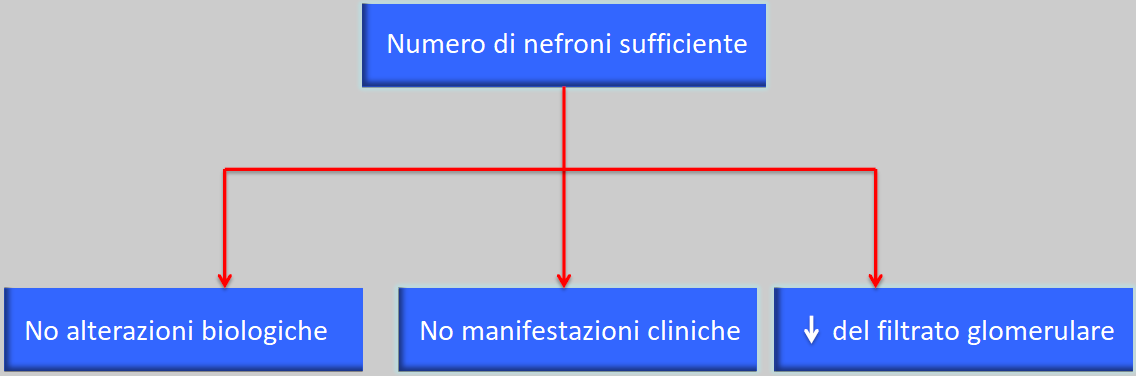
Tuttavia è una fase ancora asintomatica in quanto il numero di nefroni è sufficiente a conservare la funzione normale, senza alterazioni biologiche né manifestazioni cliniche. E’ accompagnata ad una riduzione della filtrazione glomerulare.
Solo la clearance della creatinina può dimostrare la diminuzione della filtrazione glomerulare, indice di una riduzione della riserva funzionale renale. A volte nemmeno la clearance della creatinina è utile perché, quando essa si eleva nel sangue, il rene ha già perso circa il 50% della sua funzione.
La fase di compensazione completa si ha quando la GFR è compresa tra 60 e 90 e corrisponde ad una malattia renale allo stadio 2.
Fase di compensazione parziale
Durante questo periodo, la diminuzione del numero di nefroni altera le funzioni renali. Per questo, se il processo è lento, si stabiliscono dei meccanismi di compensazione (non sempre senza conseguenze) che provano a diminuire le conseguenze della diminuzione della filtrazione glomerulare.
La compensazione consiste, in linee generali, nell’eliminazione della quantità richiesta di prodotti da un minor numero di nefroni. Questo può avvenire solo attraverso due modi: aumentando il carico filtrato e modificando la secrezione e il riassorbimento a livello tubulare.
Aumento del carico filtrato
L’aumento del carico filtrato avviene attraverso l’iperfiltrazione glomerulare. I nefroni intatti soffrono una serie di cambiamenti adattativi in grado di compensare la perdita funzionale dei nefroni danneggiati.
Quindi i nefroni conservati aumentano di volume per ipertrofia dei glomeruli, e aumenta anche il volume e la lunghezza dei tubuli. L’ipertrofia dei glomeruli sani porta ad un aumento dell’area di superficie filtrante e, per tanto, del coefficiente di ultrafiltrazione.

In condizioni normali la pressione intraglomerulare deve mantenersi costantantemente entro determinati limiti. In questo caso viene prodotta una vasodilatazione dell’arteriola afferente e una leggera vasocostrizione dell’arteriola efferente, in modo tale che la pressione intraglomerulare si mantenga costante (come in condizioni di normalità).
Questo, che inizialmente è benefico, mette in moto un secondo meccanismo che risulta pericoloso per l’individuo, provocando l’insufficienza di più glomeruli e quindi riducendo il numero di nefroni funzionanti. Tutto questo è quindi un circolo vizioso che porta a lungo andare ad un peggioramento della funzionalità renale.
Compensazione mediante ritenzione senza attivazione dei tubuli
Affinché possa avvenire la normale eliminazione dei diversi prodotti, è necessario che aumenti la loro concentrazione nel sangue e, per tanto, la quantità presente nel filtrato.
In questo modo avviene l’eliminazione di urea e di creatinina all’aumentare del carico filtrato nei nefroni conservati per aumento della concentrazione plasmatica e anche della quantità di filtrato come conseguenza dell’ipertrofia dei nefroni.
Ogni molecola ha un diverso modo per compensarsi, per esempio, l’urea e la creatinina vengono filtrati attraverso il glomerulo e dopo sono riassorbiti in diversi siti. In questo caso l’unica cosa che avviene è un incremento della concentrazione sia di urea che di creatinina nel plasma.
Non solo aumenta la capacità di filtrazione, ma anche il sangue che arriva in ogni glomerulo ha un’aumentata concentrazione della sostanza e, per tanto, facilita la sua filtrazione e successivamente la sua eliminazione.
 Compensazione tubulare parziale
Compensazione tubulare parziale
In questo caso, all’inizio del periodo, l’eliminazione normale avviene mediante l’adattamento tubulare e solo alla fine è necessario che aumenti la concentrazione nel plasma affinché aumenti il carico filtrato o sia stimolata la funzione tubulare.
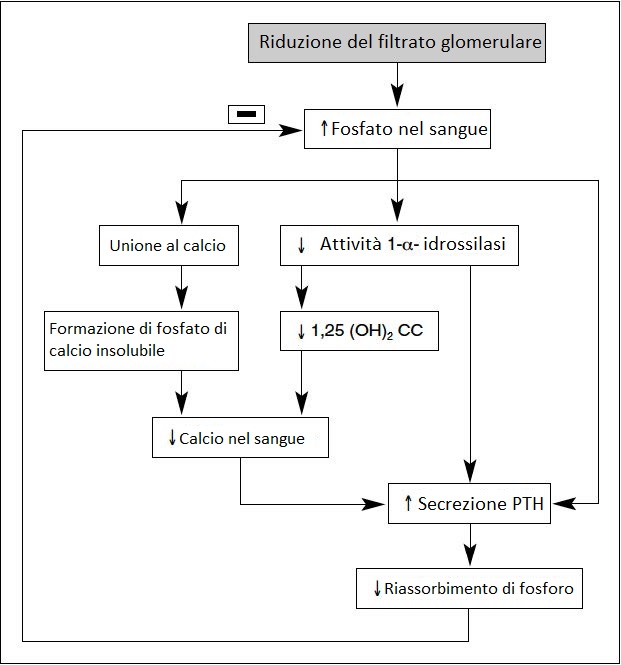
Sono esempi di prodotti soggetti a compensazione tubulare parziale i fosfati, l’acido urico e gli idrogenioni.
Quando il fosforo aumenta nel sangue si mettono in moto una serie di meccanismi che alla fine provocano un aumento della secrezione di PTH (iperparatiroidismo) che fa sì che si riassorba meno fosfato e che aumenti la calcemia.
Il tutto è schematizzato nell’immagine accanto.
Compensazione tubulare totale
Le sostanze per le quali si ottiene questo tipo di compensazione, che sono il sodio, il potassio e l’acqua, sono eliminate in maniera normale fino alla fine del periodo senza modificare la concentrazione plasmatica degli ioni o i livelli di acqua (sempre quando l’apporto di questi è costante ed equilibrato).
Questo meccanismo avviene “forzando” al massimo i meccanismi di compensazione, per cui il paziente si trova in un equilibrio instabile, incapace di rispondere a sovraccarichi di qualsiasi di queste sostanze.
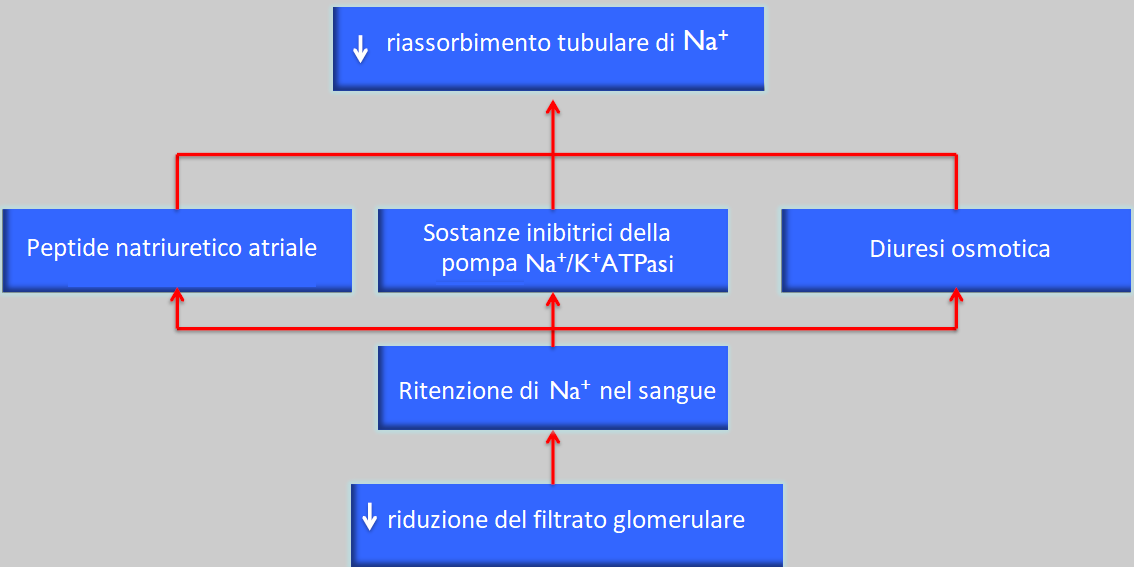
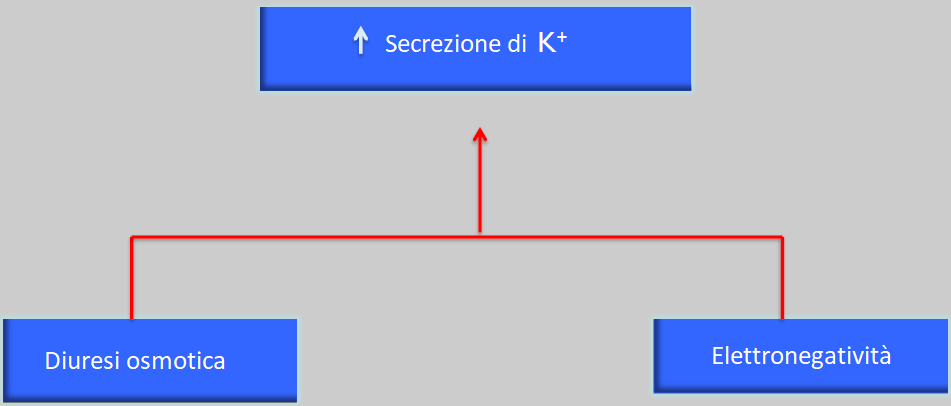
Le conseguenze cliniche di questo periodo di compensazione parziale sono:
- sete, dovuti a problemi di concentrazione delle urine con diuresi osmotica, nicturia e poliuria.
- ipertensione sanguigna dovuta alla ritenzione di sodio e acqua.
- anemia causata da una riduzione nella produzione di eritropoietina.
- osteodistorfia renale per alterazioni nel metabolismo dei minerali.
Periodo uremico
Il periodo uremico subentra quando il numero di nefroni intatti è al minimo. In queste circostanze il rene è incapace di svolgere le sue funzioni nonostante i meccanismi di compensazione precedenti.
Le ripercussioni negative sull’organismo sono notevoli e ci sono diversi meccanismi in grado di spiegarle: ritenzione di sostanze proteiche, alterazioni idroelettricolitiche dell’equilibrio acido-base, effetti negativi dei meccanismi compensatori e fallimento delle funzioni endocrine e metaboliche.
Ritenzione di sostanze proteiche
Il termine uremia venne adottato inizialmente basandosi nella supposizione che la maggior parte delle manifestazioni cliniche erano il risultato dell’azione tossica dei prodotti dell’urea trattenuti nel sangue.
Tuttavia, i livelli sierici di urea sono correlati in forma inconsistente con i sintomi dell’uremia, per cui si è cercato di identificare oltre possibili tossine uremiche.
Le vere tossine uremiche sono le molecole trattenute nel sangue a causa dell’insufficienza renale, alcune delle quali possono essere eliminate mediante i processi di dialisi.
Tra queste sostanze abbiamo le guanidine (responsabili dell’alterazione leucocitaria, convulsioni e vasocostrizione), le purine (vasocostrizione e lesione endoteliale), la leptina (anoressia), la gastrina, CCK-PZ e glucagone (alterazioni digestive), β-endorfine, fattori leucoattivi e fattori del complemento (prurito, alterazione leucocitaria e attività autoimmune), omocisteine e poliammine (alterazione tiroidea, aterosclerosi e inibizione dell’eritropoiesi).
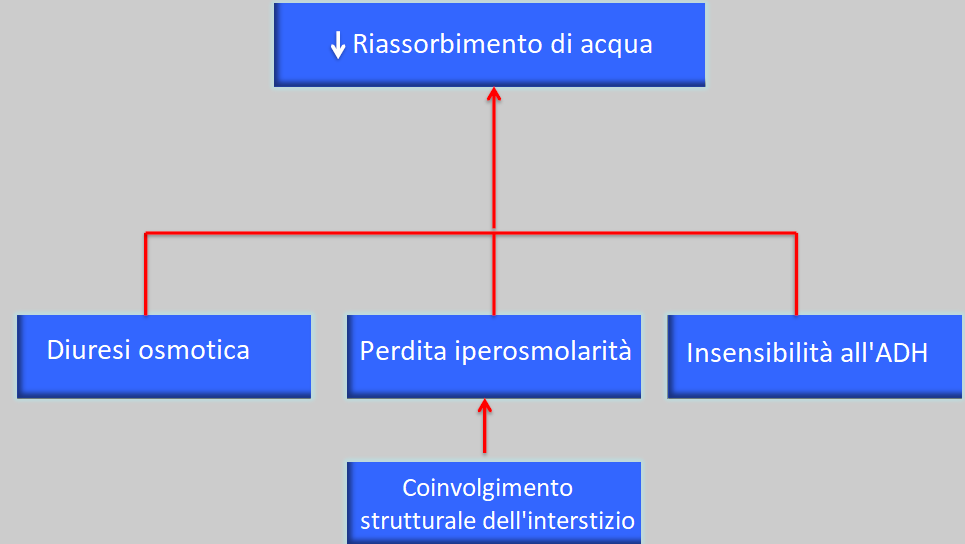
Alterazioni idroelettrolitiche e dell’equilibrio acido-base
Esiste un’anomalia del mezzo interno, i dati biochimici patologici sono gli stessi del periodo precedente ma più intensi.
Le problematiche nel concentrare le urine provocheranno nicturia e poliuria e pertanto sete.
La ritenzione di acqua è responsabile dell’ipertensione arteriosa e della formazione di edemi.
La ritenzione di potassio provocherà un’iperpotassiemia con alterazioni nella funzionalità cardiaca.
La ritenzione di acidi determinerà acidosi metabolica.
Effetti negativi dei meccanismi compensatori
Questi meccanismi, che inizialmente apportano benefici, possono portare ad effetti nocivi quando permangono per molto tempo.
L’esempio più dimostrativo è l’iperparatiroidismo secondario che tende a normalizzare la calcemia e favorisce l’eliminazione del fosfato. Tuttavia, l’aumento sconsiderato del paratormone PTH ha molteplici conseguenze nocive e portare all’osteite fibrosa cistica. Fortunatamente, al giorno d’oggi esistono terapie che combattono l’iperparatiroidismo secondario.
Fallimento delle funzioni endocrine e metaboliche
Non esiste nessun organo o apparato che non viene colpito quando vi è insufficienza renale. La secrezione insufficiente di eritropoietina contribuisce all’anemia e la riduzione dell’idrossilazione del 25-(OH) vitamina D contribuisce sia all’iperparatiroidismo secondario che alle alterazioni ossee.
I dati biochimici patologici di questo periodo sono: azotemia (aumento di urea e creatinina), iperfosfatemia, ipocalcemia, acidosi metabolica e, occasionalmente, iponatriemia e iperpotassiemia.
Per quanto riguarda il metabolismo intermedio, vi è una alterazione nella regolazione della glicemia (che oscilla tra la resistenza all’insulina con iperglicemia e l’ipoglicemia per deficit di gluconeogenesi) e modificazione nel metabolismo lipidico (aumento dei triacilgliceroli e diminuzione del colesterolo HDL per alterazione funzionale degli enzimi lipoproteinlipasi e LCAT).
Conseguenze cliniche della fase di uremia
Le manifestazioni cliniche dell’uremia sono diverse e colpiscono tutto l’organismo:
- Anemia renale: la soppressione dell’eritropoiesi, l’aumento dell’eritrocateresi e delle perdite (causate dalla dialisi) provocano anemia (normocitica e normocromica). Se il rene è l’organo che produce l’eritropoietina e questo organo smette di funzionare, si ha un’enorme riduzione dei livelli di eritropoietina con conseguenze per quanto riguarda la produzione di emazie a livello del midollo osseo. Inoltre, la poca eritropoietina che viene prodotta non esercita bene la sua funzione, per cui si avranno poche emazie e con una vita media ridotta.
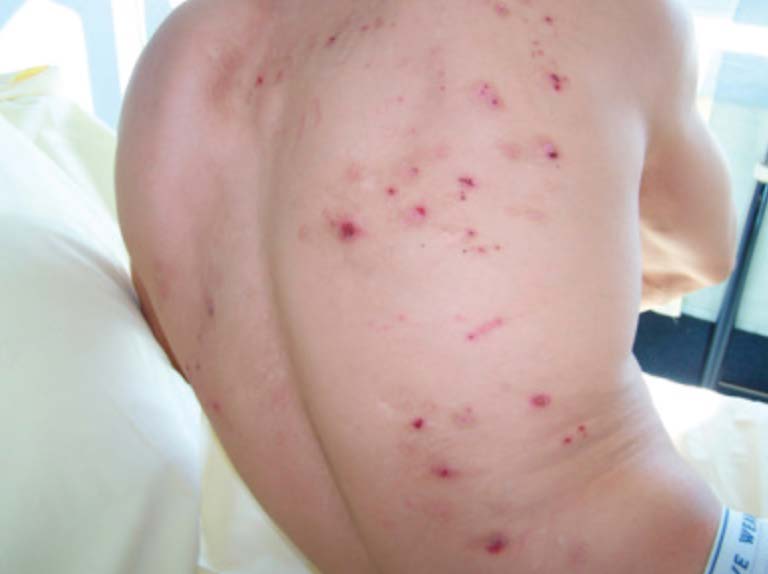 Lesioni cutanee:
Lesioni cutanee:
- pelle pallida e “terrosa”;
- scomparsa della lunula delle unghie, anche se a volte può aumentare;
- lesioni da graffio a causa del prurito provocato dall’accumulo di sostanze eliminate tramite la pelle;
- gelo uremico;
- ecchimosi e ematomi;
- lesioni vescicolari (soprattutto a livello delle mani).
- Manifestazioni cardiovascolari: sono la causa più frequente di morbi-mortalità nei pazienti con IRC:
- ipertensione arteriosa (per diminuzione dell’eliminazione di acqua);
- ipertrofia ventricolare;
- insufficienza cardiaca;
- pericardite uremica (casi rari).
- Manifestazioni neurologiche:
- ictus (per maggiore probabilità di arteriosclerosi);
- encefalopatie uremiche (per accumulo delle sostanze nocive non eliminate);
- neuropatia periferica sensitiva e motoria;
- alterazioni del sistema nervoso autonomo.
- Manifestazioni digestive:
- anoressia;
- nausea e vomito;
- malnutrizione proteica-calorica;
- fetore uremico (odore di ammoniaca nella saliva);
- gengivostomatite, gastrite;
- duodermite;
- ulcera peptica;
- angiodisplasia (malformazione che causa la dilatazione e fragilità vascolare nel colon).
- emorragie digestive occulte;
- diverticolite.
- Manifestazioni polmonari:
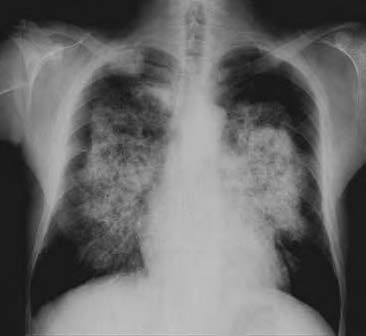
- edema polmonare di origine cardiaca (per l’ipertensione);
- edema polmonare di origine non cardiaca (per aumento della permeabilità capillare);
- polmone uremico;
- infezioni respiratorie frequenti;
- fibrosi e calcificazioni parenchimatose.
- Manifestazioni endocrine:
- aumento di FSH, LH e LH-RH;
- diminuzione del testosterone e progesterone (amenorrea);
- iperprolattinemia, possibile galattorrea;
- diminuzione di T3, T4 e TSH normale;
- resistenza al GH.
- Manifestazioni metaboliche:
- aumento dei trigliceridi;
- diminuzione di colesterolo HDL;
- ipoglicemia;
- diminuzione della sintesi proteica;
- aumento del catabolismo proteico;
- acidosi metabolica.
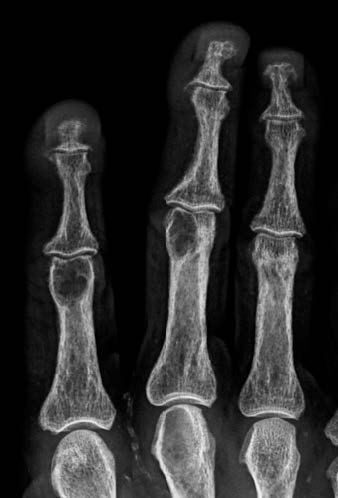 Osteodistrofia renale: si riferisce all’insieme delle lesioni ossee che risultano dalle alterazioni del metabolismo minerale causato dai meccanismi di compensazione. Queste includono:
Osteodistrofia renale: si riferisce all’insieme delle lesioni ossee che risultano dalle alterazioni del metabolismo minerale causato dai meccanismi di compensazione. Queste includono:
- iperparatiroidismo secondario, caratterizzato dal ricambio osseo accelerato, aumento del numero e attività degli osteoclasti e osteoblasti e aumento del riassorbimento osseo che comporta le tipiche lesioni dell’osteite fibrosa cistica;
- osteomalacia, con ricambio osseo basso (osso più fragile), diminuzione del numero degli osteoblasti e degli osteoclasti e aumento del volume dell’osteoide non sufficientemente calcificato;
- osteopatia dinamica, tipo di osteodistrofia renale con ricambio osseo lento, come la osteomalacia, in cui però la formazione di osteoide non è aumentata.
Fonte: Minerva Manuale di nefrologia.




