Fonte: Manuale di Nefrologia.
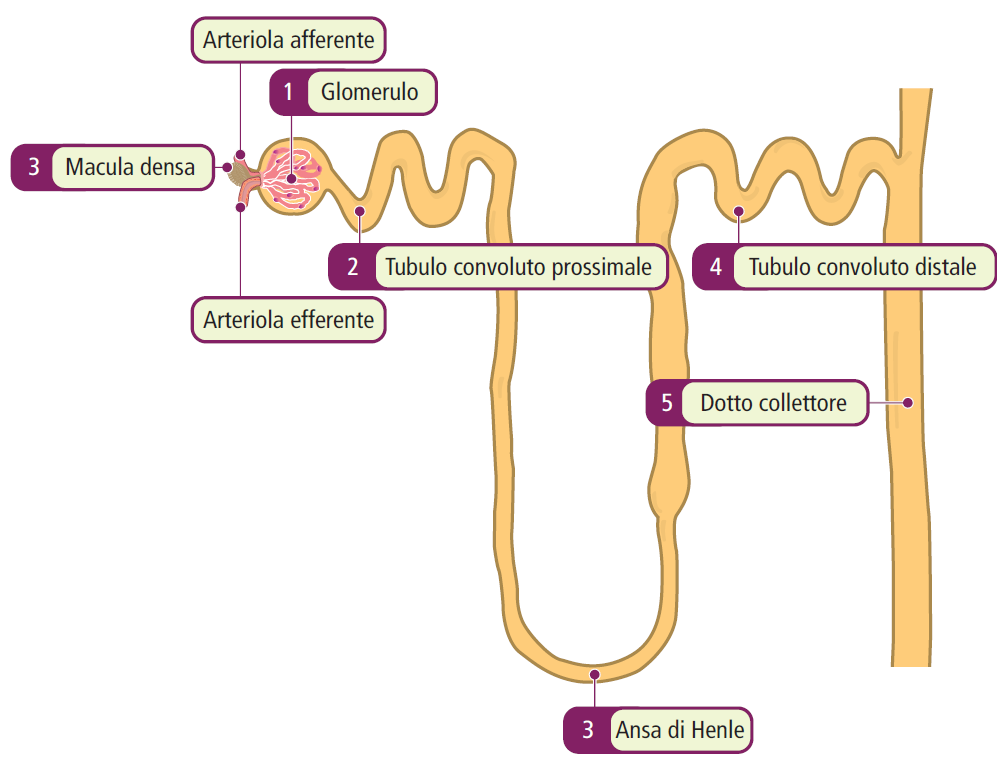
I reni rappresentano due organi retroperitoneali, ciascuno con una dimensione approssimativa compresa tra 10 e 12 cm e un peso di circa 150 grammi. L’unità funzionale fondamentale del rene è il nefrone, e ne è presente circa un milione in ciascun rene. Ogni nefrone è costituito da cinque componenti principali: il glomerulo, il tubulo prossimale, l’ansa di Henle, il tubulo distale e il dotto collettore.
Glomerulo
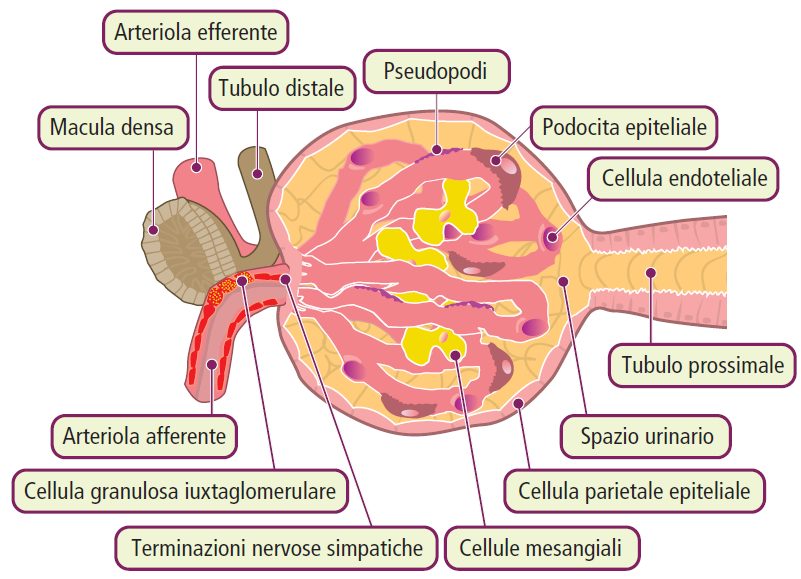
Nella corteccia renale risiedono i glomeruli, intricati agglomerati di capillari rivestiti da cellule endoteliali e intervallati da cellule mesangiali (dal greco “meso” che significa “in mezzo” e “angio” che significa “vasi”). Questi capillari derivano dall’arteriola afferente e si riuniscono successivamente per formare l’arteriola efferente, rendendo così il rene suscettibile a vari mediatori vascolari, come quelli del sistema renina-angiotensina-aldosterone (SRAA).
Fonte: Manuale di Nefrologia.
Le cellule mesangiali, che agiscono anche come macrofagi, svolgono diverse funzioni, tra cui la regolazione del tono vascolare dei capillari glomerulari e la produzione della matrice mesangiale.
La matrice glomerulare si trova all’interno della capsula di Bowman, composta da due strati di epitelio: uno viscerale e uno parietale. Le cellule epiteliali viscerali, note come podociti, formano uno spazio di filtrazione tra i due strati epiteliali, attraverso il quale passa il filtrato glomerulare. In alcune condizioni patologiche, questo spazio può essere occupato da semilune a seguito della proliferazione delle cellule epiteliali, un segno di grave danno glomerulare.
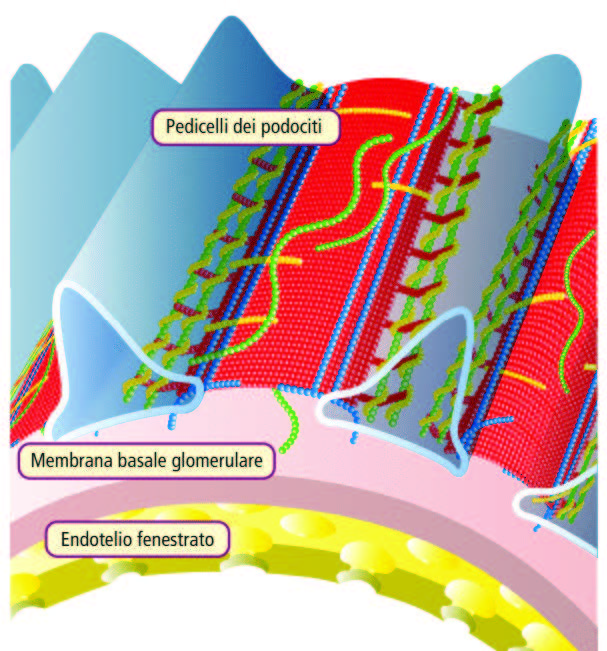
L’inizio della formazione dell’urina avviene attraverso la barriera di filtrazione glomerulare, composta da tre strati:
Fonte: Manuale di Nefrologia.
- L’endotelio fenestrato;
- La membrana glomerulare;
- I podociti.
La membrana basale glomerulare separa due spazi rilevanti per la localizzazione degli immunocomplessi che possono depositarsi nelle glomerulopatie: lo spazio subendoteliale (tra le cellule endoteliali e la membrana basale) e lo spazio subepiteliale (tra la membrana basale e i podociti).
Questa suddivisione contribuisce a comprender meglio le connessioni tra i meccanismi patogenetici, le caratteristiche patologiche e le manifestazioni cliniche delle glomerulopatie.
La velocità di filtrazione glomerulare (VFG) o glomerular filtration rate (GFR) è influenzata dalla discrepanza tra le pressioni idrostatiche e oncotiche presenti ai due lati della barriera di filtrazione.
L’equazione per la VFG è la seguente:
VFG = (PG – PB) – (πG – πB)
Dove:
- VFG: Velocità di filtrazione glomerulare;
- P: Pressione idrostatica;
- π: Pressione oncotica;
- G: Capillare glomerulare;
- B: Capsula di Bowman.
La VFG aumenta quando:
- La pressione intracapillare aumenta (ad esempio, contrazione dell’arteriola efferente);
- La concentrazione di proteine nel plasma diminuisce.
I fattori principali che influenzano il passaggio delle molecole attraverso la barriera di filtrazione includono il peso molecolare (le molecole più grandi hanno una maggiore difficoltà nel passaggio) e la carica ionica (dato che la membrana basale glomerulare ha una carica negativa, le molecole cariche negativamente hanno maggiore difficoltà nel passaggio). Molecole come l’albumina, che ha un peso molecolare di 69 kDa e una carica negativa, vengono filtrate solo in minima misura.
Tra l’arteriola afferente ed efferente si trova il tubulo distale presso il polo vascolare. Le cellule coinvolte includono la macula densa, parte dell’apparato iuxtaglomerulare, che contiene cellule secernenti la renina. La funzione di queste cellule è regolare la GFR in base alla concentrazione di sodio che raggiunge il tubulo distale (feedback tubulo-glomerulare).
Tubulo convoluto prossimale
Il tubulo convoluto prossimale rappresenta la regione chiave del rene dove avviene il riassorbimento di una considerevole quantità di piccoli soluti filtrati. Qui avviene il recupero di circa il 60% di sodio, potassio, calcio e acqua e più del 90% di bicarbonato e la totalità del glucosio e degli amminoacidi. Da segnalare sono le eccezioni costituite dallo iodio e dal magnesio, che vengono principalmente riassorbiti nell’ansa di Henle. In questo modo, il tubulo prossimale gioca un ruolo cruciale nel mantenere l’equilibrio elettrolitico e l’omeostasi del corpo attraverso un efficiente processo di riassorbimento.
Ansa di Henle
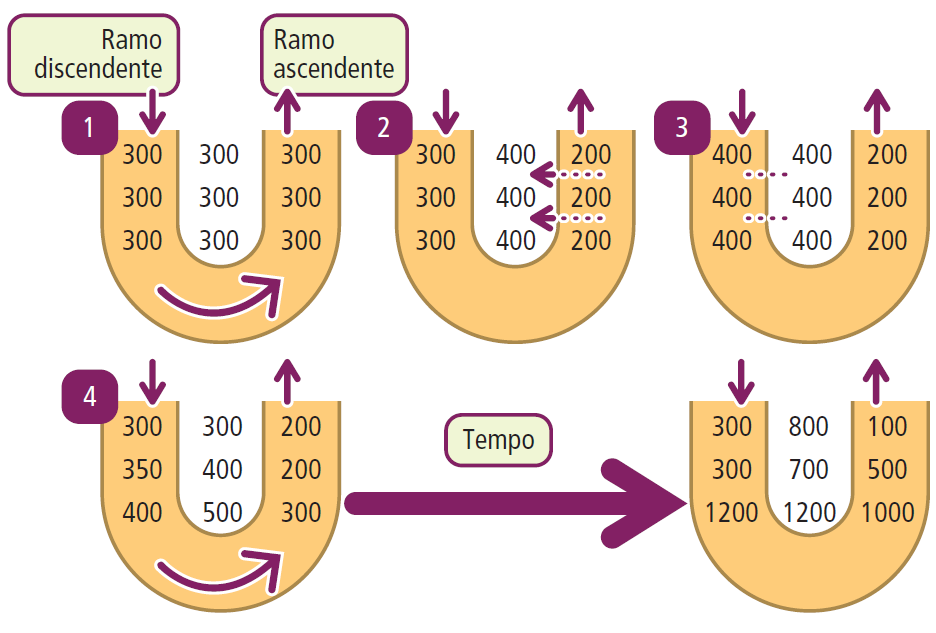
L’ansa di Henle, una sezione a forma di “U” del tubulo renale, si estende dalla corticale fino alla midollare renale. Questa struttura è composta da due segmenti: uno discendente sottile e uno ascendente spesso, che è impermeabile all’acqua e ospita il trasportatore NKCC (Na, K, 2 Cl), sensibile all’azione di diuretici dell’ansa come il furosemide.
Fonte: Manuale di Nefrologia.
L’ansa di Henle è il sito del meccanismo di moltiplicazione controcorrente, che sfrutta le diverse permeabilità all’acqua e al sodio dei due segmenti. Questo processo genera un gradiente osmotico cortico-midollare, con valori che aumentano dai circa 300 mOsm/L nella corticale (simili all’osmolarità plasmatica) fino a raggiungere i 1300 mOsm/L nella profonda midollare. Questo gradiente osmotico è essenziale per il riassorbimento dell’acqua nel tratto discendente dell’ansa, garantendo così la concentrazione delle urine.
Come conseguenza di questo fenomeno, l’interstizio diventa gradualmente più “ricco” di elettroliti (e quindi con un’osmolarità maggiore) mentre si passa dalla corticale alla midollare.
Le mutazioni che inattivano il canale NKCC, simulando l’effetto di un trattamento cronico con diuretici dell’ansa, sono correlate alla sindrome di Bartter.
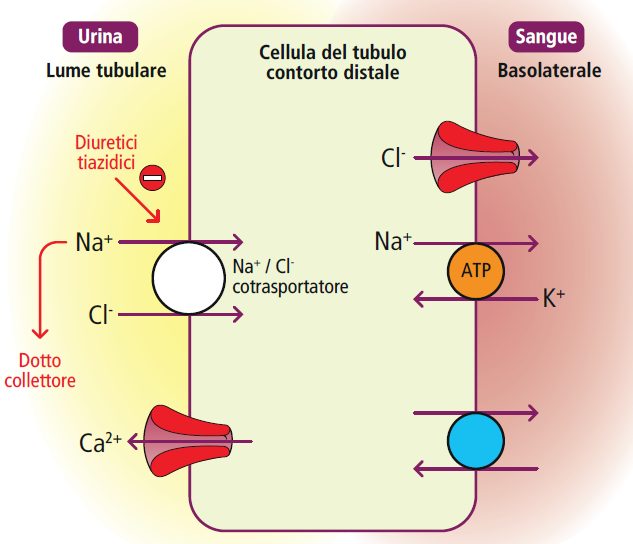
Tubulo convoluto distale
Fonte: Manuale di Nefrologia.
Nel tubulo convoluto distale, avviene il riassorbimento di circa il 5-10% del sodio filtrato tramite un meccanismo di simporto Na-Cl. Questo canale è bersaglio dell’azione dei diuretici tiazidici come clortalidone e idroclorotiazide.
La sindrome di Gitelman, causata da una mutazione inattivante il cotrasportatore Na-Cl tiazido-sensibile, replica gli effetti di un trattamento cronico con tiazidici. Questo blocco del cotrasporto Na-Cl modifica la polarità cellulare, innescando un riassorbimento di calcio attraverso canali apicali specifici. Ecco perché i diuretici tiazidici sono utilizzati per condizioni con ipercalciuria, come calcolosi renale a base di calcio e sarcoidosi.
Tra gli effetti collaterali dei diuretici tiazidici vi è un’induzione di alcalosi metabolica ipokaliemica, simile a quella causata dall’uso di diuretici dell’ansa.
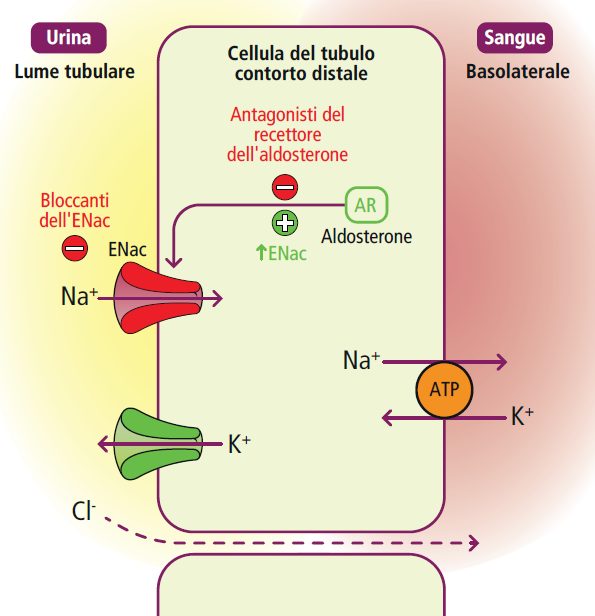
Segmento connettore del tubulo
Fonte: Manuale di Nefrologia.
Il segmento connettore del tubulo rappresenta l’interconnessione tra la parte più distale del tubulo convoluto distale e la porzione corticale del dotto collettore. Qui entra in gioco l’aldosterone, che stimola il riassorbimento del sodio (e quindi dell’acqua) e promuove l’escrezione di potassio e ioni idrogeno.
Nelle condizioni di ipovolemia efficace, come nella grave disidratazione (ad esempio, diarrea o uso eccessivo di diuretici) o nello scompenso cardiaco, il rene attiva il sistema renina-angiotensina-aldosterone (SRAA). A causa dell’aumento della consegna di sodio a questo livello indotto dai diuretici dell’ansa e tiazidici, l’aldosterone intensifica il riassorbimento di sodio, comportando una maggiore escrezione di potassio e ioni idrogeno. Questa cascata di eventi conduce in definitiva a un’alcalosi metabolica ipopotassiemica.
Nel tubulo corticale, agiscono i diuretici risparmiatori di potassio. Lo spironolattone riduce l’espressione dei recettori dell’aldosterone, mentre l’amiloride e il triamterene inibiscono direttamente il riassorbimento del sodio e promuovono l’escrezione di potassio e ioni idrogeno.
Dotto collettore
Il dotto collettore, sia nella regione corticale (segmento connettore del tubulo) sia nella zona midollare, è il luogo in cui si verifica il riassorbimento dell’acqua, principalmente sotto l’influenza dell’ormone antidiuretico (ADH).
In assenza di ADH, il dotto collettore è impermeabile all’acqua, consentendo l’escrezione di un grande volume di acqua priva di soluti. In contrasto, l’azione dell’ADH, rilasciato dall’ipotalamo, causa un aumento dell’espressione di acquaporine specifiche (tramite i recettori renali V2). Queste acquaporine mediano il riassorbimento dell’acqua senza coinvolgere il riassorbimento di altre molecole. Il processo di riassorbimento dell’acqua a questo livello ha un ruolo cruciale nella determinazione dell’osmolarità delle urine; più acqua viene riassorbita, maggiormente le urine saranno concentrate.
In Italia, è disponibile un farmaco chiamato tolvaptan, che agisce come un antagonista recettoriale competitivo dell’ADH. Questo farmaco è indicato nel trattamento della sindrome da inappropriata secrezione di ADH e, in alcune circostanze specifiche, per il rallentamento della progressione dell’insufficienza renale cronica nei pazienti con rene policistico autosomico dominante (ADPKD).



