La miastenia gravis è una patologia caratterizzata da una riduzione del numero di recettori post-sinaptici dell’acetilcolina (AChR) nella placca neuromuscolare, con una base immuno-mediata.
Nell’80% dei casi, tale riduzione è causata dalla presenza di anticorpi anti-AChR, mentre nel 5-10% dei casi è dovuta agli anticorpi contro la chinasi muscolo-specifica (anti-MuSK). Recentemente, sono stati identificati anche anticorpi anti-LRP4, anti-titina e anti-recettore per la rianodina come possibili cause della malattia. Tuttavia, nel 10% dei pazienti non sono stati rilevati nessuno dei suddetti anticorpi noti.
Alcuni fattori di rilievo correlati alla miastenia gravis includono:
- Anamnesi familiare negativa.
- Associazione con altre malattie autoimmuni nel 10% dei casi, come l’ipertiroidismo, il lupus eritematoso sistemico, l’artrite reumatoide, il pemfigo, la polimiosite e la sarcoidosi.
- La malattia colpisce più frequentemente le donne rispetto agli uomini (rapporto 3:2).
Molto importante è capire la differenza tra crisi miastenica, miastenia neonatale e sindromi miasteniche congenite:
- Crisi miastenica: un coinvolgimento acuto della muscolatura respiratoria durante la miastenia gravis, che richiede l’intubazione orotracheale e la ventilazione assistita.
- Miastenia neonatale: si verifica quando gli anticorpi della madre miastenica passano al feto. I sintomi clinici, caratterizzati da difficoltà di suzione, compaiono tra il secondo e il terzo giorno dalla nascita e regrediscono dopo circa due settimane.
- Sindromi miasteniche congenite (CMS): si riferiscono a rare patologie ereditarie, autosomiche recessive, caratterizzate da un’alterata trasmissione neuromuscolare dovuta a mutazioni che colpiscono le strutture pre-sinaptiche o post-sinaptiche. Le forme più comuni sono causate da un difetto post-sinaptico dell’AChR.
Eziopatogenesi
FONTE: Manuale di neurologia SSM
Solo il 15% dei pazienti affetti da miastenia gravis presenta un timoma, mentre la maggior parte degli altri pazienti presenta un’iperplasia timica. Nei pazienti con anticorpi anti-MuSK, il timo solitamente risulta sano. Tuttavia, nella miastenia gravis non associata ad anticorpi anti-MuSK, il timo sembra svolgere un ruolo patogenetico attraverso un processo infiammatorio che causa un alterato riconoscimento dell’AChR espresso dalle cellule mioidi timiche, simile a quello presente nella giunzione neuro-muscolare, con la formazione di anticorpi contro entrambi i recettori.
Clinica
La miastenia gravis si manifesta tipicamente con faticabilità muscolare, ossia una progressiva riduzione della forza muscolare durante l’esercizio fisico. Alcuni dei segni clinici associati alla malattia includono:
- Fluttuazioni diurne della forza muscolare, con peggioramento serale e dopo sforzi fisici, e miglioramento dopo il riposo o il sonno.
- Coinvolgimento iniziale della muscolatura oculare, con ptosi (caduta della palpebra) e diplopia (visione doppia).
In alcuni casi, i sintomi possono rimanere limitati all’area oculare (forma oculare pura) e rispondere bene ai farmaci anticolinesterasici, con una prognosi generalmente favorevole. Tuttavia, spesso si verifica anche un coinvolgimento della muscolatura facciale e bulbare, con debolezza nella masticazione, rinolalia (alterazione della pronuncia dei suoni nasali), disartria e disfagia. Nell’85% dei casi, la sintomatologia si generalizza coinvolgendo la muscolatura degli arti. - Nelle forme con anticorpi anti-MuSK, è frequente il coinvolgimento della muscolatura respiratoria, facciale e oro-faringea.
- I reflessi osteotendinei (ROT) sono normali.
- Non sono presenti segni di coinvolgimento del sistema nervoso autonomo.
Diagnosi e diagnosi differenziale
La diagnosi della miastenia gravis si basa sulla valutazione della sintomatologia clinica e viene confermata attraverso una serie di esami complementari. Alcuni dei principali approcci diagnostici includono:
- Test farmacologici con farmaci anticolinesterasici: si valuta il miglioramento dei sintomi clinici dopo la somministrazione di farmaci come la piridostigmina o la neostigmina, che inibiscono l’enzima acetilcolinesterasi (AChE) e aumentano la disponibilità di acetilcolina (ACh) nella sinapsi neuromuscolare. Un esempio di test farmacologico ormai non più utilizzato è il test al tensilon, che prevede l’uso di cloruro di edrofonio.
Attenzione: i test farmacologici possono causare effetti collaterali come bradicardia o episodi sincopali, quindi devono essere eseguiti sotto la supervisione medica adeguata. In presenza degli effetti collaterali si somministra atropina ev. - Dosaggi anticorpali:
- Anticorpi anti-recettore dell’ACh (AChR-Ab): si riscontrano in circa l’80% dei pazienti affetti da miastenia gravis generalizzata e nel 50% dei casi di forma oculare. La presenza di questi anticorpi è diagnostica, ma la loro assenza non esclude la diagnosi. Il titolo anticorpale non è correlato alla gravità della malattia, ma può essere utile per il monitoraggio dell’evoluzione e della risposta al trattamento.
- Anticorpi anti-chinasi muscolo-specifica (MuSK-Ab): questi anticorpi si riscontrano nel 70% dei casi in cui non sono presenti anticorpi anti-AChR.
- Test neurofisiologici:
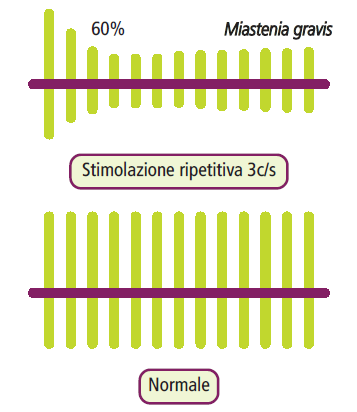
- Stimolazione nervosa ripetitiva: la stimolazione nervosa ripetitiva a bassa frequenza (3 Hz) viene eseguita con elettrodi di superficie e induce una risposta decrementale, ossia una riduzione dell’ampiezza del potenziale d’azione motorio superiore al 10% a partire dal terzo o quarto stimolo. Questo test simula l’affaticamento della giunzione neuromuscolare.
- Elettromiografia di singola fibra: questo test evidenzia un aumento della variabilità di latenza temporale, nota come “jitter“, nella depolarizzazione di due fibre muscolari appartenenti alla stessa unità motoria.
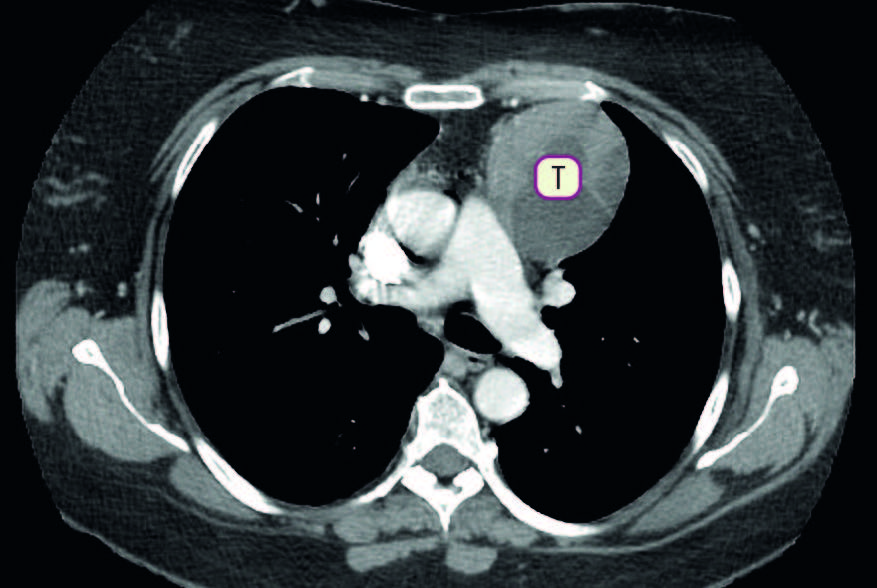
- TC/RM toracica: viene eseguita per escludere la presenza di un timoma, che è associato a una percentuale minoritaria ma significativa di casi di miastenia gravis.
FONTE: Manuale di neurologia SSM.
Durante il processo di diagnosi, è importante escludere altre condizioni che possono presentare sintomi simili alla miastenia gravis. Alcune delle principali condizioni differenziali includono:
- Sindrome di Lambert-Eaton: si differenzia dalla miastenia gravis per la riduzione o l’assenza dei riflessi, la presenza di alterazioni autonomiche e i risultati dei test neurofisiologici (risposta incrementale con aumento dell’ampiezza del potenziale motorio durante la stimolazione ripetitiva ad alta frequenza o dopo lo sforzo).
- Botulismo: si distingue per la presenza di midriasi non reattiva e ptosi bilaterale, seguite rapidamente dall’interessamento della muscolatura bulbare, assiale e degli arti. È comune l’interessamento del sistema nervoso autonomo con sintomi come ritenzione urinaria, ileo paralitico, stipsi, midriasi e scarsa reattività pupillare, nonché secchezza delle fauci.
- Oftalmoplegia esterna progressiva (PEO): si tratta di una miopatia mitocondriale che coinvolge i muscoli oculari estrinseci. Nel sospetto di questa condizione, può essere necessaria una biopsia muscolare per confermare la diagnosi.
- Lesione occupante spazio (LOS cerebrale) che causa diplopia: nel caso di sospetto di una lesione cerebrale che provoca diplopia, è consigliabile eseguire una risonanza magnetica (RM) delle orbite e dell’encefalo.
- Farmaci che causano sindromi miasteniformi: alcuni farmaci come gli antibiotici (aminoglicosidi, macrolidi, chinoloni), i miorilassanti non depolarizzanti (derivati del curaro), gli anestetici locali (procaina, xilocaina, procainamide), i beta-bloccanti, la tossina botulinica e i derivati del chinino (chinidina, clorochina, meflochina) possono causare sintomi simili alla miastenia gravis.
Trattamento
La gestione della miastenia gravis si basa su diverse opzioni terapeutiche:
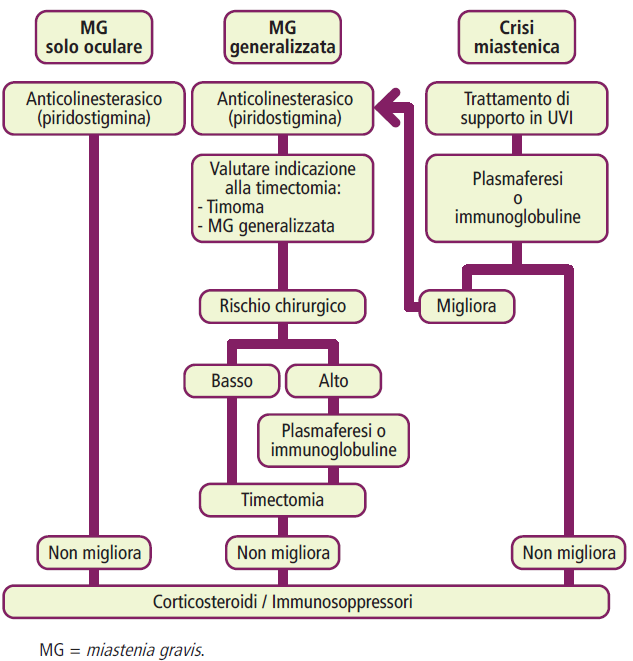
FONTE: Manuale di neurologia SSM.
- Farmaci anticolinesterasici: inibiscono l’enzima acetilcolinesterasi, aumentando la disponibilità di acetilcolina presso la placca neuromuscolare e migliorando così i sintomi della malattia. La piridostigmina, somministrata per via orale ed ampiamente utilizzata in Italia, e la neostigmina, disponibile per via orale o parenterale, sono i farmaci più comuni. Tuttavia, i pazienti con anticorpi anti-chinasi muscolo-specifica (MuSK-Ab) possono rispondere meno a questa terapia. È importante monitorare attentamente i pazienti per evitare il sovradosaggio, che può causare una crisi colinergica con sintomi muscarinici come aumento dell’ipostenia, scialorrea, nausea, diarrea e, nei casi più gravi, broncospasmo, broncorrea, bradicardia e miosi.
- Corticosteroidi: il prednisone è il corticosteroide di prima scelta, anche ad alte dosi in caso di malattia grave, seguito da una graduale riduzione (i pazienti spesso richiedono una dose di mantenimento, talvolta a giorni alterni). Poiché l’inizio della terapia con steroidi può causare un temporaneo peggioramento della debolezza muscolare, è consigliabile monitorare i pazienti in un ambiente ospedaliero. Nei casi di miastenia gravis dipendente dai corticosteroidi, al fine di ridurne il dosaggio e minimizzare gli effetti collaterali a lungo termine, spesso si associano gli immunosoppressori o si utilizzano nei casi di resistenza ai corticosteroidi.
- Immunosoppressori: come azatioprina (prima scelta in Europa), micofenolato mofetile, ciclosporina e, nei casi non responsivi, ciclofosfamide, vengono utilizzati come terapia aggiuntiva. È importante notare che l’azatioprina richiede del tempo (mesi) per mostrare i suoi effetti terapeutici.
- Terapie per la malattia refrattaria: nei casi in cui la miastenia gravis risulti refrattaria alle terapie convenzionali (10-30% dei casi), possono essere considerate opzioni come il rituximab (soprattutto per pazienti con MuSK-Ab). Anche l’eculizumab ha dimostrato benefici sulla debolezza muscolare in alcuni pazienti, ma è costoso e richiede immunosoppressione concomitante. La ciclofosfamide ad alte dosi e il trapianto autologo di cellule staminali emopoietiche sono trattamenti di salvataggio per pazienti con malattia refrattaria grave.
- Plasmaferesi e immunoglobuline EV: vengono utilizzate per le crisi miasteniche o quando è necessario un miglioramento immediato in presenza di grave ipostenia. Tuttavia, va considerato che questi trattamenti hanno un effetto di breve durata.
- Timectomia: è indicata in tutti i casi di miastenia gravis associati a timoma e nelle forme generalizzate positive per gli anticorpi anti-recettore dell’acetilcolina (AChR-Ab) in pazienti tra la pubertà e i 55 anni. Tuttavia, non esiste ancora un consenso definitivo sull’opportunità di raccomandare la timectomia nei bambini, nelle persone di età superiore ai 55 anni e nei pazienti con ipostenia limitata alla muscolatura oculare.
FONTE: Manuale di neurologia SSM



